Comparamos o preço de Victoza - Solução Injetável 6Mg C 2 Sistemas De Aplicação Refrigerado, veja o menor preço

R$ 494,00
RReferência
8
ofertasMelhores preços a partir de R$ 494,00 até R$ 720,60
Oferta patrocinada
vendido por Drogaria São Paulo
economize
31.45%
R$ 494,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Oferta patrocinada
vendido por Drogarias Pacheco
economize
16.35%
R$ 602,80
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Preço Popular
economize
25.89%
R$ 534,07
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogaria Araújo
economize
16.74%
R$ 599,99
vendido por Farma 22
economize
14.65%
R$ 615,00
FRETE REDUZIDO: para a todo o Brasil
vendido por Maranata Medicamentos
economize
14.10%
R$ 618,99
vendido por Drogão Net
economize
2.09%
R$ 705,53
vendido por Oncolog Medicamentos Especiais
R$ 720,60
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Victoza é usado para tratar diabetes mellitus tipo 2 quando dieta e exercício sozinhos já não conseguem controlar seu nível de açúcar no sangue.
Victoza pode ser usado junto com outros medicamentos para diabetes quando estes não são suficientes para controlar seu nível de açúcar no sangue. Estes podem incluir: antidiabéticos orais (como metformina, pioglitazona, sulfonilureia) e/ou insulina basal, que é um tipo de insulina que funciona o dia todo.
Como Victoza funciona?
Victoza contém um princípio ativo chamado liraglutida. Victoza ajuda seu corpo a reduzir seu nível de açúcar no sangue somente quando ele estiver elevado.
Victoza também reduz a velocidade de passagem da comida pelo estômago. A liraglutida tem duração de ação de 24 horas e melhora o controle da glicemia (nível de açúcar no sangue), reduzindo a glicemia em jejum e pós-prandial (após as refeições) de pacientes com diabetes mellitus tipo 2.
Contraindicação
Não use Victoza se você for alérgico (hipersensível) à liraglutida ou a qualquer outro componente de Victoza.
Como usar
Instruções de uso
Leia estas instruções cuidadosamente antes de usar seu sistema de aplicação Victoza.
Seu sistema de aplicação Victoza vem com 18 mg de liraglutida. Você pode selecionar doses de 0,6 mg, 1,2 mg e 1,8 mg.
O sistema de aplicação Victoza foi desenvolvido para ser usado com agulhas descartáveis da Novo Nordisk de até 8 mm de comprimento e tão finas quanto 32G.
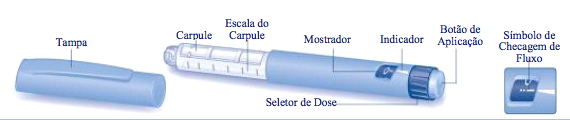
Sistema de aplicação Victoza
Agulha (exemplo)
Preparação do sistema de aplicação Victoza
- Verifique o nome e a cor do rótulo do seu sistema de aplicação para garantir que contenha liraglutida. O uso do medicamento errado pode provocar problemas graves. Tire a tampa do sistema de aplicação.

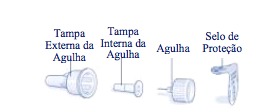
- Remova o selo de proteção de uma agulha descartável nova. Rosqueie a agulha no sistema de aplicação de forma reta e firmemente.
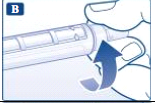
- Tire e guarde a tampa externa da agulha.
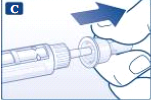
- Tire e descarte a tampa interna da agulha.
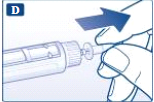
Atenção: Sempre use uma agulha nova para cada aplicação. Isso reduz o risco de contaminação, infecção, vazamento de liraglutida, entupimento da agulha e dose incorreta.
Tome cuidado para não entortar ou danificar a agulha. Nunca tente recolocar a tampa interna da agulha após removê-la. Você pode se ferir com a agulha.
Cuidados com o sistema de aplicação Victoza
- Não tente reparar ou desmontar o sistema de aplicação.
- Mantenha o sistema de aplicação longe de pó, sujeira e todos os tipos de líquidos.
- Limpe o sistema de aplicação com um pano umedecido com sabão neutro.
- Não tente lavar, molhar ou lubrificar o sistema de aplicação – isso pode danificá-lo.
Informações importantes
- Não compartilhe seu sistema de aplicação Victoza ou agulhas com outras pessoas.
- Mantenha o sistema de aplicação Victoza fora do alcance de outras pessoas, especialmente das crianças.
Para cada sistema de aplicação, verifique o fluxo.
Antes de aplicar a injeção com um sistema de aplicação novo, sempre verifique o fluxo. Caso seu sistema de aplicação já esteja em uso, vá para o passo “Seleção da dose” passo H.
- Gire o seletor de dose até que o símbolo de checagem de fluxo fique alinhado com o indicador.

- Segure o sistema de aplicação com a agulha apontada para cima. Bata de leve no carpule com seu dedo algumas vezes. Se houver bolhas de ar, isto fará com que estas se acumulem na parte de cima do carpule.
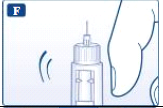
- Mantenha a agulha apontada para cima e aperte o botão de aplicação até que 0 mg fique alinhado com o indicador. Uma gota de liraglutida deve aparecer na ponta da agulha. Se nenhuma gota aparecer, repita os passos E a G por até quatro vezes. Caso ainda não apareça nenhuma gota de liraglutida, troque a agulha e repita os passos E a G mais uma vez. Não utilize o sistema de aplicação se a gota de liraglutida não aparecer. Isso indica que o sistema de aplicação está danificado e você deve usar um novo.
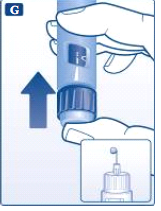
Se você deixou seu sistema de aplicação cair em uma superfície dura ou suspeita que haja algo errado com ele, sempre coloque uma agulha descartável nova e verifique o fluxo antes de aplicar a injeção.
Seleção da dose
Sempre verifique se o indicador está alinhado com 0 mg.

Gire o seletor de dose até que a dose desejada fique alinhada com o indicador (0,6 mg, 1,2 mg ou 1,8 mg). Se você selecionou uma dose errada por engano, simplesmente mude-a, girando o seletor de dose para trás ou para frente, até que a dose certa fique alinhada com o indicador. Tome cuidado para não apertar o botão de aplicação ao girar o seletor de dose para trás, pois a liraglutida pode sair do sistema de aplicação. Se o seletor de dose parar antes da dose necessária se alinhar com o indicador, não há liraglutida suficiente para uma dose inteira. Então, você pode:
Dividir sua dose em 2 aplicações:
Gire o seletor de dose até 0,6 mg ou 1,2 mg ficar alinhado com o indicador e aplique a injeção. Então prepare um novo sistema de aplicação para injeção e injete o número de mg que falta para completar sua dose.
Você somente deverá dividir sua dose entre seu sistema de aplicação atual e o novo caso tenha sido treinado ou aconselhado pelo seu profissional de saúde. Utilize uma calculadora para planejar as doses. Se você dividir sua dose de forma incorreta, você poderá injetar uma dose menor ou maior de liraglutida.
Injetar a dose completa com um novo sistema de aplicação:
Se o seletor de dose parar antes que a dose de 0,6 mg esteja alinhada ao indicador, prepare um novo sistema de aplicação e aplique a dose completa de um novo sistema de aplicação.
Atenção: Não tente selecionar doses diferentes de 0,6 mg, 1,2 mg ou 1,8 mg. Os números no mostrador devem ficar exatamente alinhados com o indicador para assegurar que você receba a dose correta. O seletor de dose faz um clique quando gira. Você não deve usar estes cliques para selecionar a quantidade de liraglutida a ser aplicada. Não use a escala do carpule para medir a quantidade de liraglutida a ser aplicada – esta não é precisa o suficiente.
Injeção da dose
Insira a agulha na sua pele usando a técnica de injeção mostrada por seu médico ou enfermeira. Depois siga as instruções a seguir:
- Pressione o botão de aplicação para injetar, até que 0 mg fique alinhado com o indicador. Tenha cuidado para não encostar seus outros dedos no mostrador ou pressionar o seletor de dose lateralmente quando você estiver injetando, pois isso pode bloquear a injeção. Mantenha o botão de aplicação pressionado para que a agulha fique sob a pele durante pelo menos seis segundos. Isto assegura que você receba sua dose completa.
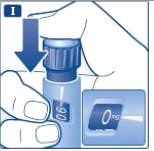
- Retire a agulha. Depois disso, pode aparecer uma gota de liraglutida na ponta da agulha. Isto é normal e não afeta a dose que você acabou de aplicar.
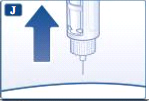
- Coloque a agulha na tampa externa da agulha, sem tocar na agulha ou na tampa externa da agulha.
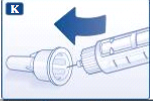
- Quando a agulha estiver coberta, empurre a tampa externa da agulha, com cuidado, completamente para dentro. Então remova a agulha. Descarte a agulha com cuidado e reponha a tampa do sistema de aplicação. Quando o sistema de aplicação estiver vazio, descarte-o com cuidado, sem uma agulha acoplada. Descarte o sistema de aplicação e a agulha de acordo com exigências locais.
?
Atenção: Sempre remova a agulha após cada aplicação, e guarde seu sistema de aplicação Victoza sem uma agulha acoplada.Isto reduz o risco de contaminação, infecção, vazamento de liraglutida, bloqueio da agulha e dose incorreta. Os responsáveis pelo cuidado dos pacientes devem ter muita cautela ao manusear agulhas usadas para prevenir ferimentos com as agulhas e infecção cruzada.
Posologia
Sempre use Victoza exatamente como prescrito por seu médico. Você deve consultar seu médico, enfermeiro ou farmacêutico em caso de dúvida.
- A dose inicial é de 0,6 mg uma vez ao dia por pelo menos uma semana.
- Seu médico lhe dirá quando aumentar a dose para 1,2 mg uma vez ao dia.
- Seu médico pode lhe pedir que aumente a dose para 1,8 mg uma vez ao dia, se sua glicemia não estiver controlada com uma dose de 1,2 mg.
- Não mude sua dose a não ser que seu médico lhe diga para fazer isso.
Victoza é uma injeção para ser aplicada sob a pele (via subcutânea). Não injete em uma veia ou músculo. Os melhores locais para você se aplicar são a frente das coxas, a frente da cintura (abdome), ou a parte superior do braço.
Você pode usar Victoza a qualquer momento do dia, sem se importar com as refeições. Quando você determinar o melhor horário do dia, é preferível que você aplique Victoza por volta do mesmo horário todos os dias.
Antes de utilizar o sistema de aplicação pela primeira vez, seu médico ou enfermeiro irá mostrar para você como usá-lo.
Grupos específicos de pacientes
Idosos (> 65 anos):
Não é necessário ajuste da dose com base na idade. A experiência com pacientes idosos ? 75 anos de idade é limitada.
Pacientes com insuficiência renal:
Para pacientes com insuficiência renal leve, não é necessário ajuste de dose. A experiência com pacientes com insuficiência renal moderada é limitada. Atualmente, Victoza não pode ser recomendado para pacientes com insuficiência renal grave, incluindo pacientes com doença renal terminal.
Pacientes com insuficiência hepática:
A experiência com pacientes com insuficiência hepática é muito limitada para recomendar o uso em pacientes com insuficiência hepática leve, moderada ou grave.
Crianças e adolescentes:
Victoza não é recomendado para pacientes abaixo de 18 anos de idade devido à falta de dados.
Se você parar de usar Victoza:
Não pare de usar Victoza sem conversar com seu médico. Se parar de usá-lo, seu açúcar no sangue pode aumentar.
Se você tiver dúvidas sobre como usar este medicamento, pergunte ao seu médico, enfermeiro ou farmacêutico.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que eu devo fazer quando eu me esquecer de tomar Victoza?
Se você esquecer uma dose, use Victoza assim que se lembrar.
Porém, se houver passado mais de 12 horas desde quando você deveria ter usado Victoza, pule a dose esquecida. Então, aplique a próxima dose no dia seguinte normalmente.
Não tome uma dose extra ou aumente a dose no dia seguinte para compensar a dose perdida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Leia atentamente esta bula antes de iniciar o uso deste medicamento.
- Guarde esta bula. Você pode precisar lê-la novamente.
- Se você tiver dúvidas adicionais, consulte seu médico, enfermeira ou farmacêutico.
- Este medicamento foi prescrito para você. Não o dê para outras pessoas, pois poderá causar danos até mesmo se os sintomas forem os mesmos que os seus.
- Se qualquer um dos efeitos colaterais piorar ou se você notar qualquer efeito colateral não mencionado nesta bula, informe seu médico, enfermeira ou farmacêutico.
Tenha cuidado especial com Victoza, converse com seu médico, farmacêutico ou enfermeiro:
- Antes de usar Victoza.
- Se você tiver ou já teve doença no pâncreas.
Victoza não deve ser usado se você tiver diabetes tipo 1 (seu organismo não produz nenhuma insulina) ou cetoacidose diabética (uma complicação do diabetes, que apresenta alta concentração de açúcar no sangue e aumento de esforço para respirar). Victoza não é uma insulina, portanto não deve ser usado como um substituto para insulina.
Não há experiência com Victoza em pacientes com problemas renais graves. Se você tiver doença renal grave ou realiza diálise, consulte seu médico.
Existem poucas experiências com Victoza em pacientes com problemas hepáticos. Victoza não é recomendado se você tiver doenças hepáticas.
Existem raras experiências com Victoza em pacientes com insuficiência cardíaca. Victoza não é recomendado se você tiver insuficiência cardíaca grave.
Victoza não é recomendado se você tiver problema estomacal ou intestinal grave que resulte no atraso do esvaziamento estomacal (chamado de gastroparesia), ou se tiver doença inflamatória intestinal.
Se você tiver sintomas de pancreatite aguda, como dor abdominal grave e persistente, você deve consultar seu médico imediatamente.
Se você tiver doença da tiroide incluindo nódulos na tiroide e aumento da glândula tiroide, consulte seu médico.
Quando iniciar o tratamento com Victoza, em alguns casos, você pode apresentar perda de fluidos/desidratação, por exemplo, em caso de vômito, náusea e diarreia. É importante evitar a desidratação bebendo bastante líquido. Contate seu médico se você tiver dúvidas.
Crianças e adolescentes:
Victoza não deve ser usado em crianças e adolescentes abaixo de 18 anos.
Dirigindo e operando máquinas:
Enquanto estiver dirigindo ou usando ferramentas ou máquinas, você deve evitar que o nível de açúcar no sangue fique muito baixo (hipoglicemia), pois isto pode reduzir sua capacidade para concentrar-se. Seu médico lhe dirá como fazer isto.
Gravidez e Amamentação
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Converse com seu médico se estiver grávida, se acha que pode estar grávida, ou se está planejando engravidar. Victoza não deve ser usado durante a gravidez. Não é sabido se Victoza pode causar danos ao bebê que está por nascer.
Não é sabido se Victoza passa para o leite materno. Não use Victoza se estiver amamentando.
Converse com seu médico ou farmacêutico antes de usar qualquer medicamento se você estiver grávida ou amamentando.
Principais interações medicamentosas:
Informe seu médico, enfermeiro ou farmacêutico se você estiver utilizando ou tenha utilizado recentemente qualquer outro medicamento, incluindo medicamentos obtidos sem receita médica.
Em particular, informe seu médico, enfermeiro ou farmacêutico se você estiver usando medicamentos para diabetes que contém as seguintes substâncias:
Sulfonilureia (como glimepirida ou glibenclamida). Você pode ter hipoglicemia (baixo nível de açúcar no sangue) se usar Victoza junto com uma sulfonilureia já que a sulfonilureia aumenta o risco de hipoglicemia.
Quando você começar a usar estes medicamentos em conjunto, seu médico pode pedir que você reduza a dose da sulfonilureia. Se estiver usando uma sulfonilureia (como glimepirida ou glibenclamida), seu médico pode pedir que meça seu nível de açúcar. Isso irá ajudar seu médico a decidir se a dose da sulfonilureia necessita ser alterada.
Varfarina e outros anticoagulantes orais:
Um monitoramento mais frequente do seu sangue, para determinar a capacidade de coagulação pode ser necessário.
Utilizando Victoza com alimentos e bebidas
Você pode utilizar Victoza sem se preocupar com as refeições.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Como todos os medicamentos, Victoza pode provocar efeitos colaterais, embora nem todas as pessoas os apresentem.
Reação muito comum (ocorre em 10% ou mais dos pacientes que utilizam este medicamento):
- Náusea (enjôo). Este sintoma normalmente desaparece com o tempo.
- Diarreia. Este sintoma normalmente desaparece com o tempo.
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Hipoglicemia (baixo nível de açúcar no sangue). Os sinais de advertência para hipoglicemia podem aparecer repentinamente e podem incluir: suor frio, pele fria e pálida, dor de cabeça, batimento cardíaco rápido, enjôo, muita fome, alterações na visão, sonolência, fraqueza, nervosismo, ansiedade, confusão, dificuldade de concentração, tremor. Seu médico lhe avisará como tratar o nível baixo de açúcar no sangue e o que fazer se você observar estes sinais de advertência. É mais provável isto acontecer se você já estiver usando uma sulfonilureia ou uma insulina basal. Seu médico poderá reduzir a dose destes medicamentos antes de você iniciar o uso de Victoza.
- Anorexia.
- Redução do apetite.
- Dor de cabeça.
- Vômito.
- Dispepsia.
- Gastrite (inflamação no estômago). Os sinais incluem dor no estômago, náusea e vômito.
- Doença do refluxo gastroesofágico (DRGE). Os sinais incluem azia.
- Distensão abdominal.
- Dor na parte superior do abdome.
- Constipação (prisão de ventre).
- Flatulência (gases).
- Eructação (arroto).
- Infecção das vias aéreas superiores.
- Reações no local da injeção (tais como hematoma, dor, irritação, coceira e erupção).
- Reações alérgicas como erupção cutânea (rash).
- Frequência cardíaca aumentada.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Reações alérgicas como prurido (coceira) e urticária (um tipo de erupção de pele).
- Mal estar.
- Desidratação, algumas vezes com diminuição da função renal.
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
- Um tipo de reação alérgica grave (reação anafilática) com sintomas adicionais como dificuldade de respiração, inchaço da garganta e da face, batimentos cardíacos rápidos, etc. Se você apresentar estes sintomas você deve procurar socorro médico imediatamente e informar seu médico o mais rápido possível.
Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento):
- Casos de inflamação do pâncreas (pancreatite). A pancreatite pode ser uma condição séria e de potencial risco à vida. Pare de usar Victoza e procure seu médico imediatamente se você notar qualquer dos seguintes eventos adversos graves: dor aguda e persistente na região abdominal (área do estômago) que pode ser estendida para as costas, assim como náusea e vômitos. Isso pode ser um sinal de pâncreas inflamado (pancreatite).
Se algum destes eventos se agravar, ou se você notar qualquer efeito colateral não citado nesta bula, procure seu médico, enfermeiro ou farmacêutico.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
Composição
Cada mL da solução injetável contém
6,0 mg de liraglutida.
Excipientes: fosfato de sódio dibásico di-hidratado, propilenoglicol, fenol, hidróxido de sódio (ajuste de pH), ácido clorídrico (ajuste de pH) e água para injetáveis.
Um sistema de aplicação preenchido contém 18 mg de liraglutida.
Superdosagem
Se você usar mais Victoza do que o indicado, converse com seu médico imediatamente. Você pode precisar de tratamento médico. Se você aplicar Victoza demais, você pode sentir enjôo (náusea) ou vomitar.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Avaliação in vitro
A Liraglutida (substância ativa deste medicamento) mostrou um potencial muito baixo de envolvimento em interações farmacocinéticas com outras substâncias ativas biotransformadas pelo citocromo P450 e de ligação a proteínas plasmáticas.
Avaliação in vivo
O pequeno prolongamento do esvaziamento gástrico causado pela Liraglutida (substância ativa deste medicamento) pode afetar a absorção de medicamentos orais administrados concomitantemente. Estudos de interação não demonstraram qualquer atraso clinicamente relevante da absorção, portanto, não é necessário um ajuste de dose. Poucos pacientes tratados com Liraglutida (substância ativa deste medicamento) (substância ativa) relataram pelo menos um episódio de diarréia grave. A diarréia pode afetar a absorção de medicamentos orais concomitantes.
Paracetamol
A Liraglutida (substância ativa deste medicamento) não alterou a exposição global do paracetamol após uma dose única de 1000mg. A Cmáx do paracetamol foi reduzida em 31% e o Tmáx mediano foi prolongado em até 15 min. Não é necessário ajuste da dose para o uso concomitante de paracetamol.
Atorvastatina
A Liraglutida (substância ativa deste medicamento) não alterou a exposição global da atorvastatina em grau clinicamente relevante após administração de dose única de atorvastatina 40mg. Portanto, não é necessário ajuste da dose de atorvastatina quando administrada com Liraglutida (substância ativa deste medicamento). A Cmáx da atorvastatina foi reduzida em 38% e o Tmáx mediano foi prolongado de 1 h para 3 h com Liraglutida (substância ativa deste medicamento).
Griseofulvina
A Liraglutida (substância ativa deste medicamento) não alterou a exposição global da griseofulvina após administração de dose única de griseofulvina 500mg. A Cmáx da griseofulvina aumentou em 37%, enquanto o Tmáx mediano não se alterou. Não é necessário ajuste da dose para griseofulvina e outros compostos com baixa solubilidade e alta permeabilidade.
Digoxina
A administração de dose única de 1mg de digoxina com Liraglutida (substância ativa deste medicamento) resultou na redução da AUC da digoxina em 16%; na diminuição da Cmáx da digoxina em 31%. O tempo mediano para a concentração máxima (Tmáx) da digoxina foi prolongado de 1 h para 1,5 h. Nenhum ajuste de dose de digoxina é necessário com base nestes resultados.
Lisinopril
A administração de dose única de 20mg de lisinopril resultou na redução da AUC do lisinopril em 15%; na diminuição da Cmáx do lisinopril em 27%. O Tmáx mediano do lisinopril foi prolongado de 6 h para 8 h com Liraglutida (substância ativa deste medicamento). Nenhum ajuste de dose do lisinopril é necessário com base nestes resultados.
Contraceptivos orais
A Liraglutida (substância ativa deste medicamento) reduziu a Cmáx do etinilestradiol e do levonorgestrel em 12 e 13%, respectivamente, após administração de uma dose única de um produto contraceptivo oral. O Tmáx foi atrasado em 1,5 h com a Liraglutida (substância ativa deste medicamento), para ambos compostos. Não houve efeito clinicamente relevante na exposição global do etinilestradiol ou do levonorgestrel. Acredita-se, portanto, que o efeito contraceptivo não seja afetado na coadministração com Liraglutida (substância ativa deste medicamento).
Varfarina e outros derivados cumarínicos
Nenhum estudo de interação foi realizado. A interação clinicamente relevante com substâncias ativas com baixa solubilidade ou com índice terapêutico estreito como a varfarina não pode ser excluída. Após o início do tratamento com Liraglutida (substância ativa deste medicamento) (substância ativa) em paciente sob uso de varfarina ou outros derivados cumarínicos, é recomendado um monitoramento mais frequente da INR (razão normalizada internacional).
Insulina
Nenhuma interação farmacodinâmica ou farmacocinética foi observada entre Liraglutida (substância ativa deste medicamento) e insulina detemir com a administração de uma dose única de insulina detemir 0,5 U/kg com Liraglutida (substância ativa deste medicamento) 1,8mg no estado de equilíbrio em pacientes com diabetes tipo 2.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados de eficácia
Cinco estudos clínicos randomizados, duplo-cegos e controlados foram conduzidos para avaliar o efeito da liraglutida no controle glicêmico. O tratamento com Liraglutida (substância ativa deste medicamento) produziu melhora clínica e estatisticamente significativa na hemoglobina glicada (HbA1c), glicemia de jejum e glicemia pós-prandial, em comparação ao placebo. Estes estudos incluíram 3978 indivíduos expostos (2501 indivíduos tratados com Liraglutida (substância ativa deste medicamento)), 53,7% de homens e 46,3% de mulheres, 797 indivíduos (508 tratados com Liraglutida (substância ativa deste medicamento)) com idade ? 65 anos e 113 indivíduos (66 tratados com Liraglutida (substância ativa deste medicamento)) com idade ? 75 anos.
Controle glicêmico
Monoterapia
Tabela 1 Resultados de um estudo de 52 semanas de monoterapia com Liraglutida (substância ativa deste medicamento) em pacientes com controle glicêmico inadequado a partir de dieta e exercício ou tratamento com um antidiabético oral (ADO) prévios
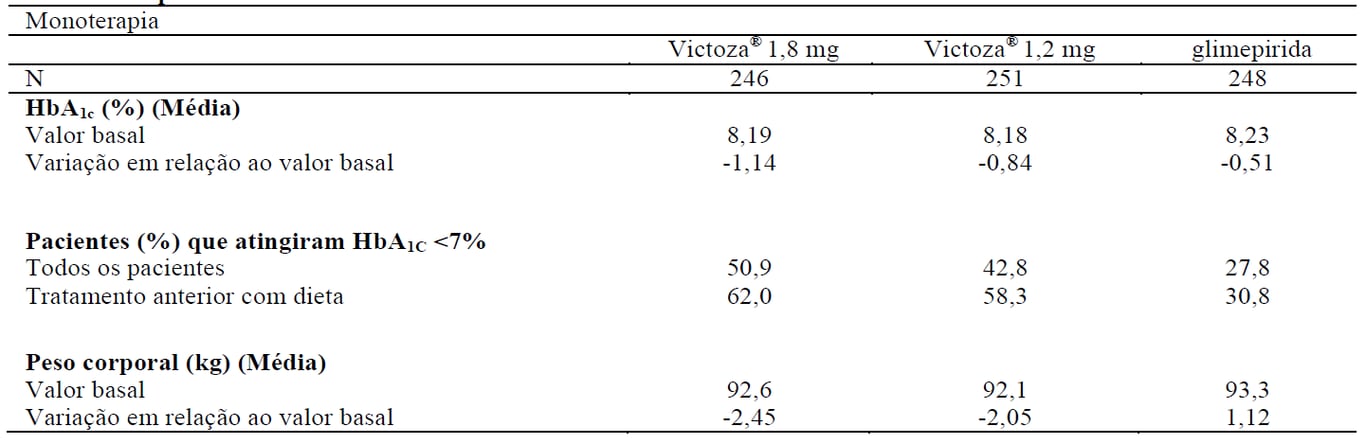
A monoterapia com Liraglutida (substância ativa deste medicamento) durante 52 semanas resultou em reduções na HbA1c estatisticamente significativas (p < 0,0014) e sustentadas, em comparação aos pacientes tratados com glimepirida.
Figura 1. O nível de HbA1c reduziu abaixo de 7% e sustentou após 12 meses quando Liraglutida (substância ativa deste medicamento) foi administrado a pacientes tratados previamente com dieta e exercícios (estudo 1573)
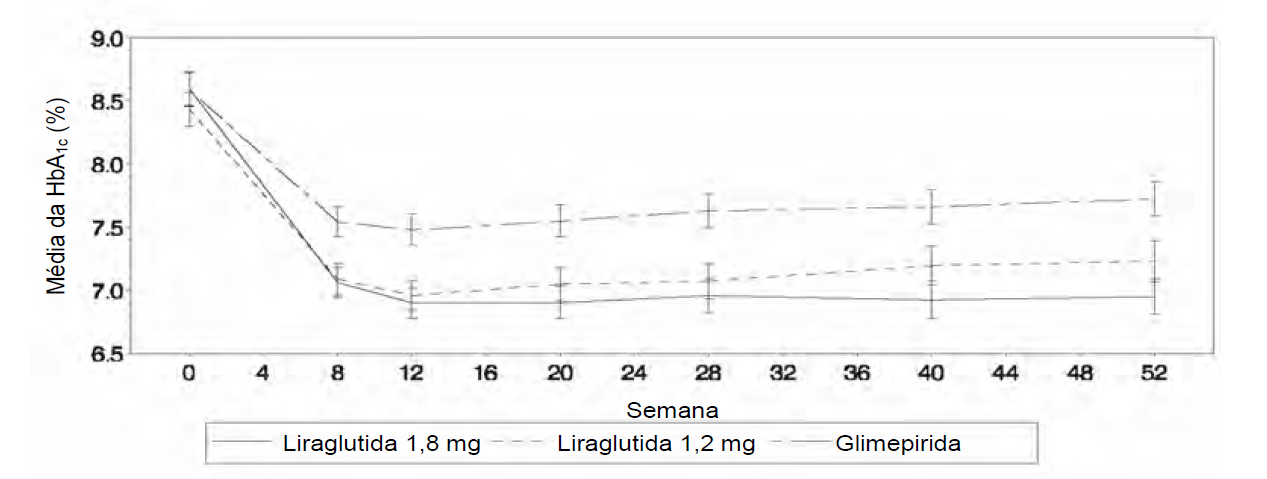
Pacientes com hemoglobina glicada (HbA1c) basal acima de 9,5% apresentaram uma redução média na HbA1c de 2,1% após o tratamento com Liraglutida (substância ativa deste medicamento) como monoterapia enquanto, pacientes tratados com Liraglutida (substância ativa deste medicamento), em estudos de combinação, tiveram reduções médias na HbA1c de 1,1-2,5%.
Combinação com antidiabéticos orais
A liraglutida em terapia combinada, por 26 semanas, com metformina, glimepirida ou metformina e rosiglitazona resultaram na redução estatisticamente significativa (p<0.0001) e sustentada na hemoglobina glicada (HbA1c), quando comparado aos pacientes tratados com placebo.
Em combinação com metformina:
Tabela 2 Liraglutida (substância ativa deste medicamento) em combinação com metformina (26 semanas)
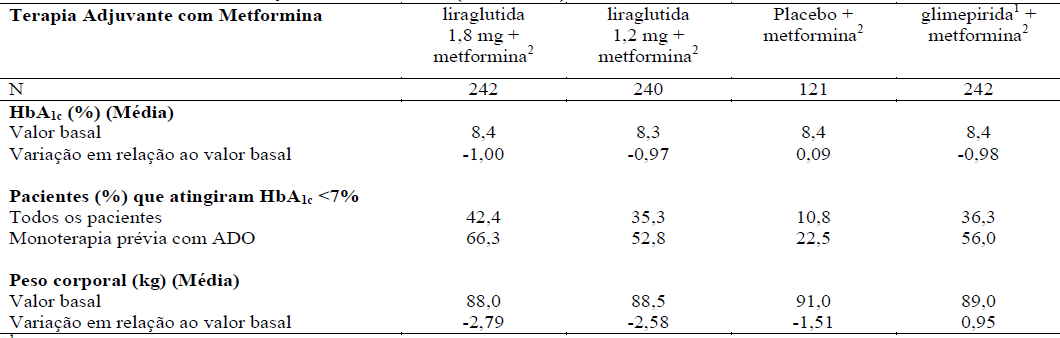
14mg/dia de glimepirida.
22.000mg/dia de metformina.
Em combinação com sulfonilureia:
Tabela 3. Liraglutida (substância ativa deste medicamento) em combinação com glimepirida (26 semanas)
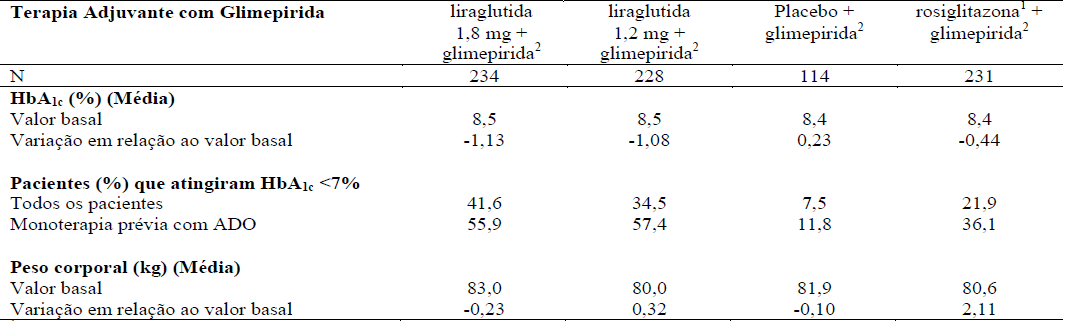
14mg/dia de rosiglitazona.
24mg/dia de glimepirida.
Tabela 4. Liraglutida (substância ativa deste medicamento) em combinação com metformina + rosiglitazona (26 semanas)
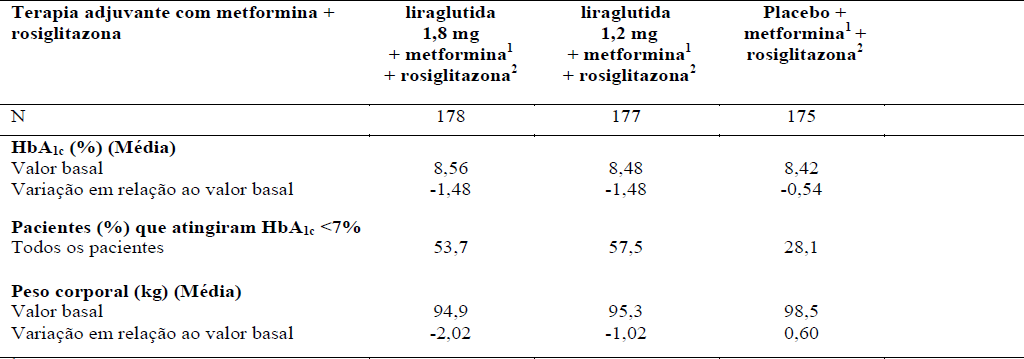
14mg/dia de rosiglitazona.
24mg/dia de glimepirida.
Em combinação com tiazolidinediona e metformina:
Tabela 5. Liraglutida (substância ativa deste medicamento) em combinação com sulfonilureia e metformina (26 semanas)

1A dose de insulina glargina foi administrada de acordo com o guia de titulação abaixo. A titulação da dose de insulina glargina foi conduzida pelo paciente de acordo com a orientação do investigador.
22.000mg/dia de metformina.
34mg/dia de glimepirida.
Tabela. Guia de titulação para insulina glargina
| Auto-mediação FPG | Aumento da dose de insulina glargina (UI) |
| ?5.5mmol/l (?100mg/dl) - alvo | Sem ajuste |
| >5.5 and <6.7mmol/l (>100 e <120mg/dl) | 0–2UIa |
| ?6.7mmol/l (?120mg/dl) | 2UI |
aDe acordo com a dose individualizada recomendada pelo investigador na visita anterior, por exemplo, dependendo se o paciente teve hipoglicemia.
Combinação com insulina
Em um estudo clínico de 104 semanas, 57% dos pacientes com diabetes tipo 2 foram tratados com insulina degludeca em combinação com metformina alcançando o alvo de HbA1c <7%, e os pacientes remanescentes continuaram com um estudo clínico aberto por 26 semanas, randomizados para adição de liraglutida ou uma dose única de insulina asparte (em uma refeição principal). No grupo da insulina degludeca + liraglutida, a dose de insulina foi reduzida em 20% para minimizar o risco de hipoglicemia. A adição de liraglutida resultou em uma maior redução de HbA1c (-0,73% para liraglutida vs. -0,40% para o comparador) e no peso corporal (-3,03 vs. 0,72 Kg). A taxa de episódios de hipoglicemias (por ano de exposição do paciente) foi mais baixa quando a liraglutida foi adicionada quando comparado a adição de dose única de insulina asparte (1,0 vs. 8,15; média: 0,13; 95% de IC: 0,08 para 0,21).
Em um estudo clínico de 52 semanas, a adição de insulina detemir à liraglutida 1,8mg e metformina em pacientes que não atingiram a meta glicêmica com liraglutida e metformina em monoterapia, resultou na redução de HbA1c em 0,54% em relação ao valor basal, quando comparado com os 0,20% de liraglutida 1,8mg com metformina e ao grupo de controle com metformina. A perda de peso foi sustentada. Houve um pequeno aumento na taxa de episódios de hipoglicemias leves (0,23 vs. 0,03 eventos por paciente ano).
Resultados de eficácia do uso em pacientes com insuficiência renal
Em um estudo duplo-cego, comparando a eficácia e a segurança de liraglutida 1,8mg versus o placebo como tratamento adicional à insulina e/ou antidiabéticos orais em pacientes com diabetes tipo 2 e insuficiência renal moderada, a liraglutida foi superior ao tratamento com placebo na redução de HbA1c após 26 semanas (-1,05% vs.-0,38% p<0,0001). Significativamente mais pacientes alcançaram HbA1c abaixo de 7% com liraglutida quando comparado ao placebo (52,8% vs. 19,5% p<0,0001). Os pacientes tratados com liraglutida apresentaram uma diminuição estatisticamente significante no peso corporal quando comparado aos pacientes tratados com placebo (-2,4 Kg vs. -1,3 Kg, p = 0,0052). Houve um risco considerável de episódios de hipoglicemia entre os dois grupos de tratamento. O perfil de segurança da liraglutida foi geralmente similar ao observado em outros estudos com liraglutida.
Proporção de pacientes que obtiveram reduções na hemoglobina glicada (HbA1c)
A monoterapia com Liraglutida (substância ativa deste medicamento) resultou em uma maior proporção, de forma estatisticamente significativa (p? 0,0007), de pacientes que alcançaram uma HbA1c <7% em 52 semanas, em comparação com pacientes tratados com glimepirida.
A liraglutida em combinação com metformina, glimepirida, ou metformina e rosiglitazona resultou em uma maior proporção, de forma estatisticamente significativa (p < 0,0001), de pacientes que alcançaram uma HbA1c ? 6,5% em 26 semanas, em comparação aos pacientes tratados com estes agentes isoladamente.
Glicemia de jejum
O tratamento com Liraglutida (substância ativa deste medicamento) isoladamente ou em combinação com um ou dois antidiabéticos orais resultou em uma redução na glicemia de jejum de 13-43,5mg/dL (0,72 - 2,42mmol/L). Esta redução foi observada dentro das duas primeiras semanas de tratamento.
Glicemia pós-prandial
Liraglutida (substância ativa deste medicamento) reduz a glicemia pós-prandial em todas as três refeições diárias em 31-49mg/dL (1,68-2,71mmol/L).
Peso corporal
A monoterapia com Liraglutida (substância ativa deste medicamento) por 52 semanas foi associada a uma redução do peso sustentada. O tratamento com Liraglutida (substância ativa deste medicamento) em monoterapia por 52 semanas reduziu a média da circunferência da cintura em 3,0-3,6 cm.
Liraglutida (substância ativa deste medicamento) em combinação com metformina, metformina e glimepirida ou metformina e rosiglitazona foi associado à redução de peso sustentada ao longo da duração dos estudos clínicos em um intervalo de 1,0 Kg a 2,8 kg.
Foi observada maior redução de peso nos pacientes com maiores índices de massa corpórea (IMC) no início do estudo.
Cirrose hepática não alcoólica
A liraglutida reduziu a esteatose hepática em pacientes com diabetes tipo 2.
Pressão arterial
Durante a duração dos estudos clínicos, a liraglutida reduziu a pressão arterial sistólica em um intervalo médio de 2,3 a 6,7mmHg em relação ao valor basal e quando comparado ao comparador a redução foi de 1,9 a 4,5mmHg.
Após análise Post-hoc de eventos adversos principais cardiovasculares graves (morte cardiovascular, infarto do miocárdio, acidente vascular cerebral) de todos os estudos intermediários e de longa duração de fase 2 e 3 (variando de 26 até 100 semanas de duração) incluindo 5.607 pacientes (3.651 expostos a liraglutida, não mostraram aumento do risco cardiovascular (taxa de incidência de 0,75 (95% IC 0,35:1,63) para o período final composto por liraglutida vs. todos os comparadores (metformina, glimepirida, rosiglitazona, insulina glargina, placebo)).
Pacientes com alto risco cardiovascular foram excluídos dos estudos clínicos e as taxas de incidência de eventos adversos principais cardiovasculares graves nos estudos foram baixas (6,02 por 1.000 pacientes ano tratados com liraglutida e 10,45 em pacientes tratados cos comparadores), impossibilitando conclusões categóricas.
Imunogenicidade
Consistente com as propriedades potencialmente imunogênicas dos medicamentos que contêm proteínas ou peptídeos, os pacientes podem desenvolver anticorpos anti-liraglutida após o tratamento com liraglutida. Em média, 8,6% dos pacientes desenvolveram anticorpos. A formação de anticorpo não tem sido associada com a redução da eficácia de liraglutida.
Outros dados clínicos
Em um estudo clínico aberto, comparando a eficácia e segurança de Liraglutida (substância ativa deste medicamento) 1,8mg com lixisenatida 20 ?g em 404 pacientes com controle glicêmico inadequado (média HbA1c 8,4%) em tratamento com metformina, Liraglutida (substância ativa deste medicamento) foi superior a lixisenatida na redução de HbA1c após 26 semanas de tratamento (-1,83% vs.-1,21%, p < 0,0001). Um número significativamente maior de pacientes alcançou uma HbA1c abaixo de 7% com Liraglutida (substância ativa deste medicamento) quando comparado a lixisenatida (74,2% vs. 45,5%, p < 0,0001), assim como uma meta de HbA1c abaixo ou igual a 6,5% (54,6% vs. 26,2%, p < 0,0001). Foi alcançada uma redução significativamente maior na glicemia de jejum com Liraglutida (substância ativa deste medicamento) quando comparada a lixisenatida (-2,85 vs. -1,70mmol/l, p < 0,0001). A perda de peso foi observada em ambos os braços de tratamento (-4,3 Kg com Liraglutida (substância ativa deste medicamento) e -3,7 Kg com lixisenatida). O perfil de segurança de Liraglutida (substância ativa deste medicamento) e lixisenatida foram em geral comparáveis.
Nenhuma informação de segurança nova foi identificada com Liraglutida (substância ativa deste medicamento).
Em um estudo comparando a eficácia e segurança de Liraglutida (substância ativa deste medicamento) (1,2mg e 1,8mg) e sitagliptina (um inibidor de DPP-4, 100mg) em pacientes não controlados com metformina, Liraglutida (substância ativa deste medicamento) em ambas as doses foi superior ao tratamento com sitagliptina na redução da HbA1c após 26 semanas (-1,24%, -1,50% vs. -0,90%, p<0,0001). Significativamente mais pacientes alcançaram HbA1c abaixo de 7% com Liraglutida (substância ativa deste medicamento) comparado com sitagliptina (43,7% e 56,0% vs. 22,0%, p= 0,0001). Pacientes tratados com Liraglutida (substância ativa deste medicamento) tiveram uma diminuição significativa no peso corporal comparado com os pacientes tratados com sitagliptina (-2,9 kg e -3,4 kg vs. -1,0 kg, p<0,0001). Uma maior proporção de pacientes tratados com liraglutida relatou náusea transitória vs. pacientes tratados com sitagliptina (20,8% e 27,1% para liraglutida vs. 4,6% para sitagliptina). As reduções na HbA1c e a superioridade versus sitagliptina observadas após 26 semanas de tratamento com Liraglutida (substância ativa deste medicamento) (1,2mg e 1,8mg) foram mantidas após 52 semanas de tratamento (-1,29% e -1,51% versus -0,88%, p<0,0001). A transferência de pacientes de sitagliptina para Liraglutida (substância ativa deste medicamento) após 52 semanas de tratamento resultou em redução adicional e estatisticamente significativa na HbA1c (0,24% e 0,45%, 95% IC; 0,41 a 0,07 e -0,67 a 0,23) na semana 78, mas um grupo controle formal não estava disponível.
Em um estudo comparando a eficácia e segurança de Liraglutida (substância ativa deste medicamento) 1,8mg e exenatida 10?g duas vezes ao dia em pacientes inadequadamente controlados com metformina e/ou sulfonilureia (significa HbA1c 8,3%), Liraglutida (substância ativa deste medicamento) foi superior ao tratamento com exenatida na redução da HbA1c após 26 semanas (-1,12% vs. -0,79%; diferença de tratamento prevista: - 0,33; 95% IC: - 0,47 para - 0,18). Significativamente mais pacientes alcançaram HbA1c abaixo de 7% com Liraglutida (substância ativa deste medicamento) comparado com exenatida (54,2% vs. 43,4%, p= 0,0015). Ambos os tratamentos resultaram em perda média de peso corporal de aproximadamente 3 kg. A transferência de pacientes de exenatida para Liraglutida (substância ativa deste medicamento) após 26 semanas de tratamento resultou em redução adicional e estatisticamente significativa na HbA1c (- 0,32%, 95% IC: - 0,41 para - 0,24) na semana 40, mas um grupo de controle formal não estava disponível. Durante as 26 semanas, havia 12 eventos graves em 235 pacientes (5,1%) usando liraglutida, enquanto haviam 6 eventos graves em 232 pacientes (2,6%) usando exenatida. Não houve padrão consistente em relação à classe de sistemas de órgãos de eventos.
Recuperação relatada por pacientes
Em um estudo clínico comparando Liraglutida (substância ativa deste medicamento) com glimepirida em pacientes com diabetes tipo 2, Liraglutida (substância ativa deste medicamento) 1,8mg por dia em monoterapia durante 52 semanas, melhorou significativamente a qualidade de vida global relacionada à saúde (p ? 0,02) conforme definido pelas saúdes mental e emocional combinadas e pela saúde geral percebida. Saúde mental e emocional (p = 0,01) e o componente subescalas de angústia psicológica (p = 0,03) e bem estar psicológico (p = 0,01), melhoraram significativamente com Liraglutida (substância ativa deste medicamento) 1,8mg por dia em monoterapia em comparação com a glimepirida, assim como a saúde geral percebida. Tratamento com Liraglutida (substância ativa deste medicamento) 1,2mg ou 1,8mg por dia melhorou significativamente o conceito de peso comparado com glimepirida (p < 0,01), enquanto Liraglutida (substância ativa deste medicamento) 1,8mg por dia também melhorou significativamente a imagem de peso (p < 0,01).
Resultados de outro estudo clínico comparando Liraglutida (substância ativa deste medicamento) 1,8mg e 1,2mg à glimepirida, ambos em combinação com metformina, mostraram que pacientes tratados com Liraglutida (substância ativa deste medicamento) 1,8mg em combinação tiveram frequência significativamente menor e dose-dependente de hiperglicemia. Liraglutida (substância ativa deste medicamento) 1,2mg e 1,8mg, ambos em combinação com metformina, tiveram menor frequência de hiperglicemia do que com metformina isolada.
Pacientes tratados com Liraglutida (substância ativa deste medicamento) 0,6mg, 1,2mg e 1,8mg em combinação com metformina tiveram significativamente menor frequência de hipoglicemia percebida comparado com glimepirida em combinação com metformina.
Características farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
A liraglutida é um análogo de GLP-1 com 97% de homologia sequencial ao GLP-1 humano, que se liga e ativa o receptor de GLP-1. O receptor de GLP-1 é o alvo do GLP-1 nativo, um hormônio incretina endógeno que potencializa a secreção de insulina dependente de glicose pelas células beta pancreáticas.
Ao contrário do GLP-1 nativo, liraglutida tem um perfil farmacocinético e farmacodinâmico adequado em humanos para administração uma vez ao dia. Após a administração subcutânea, o perfil de ação prolongado é baseado em três mecanismos: autoassociação, resultando em absorção lenta; ligação à albumina e maior estabilidade enzimática para as enzimas dipeptidil peptidase IV (DPP-IV) e endopeptidase neutra (NEP), resultando em uma meia-vida plasmática longa.
A ação da liraglutida é mediada por uma interação específica com receptores de GLP-1, levando a um aumento no monofosfato de adenosina cíclico (AMPc). A liraglutida estimula a secreção de insulina de forma dependente de glicose e melhora a função das células beta. Simultaneamente, a liraglutida reduz a secreção indevidamente alta de glucagon, também de forma glicose-dependente. Assim, quando a glicemia está alta, a secreção de insulina é estimulada e a secreção de glucagon é inibida. Reciprocamente, durante a hipoglicemia, a liraglutida diminui a secreção de insulina e não prejudica a secreção de glucagon. O mecanismo de redução da glicose sanguínea também envolve um pequeno prolongamento do esvaziamento gástrico.
A liraglutida mostrou atrasar a progressão do diabetes em modelos animais de pré-diabetes. A liraglutida mostrou ser in vitro um agente potente para estimulação específica da proliferação da célula beta e prevenção da morte da célula beta(apoptose) induzida por citocina e acido graxo livre. In vivo, a liraglutida aumenta a biossíntese de insulina e a massa da célula beta em modelos animais com diabetes. Quando a glicose está totalmente normalizada, a liraglutida não aumenta a massa de célula beta.
Efeitos Farmacodinâmicos
A liraglutida tem duração de ação de 24 horas e melhora o controle glicêmico reduzindo a glicemia de jejum e pós-prandial em pacientes com diabetes mellitus tipo 2.
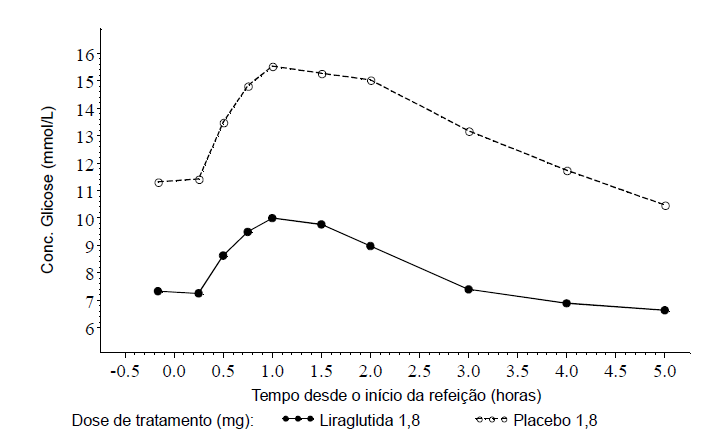
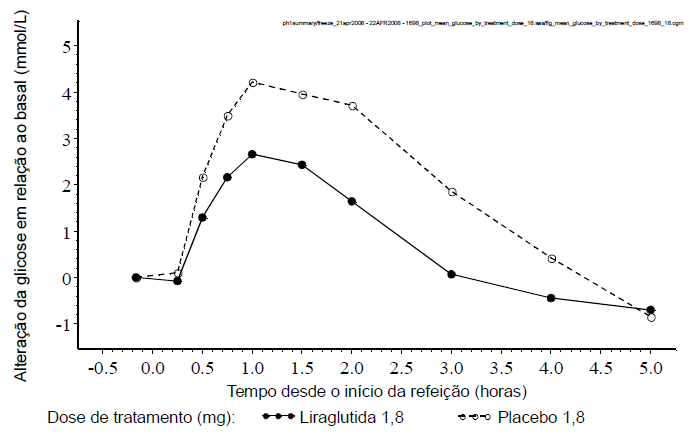
A diferença entre liraglutida 1,8mg (Figura 2) / 1,2mg e placebo na redução da glicose de jejum média mostrou ser 3,90mmol/L (70mg/dL) / 3,33mmol/L (60mg/dL). Seguindo uma refeição padrão, a diferença na concentração média de glicose pós-prandial de 2 horas foi de 6,02mmol/L (108mg/dL) / 5,63mmol/L (101mg/dL). Adicionalmente, a liraglutida diminuiu a excursão de glicose pós-prandial (glicose pós-prandial incremental) em média em 1,1mmol/L (20mg/dL) / 1,08mmol/L (19mg/dL).
Figura 2. Concentrações médias de glicemia pós-prandial absoluta (esquerda) e incremental (direita). Pacientes com diabetes tipo 2 tratados com liraglutida 1,8mg ou placebo em estudo cruzado (N = 18) (estudo 1698)
Secreção de insulina glicose-dependente
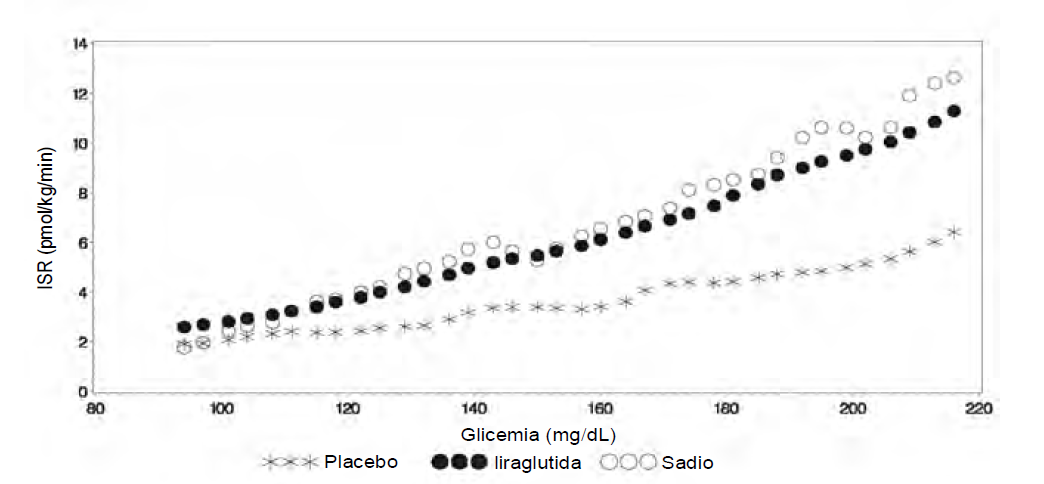
A liraglutida aumentou a secreção de insulina em relação ao aumento das concentrações de glicose. Usando uma infusão de glicose escalonada gradual, a taxa de secreção de insulina aumentou após uma única dose de liraglutida, em pacientes com diabetes tipo 2, até um nível comparável ao observado em indivíduos saudáveis (Figura 3).
Figura 3. Taxa média de secreção de insulina (ISR) versus concentração de glicose seguindo uma dose única de 7,5 ?g/kg (~0,66mg) ou placebo em pacientes com diabetes tipo 2 (N = 10) e pacientes sadios não tratados (N = 10) durante infusão de glicose graduada (estudo 2063)
Função da célula beta
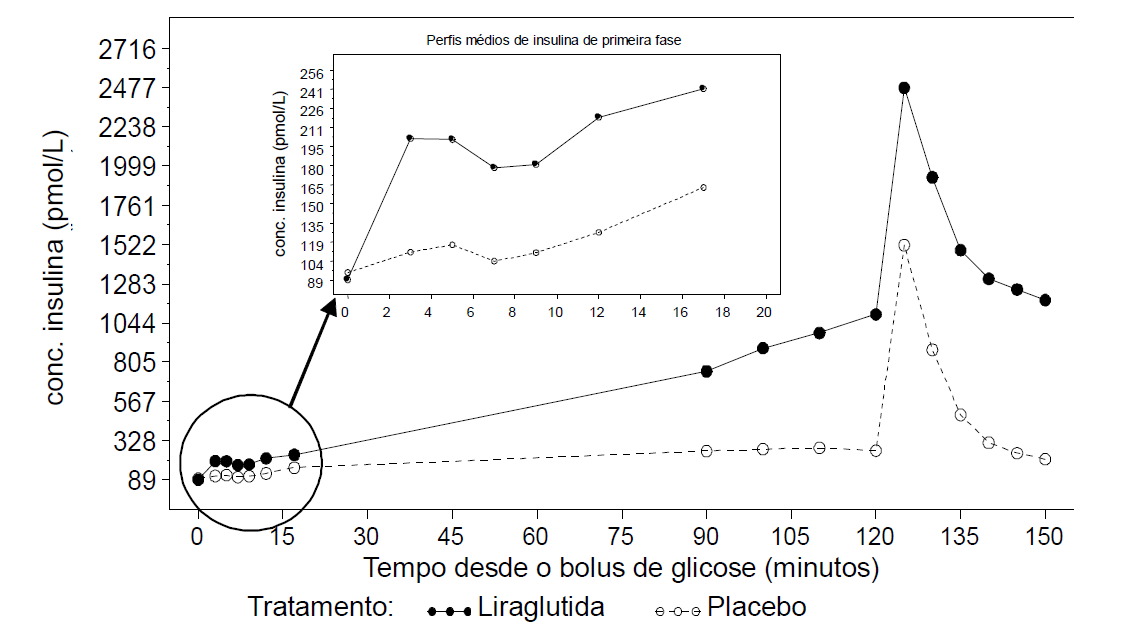
A liraglutida melhorou a função da célula beta conforme medido pela resposta insulínica de primeira e segunda fase e pela capacidade secretória máxima da célula beta. Um estudo farmacodinâmico em pacientes com diabetes tipo 2 demonstrou restauração da secreção insulínica de primeira fase (bolus de glicose intravenoso), melhorou a secreção insulínica de segunda fase (clamp hiperglicêmico) e a capacidade secretória maxima de insulina (teste de estimulação de arginina).
Figura 4. Perfis médios de insulina durante bolus de glicose (inserido), clamp hiperglicêmico e teste de estimulação de arginia seguido por 6 ?g/kg (~0,55mg) de liraglutida ou placebo por 10 dias em pacientes com diabetes tipo 2 (estudo 1332)
Estudos clínicos de 52 semanas com Liraglutida (substância ativa deste medicamento) mostraram melhora da função das células beta, usando medidas como o modelo de avaliação da homeostase para função das células beta (HOMA-B) e a proporção pró-insulina/insulina.
Secreção de glucagon
A liraglutida diminuiu a glicemia pela estimulação da secreção de insulina e diminuindo a secreção de glucagon. A liraglutida não diminuiu a resposta do glucagon a baixas concentrações de glicose. Além disso, foi observada menor liberação de glicose endógena com liraglutida.
Esvaziamento gástrico
A liraglutida causou um pequeno atraso no esvaziamento gástrico, reduzindo assim a taxa na qual a glicose pós-prandial apareceu na circulação.
Peso corporal, composição corporal e ingestão de energia
Em estudos clínicos de longa duração envolvendo pacientes com peso corporal elevado, Liraglutida (substância ativa deste medicamento) diminuiu significativamente o peso corporal. Varreduras de tomografia computadorizada e de absortometria de raios-X de dupla energia mostraram que esta perda de peso se deu primariamente do tecido adiposo. Esses achados são explicados por sensação reduzida da fome e redução da ingestão de energia, observadas durante o tratamento com liraglutida.
Eletrofisiologia cardíaca (QTc)
O efeito da liraglutida na repolarização cardíaca foi testado em um estudo de QTc. As concentrações de liraglutida no estado de equilíbrio com doses diárias acima de 1,8mg não produziram prolongamento do QTc.
Propriedades Farmacocinéticas
Absorção
A absorção da liraglutida após administração subcutânea é lenta, atingindo a concentração máxima 8-12 horas após a dose. A concentração máxima estimada de liraglutida foi de 9,4 nmol/L para uma dose única subcutânea de 0,6mg. Na dose de 1,8mg de liraglutida, a concentração média no estado de equilíbrio (AUC?/24) atingiu aproximadamente 34 nmol/L. A exposição de liraglutida aumentou proporcionalmente com a dose. O coeficiente de variação intraindivíduo para a área sob a curva (AUC) da liraglutida foi de 11% após administração de dose única. A liraglutida pode ser administrada subcutaneamente no abdome, coxa ou parte superior do braço.
A biodisponibilidade absoluta da liraglutida após administração subcutânea é de aproximadamente 55%.
Distribuição
O volume aparente de distribuição após administração subcutânea é de 11-17 litros. O volume médio de distribuição após a administração intravenosa de liraglutida é de 0,07 L/kg. A liraglutida liga-se amplamente às proteínas plasmáticas (> 98%).
Metabolismo/Biotransformação
Durante 24 horas após a administração de uma dose única de [3H]-liraglutida a indivíduos saudáveis, o principal componente no plasma foi a liraglutida inalterada. Dois metabólitos plasmáticos secundários foram detectados (? 9% e ? 5% de exposição plasmática total ao radioisótopo). A liraglutida é metabolizada endogenamente de forma semelhante às proteínas grandes, sem que um órgão específico tenha sido identificado como via principal de eliminação.
Eliminação
Após uma dose de [3H]-liraglutida, a liraglutida inalterada não foi detectada na urina ou nas fezes. Apenas uma pequena parte do radioisótopo administrado foi excretada como metabólitos relacionados à liraglutida na urina ou fezes (6% e 5%, respectivamente). Os radioisótopos da urina e das fezes foram excretados principalmente durante os primeiros 6-8 dias e corresponderam a três metabólitos secundários, respectivamente.
A depuração média após a administração subcutânea de uma dose única de liraglutida é de aproximadamente 1,2 L/h, com uma meia-vida de eliminação de aproximadamente 13 horas.
População Especial
Idosos
Nenhum ajuste de dose é requerido com base na idade. A idade não teve qualquer influência clinicamente relevante na farmacocinética da liraglutida, com base nos resultados de um estudo farmacocinético em indivíduos saudáveis e análise de dados de farmacocinética populacional de pacientes (18 a 80 anos).
Gênero
Nenhum ajuste de dose é requerido com base no gênero. O gênero não teve qualquer influência clinicamente significativa na farmacocinética de liraglutida, baseado nos resultados de dados de farmacocinética populacional de pacientes masculinos e femininos e em um estudo farmacocinético em sujeitos saudáveis.
Etnia
Nenhum ajuste de dose é requerido com base na etnia. A etnia não teve qualquer influência clinicamente relevante na farmacocinética da liraglutida, com base nos resultados da análise farmacocinética populacional, a qual incluiu grupos de sujeitos brancos, negros, asiáticos e hispânicos.
Obesidade
A análise farmacocinética populacional sugeriu que o índice de massa corpórea (IMC) não afeta significativamente na farmacocinética da liraglutida.
Insuficiência hepática
A farmacocinética da liraglutida foi avaliada em indivíduos com graus variados de insuficiência hepática em um estudo de dose única. Pacientes com insuficiência hepática leve (pontuação de Child-Pugh 5-6) a grave (pontuação de Child-Pugh > 9) foram incluídos no estudo. A exposição não foi maior em pacientes com função hepática insuficiente comparado à sujeitos sadios e, portanto, a insuficiência hepática não tem efeito clinicamente relevante na farmacocinética da liraglutida.
Insuficiência renal
A farmacocinética da liraglutida foi avaliada em pacientes com graus variados de insuficiência renal em um estudo de dose única. Pacientes com insuficiência renal leve (clearance de creatinina estimado de 50-80mL/min) a grave (clearance de creatinina estimado < 30mL/min) e pacientes com doença renal terminal requerendo diálise foram incluídos no estudo. A insuficiência renal não teve efeito clinicamente relevante na farmacocinética da liraglutida.
Pacientes pediátricos
Liraglutida (substância ativa deste medicamento) não foi estudado em pacientes pediátricos.
Dados de segurança pré-clínica
Dados não-clínicos não revelam qualquer risco especial para humanos, com base em estudos convencionais de farmacologia de segurança, toxicidade de doses repetidas ou genotoxicidade.
Tumores não-letais de células C da tireóide foram vistos em estudos de carcinogenicidade de dois anos em ratos e camundongos. Em ratos, um nível de efeito adverso não observado (NOAEL) não foi observado. Estes tumores não foram vistos em macacos tratados durante 20 meses. Estes achados em roedores são causados por um mecanismo não-genotóxico específico mediado pelo receptor de GLP-1, ao qual os roedores são particularmente sensíveis. A relevância para humanos é provavelmente baixa, mas não pode ser completamente excluída. Nenhum outro tumor relacionado ao tratamento foi encontrado.
Estudos em animais não indicaram efeitos prejudiciais diretos na fertilidade, mas houve ligeiro aumento em mortes embrionárias precoces na dose mais alta. A administração de liraglutida no meio da gestação causou uma redução no peso materno e crescimento fetal, com efeitos questionáveis nas costelas em ratos e variação esquelética em coelhos. O crescimento neonatal foi reduzido em ratos enquanto expostos a liraglutida, e persistiu no período pós-desmame no grupo de dose alta. Não se sabe se estes efeitos estão relacionados à ingestão calórica reduzida como efeito direto do GLP-1.
Cuidados de Armazenamento
Antes de você começar a usar Victoza, armazene-o em refrigerador (2 °C a 8 °C), longe do compartimento congelador. Não congele.
Durante o uso, Victoza deve ser armazenado em temperatura ambiente (entre 15 °C e 30°C) ou em refrigerador (2 °C a 8 °C). Após aberto, o medicamento é válido por 1 mês.
Mantenha longe do compartimento congelador. Não congele.
Quando você não estiver usando o sistema de aplicação, mantenha-o tampado para proteger da luz.
Número de lote e datas de fabricação e validade: vide embalagem.
A data de validade se refere ao último dia do mês indicado.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Característica física
Victoza é uma solução injetável límpida e incolor ou quase incolor em um sistema de aplicação preenchido.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Não use Victoza se a solução não estiver límpida e incolor ou quase incolor.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Registro MS 1.1766.0028
Farm. Resp.:
Luciane M. H. Fernandes - CRF-PR 6002
Fabricado por:
Novo Nordisk A/S
DK-2880 Bagsvaerd
Dinamarca
Importado por:
Novo Nordisk Farmacêutica do Brasil Ltda.
Rua Prof. Francisco Ribeiro, 683
CEP 83707-660
Araucária - PR
CNPJ: 82.277.955/0001-55
Disk Novo Nordisk: 0800 144488
Venda sob prescrição médica.