Comparamos o preço de Bonviva - 150Mg 1 Comprimidos, veja o menor preço

R$ 266,10
RReferência
1
ofertasMelhores preços a partir de R$ 266,10 até R$ 266,10
Menor preço
vendido por Drogaria Vera Cruz
R$ 266,10
Entregas para todo o Brasil. Clique e confira!
Para que serve
Bonviva é indicado para o tratamento da osteoporose (enfraquecimento dos ossos) pós-menopausa, para reduzir o risco de fraturas vertebrais.
Bonviva solução Injetável
Em um subgrupo de pacientes de maior risco de sofrer fraturas não vertebrais (escore T < 3,0 DP no colo do fêmur), Bonviva também demonstrou reduzir o risco de fraturas não vertebrais.
Como Bonviva funciona?
Bonviva é um medicamento utilizado para tratar a osteoporose em mulheres após a menopausa.
O princípio ativo de Bonviva é o ibandronato de sódio, uma substância altamente potente que age seletivamente nos ossos inibindo a atividade das células que destroem o tecido ósseo.
Assim, Bonviva é um medicamento que inibe a reabsorção do tecido ósseo causadora da fragilidade dos ossos (osteoporose) que ocorre principalmente em mulheres na pósmenopausa.
Bonviva Solução Injetável:
Este medicamento pode reverter a perda óssea por inibir a reabsorção e aumentar a massa dos ossos, mesmo que você não sinta ou perceba nenhuma diferença durante o tratamento, reduzindo os riscos de sofrer fraturas decorrentes da osteoporose pós-menopausa.
Bonviva comprimidos revestidos:
Após ingestão do comprimido em jejum, o medicamento é rapidamente absorvido para o sangue, atingindo a concentração máxima após 30 minutos a duas horas (em média, uma hora).
Cerca de 40% a 50% da dose absorvida é sequestrada pelos ossos. A diminuição das substâncias consideradas como marcadores bioquímicos da reabsorção óssea é observada dentro de sete dias após o início do tratamento.
Este medicamento pode reverter a perda óssea por inibir reabsorção e aumentar a massa dos ossos, mesmo que você não sinta ou perceba uma diferença, reduzindo as chances de sofrer fraturas decorrentes da osteoporose pósmenopausa.
Contraindicação
Você não deverá tomar Bonviva se tiver conhecida hipersensibilidade (alergia) ao ibandronato de sódio ou aos demais componentes da fórmula do produto. Você não deverá tomar Bonviva se tiver hipocalcemia (nível de cálcio baixo no sangue) não corrigida.
Bonviva Comprimidos revestidos:
Tal como acontece com vários bisfosfonatos, você não deverá tomar Bonviva se tiver anormalidades no esôfago, como demora no esvaziamento esofágico, estenose (estreitamento do esôfago) ou acalasia (ausência de relaxamento do esôfago).
Você não deverá tomar Bonviva se não conseguir ficar em pé ou sentado durante, pelo menos, 60 minutos.
Como usar
Duração do tratamento:
Solução Injetável:
A dose recomendada de Bonviva é uma injeção intravenosa de 3 mg (administrada em 15 a 30 segundos) a cada três meses.
Você deverá receber suplementação de cálcio e vitamina D.
Recomenda-se restrição absoluta à via intravenosa de administração.
Deve-se ter cuidado para não administrar Bonviva por via intra-arterial ou paravenosa, pois isso pode causar lesão tecidual.
O profissional de saúde saberá como preparar o medicamento.
Tome Bonviva exatamente conforme indicado por seu médico e continue tomando pelo tempo que ele determinar.
Bonviva é um medicamento para uso contínuo e não surtirá o efeito desejado se você parar de tomá-lo.
Comprimidos Revestidos:
A dose recomendada de Bonviva é um comprimido revestido de 150 mg, uma vez por mês. Os comprimidos devem ser tomados sempre na mesma data a cada mês.
A dose máxima de Bonviva é 150 mg por mês.
Bonviva é um medicamento de uso contínuo, não havendo duração de tratamento determinada.
Tome Bonviva exatamente conforme indicado por seu médico e continue tomando pelo tempo que ele determinar.
Bonviva é um medicamento para uso contínuo e não surtirá o efeito desejado se você parar de tomá-lo.
Posologia
Solução Injetável:
Instruções posológicas especiais:
Pacientes com insuficiência do fígado:
Não é necessário ajuste de dose.
Pacientes com insuficiência dos rins:
Não é necessário ajuste de dose em pacientes com creatinina sérica ? 2,3 mg/dL ou quando o clearance de creatinina (medido ou estimado) for ? 30 mL/min.
Bonviva, 3 mg, IV, a cada três meses, não é recomendado para uso em pacientes com creatinina sérica > 2,3 mg/dL ou com clearance de creatinina (medido ou estimado) <30 mL/min, pois não existem dados de estudos clínicos que incluíram tais pacientes.
Pacientes idosos:
Não é necessário ajuste da dose.
Comprimidos Revestidos:
Pacientes idosos:
Não é necessário ajuste de dose. Considerando-se que pode haver diminuição da função dos rins em pacientes idosos, se houver caracterização de insuficiência renal grave, recomenda-se avaliar a relação risco / benefício antes de administrar Bonviva.
Pacientes com insuficiência dos rins:
Não é necessário ajuste de dose para pacientes com insuficiência dos rins leve a moderada e com depuração de creatinina ? 30 mL/min.
Em pacientes com depuração de creatinina < 30 mL/min, a decisão de administrar Bonviva deve ser baseada na avaliação individual da relação risco / benefício.
Pacientes com insuficiência do fígado:
Não há necessidade de ajuste de dose para pacientes com insuficiência do fígado
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que fazer quando eu me esquecer de usar Bonviva?
Bonviba - Solução Injetável:
Se uma dose for perdida, a injeção deve ser aplicada assim que possível. Posteriormente, as injeções devem ser agendadas em intervalos de três meses a partir da data da última injeção.
Seu médico saberá quando deverá ser aplicada a próxima dose de Bonviva.
Bonviva - Comprimidos Revestidos:
Procure tomar o comprimido de Bonviva sempre na mesma data. Se por qualquer motivo você deixou de tomar sua dose mensal de Bonviva 150 mg, tome o comprimido na manhã seguinte ao dia em que você se lembrou, a menos que o intervalo de tempo até a próxima dose prevista seja menor que sete dias. Após isso, retome o esquema de dose uma vez por mês na data originalmente planejada.
Caso o intervalo de tempo até a próxima dose seja inferior a sete dias, não tome o comprimido, aguarde até a data originalmente planejada e retome o esquema de dose única mensal nessa data.
Os pacientes não devem tomar dois comprimidos de 150 mg dentro da mesma semana, isto é, em intervalo de tempo inferior a sete dias.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Bonviva solução injetável:
Uso em crianças:
Bonviva destina-se apenas para uso em adultos. Não há experiência com o uso deste medicamento em pessoas com menos de 18 anos de idade.
Capacidade para dirigir veículos e operar máquinas:
Não foram realizados estudos sobre os efeitos em relação à capacidade de dirigir veículos ou operar máquinas.
Até o momento, não há informações de que ibandronato de sódio possa causar doping. Em caso de dúvida, consulte o seu médico.
Gravidez e amamentação:
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Não existe experiência clínica com o uso de Bonviva por gestantes e não se sabe se Bonviva é excretado no leite humano.
Bonviva não deve ser usado por mulheres grávidas ou que estejam amamentando.
Interações medicamentosas:
Interações entre drogas clinicamente relevantes são consideradas improváveis, pois o ibandronato de sódio não mostrou inibir nem estimular processos de metabolização de drogas pelo fígado. Além disso, em concentrações terapêuticas, a ligação a proteínas plasmáticas é baixa, sendo pouco provável que o ibandronato de sódio desloque outras drogas de sua ligação às proteínas do plasma.
O ibandronato de sódio é eliminado apenas por excreção nos rins e não sofre nenhuma transformação no organismo. A via secretora não parece incluir os sistemas de transporte ácido básico envolvidos na excreção de outras drogas.
Estudos de interação farmacocinética em mulheres na pós-menopausa demonstraram ausência de qualquer potencial interação com tamoxifeno (medicamento utilizado no tratamento do câncer de mama) ou terapia de reposição hormonal (estrogênio).
Não se observou nenhuma interação quando o ibandronato de sódio foi administrado concomitantemente com melfalano / prednisolona a pacientes com mieloma múltiplo (câncer que se desenvolve na medula óssea).
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Comprimidos revestidos:
Uso em crianças:
Bonviva destina-se apenas para uso em adultos. Não há experiência com o uso deste medicamento por pessoas com menos de 18 anos de idade.
Uso em idosos:
Em uma análise realizada, a idade não foi um fator independente para nenhum dos parâmetros farmacocinéticos estudados.
Como a função dos rins diminui com a idade, esse é o único fator a ser levado em consideração.
Uso em pacientes com insuficiência dos rins:
A depuração do ibandronato de sódio em pacientes com vários graus de insuficiência dos rins se relaciona linearmente com a depuração de creatinina.
Não há necessidade de ajuste de dose para pacientes com insuficiência leve a moderada dos rins (depuração de creatinina ? 30 mL/min), conforme demonstrado em estudo no qual a maioria dos pacientes se enquadrava nessas categorias.
Indivíduos com insuficiência grave dos rins (depuração de creatinina < 30 mL/min) em uso de ibandronato de sódio 10 mg por via oral diariamente, durante 21 dias, apresentaram concentrações plasmáticas duas a três vezes maiores que em indivíduos com função dos rins normal (depuração total = 129 mL/min).
A depuração total do ibandronato de sódio foi reduzida para 44 mL/min nos indivíduos com disfunção dos rins grave.
Após administração intravenosa de 0,5 mg, as depurações total, renal e não renal diminuíram em 67%, 77% e 50%, respectivamente, em indivíduos com disfunção dos rins grave.
Entretanto, não houve redução da tolerabilidade associada com o aumento da exposição ao ibandronato de sódio.
Uso em pacientes com insuficiência do fígado:
Não se dispõe de dados sobre o uso de ibandronato de sódio em pacientes com disfunção do fígado.
O fígado não possui um papel importante na depuração do ibandronato de sódio, que não é metabolizado, mas eliminado apenas por excreção nos rins e por captação óssea. Portanto, não são necessários ajustes de dose em pacientes com disfunção do fígado.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas.
Não foram realizados estudos sobre os efeitos de Bonviva sobre a capacidade de dirigir veículos e operar máquinas.
Até o momento, não há informações de que ibandronato de sódio possa causar doping. Em caso de dúvida, consulte o seu médico.
Interações medicamentosas:
É provável que suplementos à base de cálcio, antiácidos e alguns medicamentos de uso oral que contêm alumínio, magnésio e ferro (por exemplo, complexos vitamínicos) interfiram na absorção de Bonviva.
Portanto, você deverá esperar 60 minutos após tomar Bonviva antes de tomar outros medicamentos orais, inclusive os suplementos à base de cálcio e outros minerais.
Em mulheres pós-menopáusicas, demonstrou-se não existir interação com tamoxifeno (medicamento utilizado no tratamento de câncer de mama) ou com tratamentos à base de reposição hormonal (estrogênio).
Não se observou interferência quando Bonviva foi administrado concomitantemente com melfalano / prednisolona em pacientes com mieloma múltiplo.
Em voluntários sadios masculinos e mulheres na pós-menopausa, a ranitidina intravenosa causou aumento na biodisponibilidade do ibandronato de sódio de cerca de 20%, provavelmente como resultado da redução da acidez gástrica.
Entretanto, uma vez que esse aumento se manteve dentro da variação normal da biodisponibilidade do ibandronato de sódio, não é necessário ajuste de doses, quando Bonviva for administrado com antagonistas dos receptores H2 ou outras substâncias que aumentam o pH gástrico.
Interações com alimentos:
A presença de alimentos ou produtos que contenham cálcio, alumínio, magnésio e ferro, incluindo leite e outros alimentos, interfere na absorção de Bonviva.
Portanto, você deverá esperar 60 minutos após tomar Bonviva para ingerir qualquer alimento..
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Advertências
Bonviva Solução Injetável:
Bonviva, assim como outros bisfosfonatos administrados por via intravenosa, pode provocar redução transitória dos níveis de cálcio no sangue.
Antes de iniciar o tratamento com Bonviva, a deficiência de cálcio e outros distúrbios do metabolismo ósseo e mineral devem ser tratados. A ingestão adequada de cálcio e vitamina D é importante para todos os pacientes.
Portanto, você deverá receber suplemento de cálcio e vitamina D, se a ingestão por dieta for insuficiente.
Bonviva, 3 mg, IV, a cada três meses, não é recomendado a pacientes com insuficiência dos rins que apresentam creatinina sérica > 2,3 mg/dL ou com clearance de creatinina < 30 mL/min, pois não existem dados de estudos clínicos que tenham incluído tais pacientes.
Pacientes portadores de doenças ou que usam concomitantemente medicações com potencial de efeitos adversos sobre o rim devem ser monitorados regularmente de acordo com as boas práticas clínicas durante o tratamento.
Casos de reações anafiláticas, incluindo episódios fatais, foram reportados em pacientes tratados com ibandronato de sódio intravenoso.
Suporte médico apropriado e medidas para monitoramento do paciente devem ser devidamente disponibilizados quando ibandronato de sódio intravenoso for administrado. Se ocorrer reação anafilática ou outra reação de hipersensibilidade, seu médico deverá descontinuar imediatamente a injeção e iniciar o tratamento apropriado.
Relatos na literatura médica indicam que os bisfosfonatos podem estar associados à inflamação ocular, como uveíte e esclerite.
Em alguns casos, tais eventos não desapareceram até que o bisfosfonato tenha sido descontinuado.
Osteonecrose de mandíbula (ONM) foi descrita em pacientes tratados com bisfosfonatos.
A maioria dos casos ocorreu em pacientes com câncer submetidos a procedimentos dentários, mas alguns casos ocorreram em pacientes com osteoporose pós-menopausa ou outros diagnósticos.
Fatores de risco conhecidos para osteonecrose de mandíbula incluem diagnóstico de câncer, quimioterapia inclusive com medicamentos que bloqueiam a formação de vasos sanguíneos, radioterapia, e uso de corticosteroides dados em associação, além de doenças associadas como anemia, doenças da coagulação, infecção e doença dentária preexistente.
A maioria dos casos notificados ocorreu em pacientes tratados com bisfosfonatos intravenosos, no entanto, alguns ocorreram em pacientes tratados por via oral.
Casos de osteonecrose em outras regiões de boca e face, incluindo o canal auditivo externo também foram relatados em pacientes tratados com bisfosfonatos, que incluem o ibandronato. Os fatores de risco são semelhantes aos da ONM. Outros fatores de risco podem incluir pequenos traumas repetitivos (por exemplo, uso habitual de hastes flexíveis com pontas de algodão).
A possibilidade de osteonecrose do canal auditivo externo deve ser considerada em pacientes que recebem bisfosfonatos e apresentam sintomas no ouvido, que incluem infecções de ouvido crônicas.
Em pacientes que desenvolvem osteonecrose de mandíbula (ONM) durante a terapia com bisfosfonatos, cirurgias dentárias podem exacerbar a condição. Não existem dados disponíveis que sugerem que a interrupção do bisfosfonato reduz o risco de ONM em pacientes com necessidade de procedimentos dentários.
O critério clínico do médico assistente deve orientar o plano de tratamento para cada paciente com base na avaliação individual do risco / benefício.
Bonviva - Comprimidos revestidos:
Antes de iniciar o tratamento com Bonviva, deve-se tratar a deficiência de cálcio e outros distúrbios do metabolismo ósseo e mineral. A ingestão adequada de cálcio e vitamina D é importante para todos os pacientes.
Portanto, você deverá receber suplemento de cálcio e vitamina D. se a ingestão pela dieta for insuficiente. Os bisfosfonatos em geral podem causar irritação no esôfago e no estômago, podendo ocorrer dificuldade para engolir o comprimido, queimação no esôfago e úlceras no esôfago e estômago.
Preste especial atenção e siga as instruções de administração e modo de usar do medicamento.
Se aparecerem sintomas de irritação no esôfago, tais como dor para engolir, dor no peito ou queimação no esôfago / estômago, recomenda-se interromper o uso de Bonviva e procurar atendimento médico.
Caso você se submeta a algum procedimento dentário, informe ao seu cirurgião-dentista que se encontra em tratamento com Bonviva.
Osteonecrose de mandíbula (ONM) foi relatada em pacientes tratados com bisfosfonatos. A maioria dos casos ocorreu em pacientes com câncer submetidos a procedimentos dentários, mas alguns casos ocorreram em pacientes em tratamento para osteoporose pós-menopausa e outros diagnósticos.
Fatores de risco conhecidos para osteonecrose de mandíbula incluem diagnóstico de câncer, quimioterapia inclusive com medicamentos que bloqueiam a formação de vasos sanguíneos, radioterapia, e uso de corticosteroides dados em associação, além de doenças associadas como anemia, doenças da coagulação, infecção e doença dentária preexistente.
A maioria dos casos notificados ocorreu em pacientes tratados com bisfosfonatos intravenosos, no entanto, alguns ocorreram em pacientes tratados por via oral.
Casos de osteonecrose em outras regiões de boca e face, incluindo o canal auditivo externo também foram relatados em pacientes tratados com bisfosfonatos, que incluem o ibandronato.
Os fatores de risco são semelhantes aos da ONM.
Outros fatores de risco podem incluir pequenos traumas repetitivos (por exemplo, uso habitual de hastes flexíveis com pontas de algodão). A possibilidade de osteonecrose do canal auditivo externo deve ser considerada em pacientes que recebem bisfosfonatos e que apresentam sintomas no ouvido, que incluem infecções de ouvido crônicas.
Em pacientes que desenvolvem osteonecrose de mandíbula (ONM) durante a terapia com bisfosfonatos, cirurgias dentárias podem exacerbar a condição. Não existem dados disponíveis que sugerem que a interrupção do bisfosfonato reduz o risco de ONM em pacientes com necessidade de procedimentos dentários.
O critério clínico do médico assistente deve orientar o plano de tratamento para cada paciente com base na avaliação individual do risco / benefício.
Relatos na literatura médica indicam que os bisfosfonatos podem estar associados à inflamação ocular,como uveíte e esclerite. Em alguns casos, tais eventos não desapareceram até que o bisfosfonato tenha sido descontinuado.
Reações Adversas
Bonviva - Solução Injetável:
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Distúrbios gastrintestinais:
Dor abdominal, dispepsia (dificuldade de digestão), náuseas, prisão de ventre, diarreia, gastrite), dores musculares, dor nas juntas, sintomas semelhantes aos de gripe, fadiga, dor de cabeça, erupção cutânea.
Sintomas gripais transitórios foram descritos em pacientes em uso de Bonviva, IV, tipicamente em associação com a primeira dose. Esses sintomas são geralmente de curta duração, leves ou moderados e se resolvem espontaneamente com a continuação do tratamento.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
Distúrbios musculoesqueléticos:
Dor óssea.
Distúrbios gerais e condições do local de administração:
Astenia (fraqueza muscular) e reações no local de injeção.
Distúrbios vasculares:
Flebite (inflamação das veias) e tromboflebite (inflamação das veias com coágulo).
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
Distúrbios do sistema imunológico:
Reações de hipersensibilidade (alergia).
Distúrbios da pele e dos tecidos subcutâneos:
Angioedema (inchaço situado na parte mais profunda da pele), edema facial (inchaço no rosto) e urticária (placas avermelhadas na pele).
Resultados laboratoriais anormais:
Não houve evidência de alterações laboratoriais indicativas de disfunção do fígado, dos rins ou do sistema hematológico (sanguíneo), hipocalcemia (valores baixos de cálcio no sangue) ou hipofosfatemia (valores baixos de fosfato no sangue) com Bonviva 3 mg, IV, a cada três meses.
Experiência pós-comercialização:
Desordens musculoesqueléticas e do tecido conjuntivo:
Osteonecrose de mandíbula e de outras regiões de boca e face, que incluem o canal auditivo externo, foi descrita muito raramente em pacientes tratados com ibandronato de sódio.
Desordens oculares:
Foram relatados eventos de inflamação ocular, como uveíte, episclerite e esclerite, com o uso de bisfosfonatos, incluindo ibandronato de sódio. Em alguns casos, esses eventos não foram resolvidos até a descontinuação do uso do bisfofonato.
Desordens do sistema imune:
Foram relatados casos de reação anafilática / choque anafilático, incluindo eventos fatais, em pacientes tratados com ibandronato de sódio.
Reações alérgicas incluindo exacerbação de asma foram relatadas.
Reações adversas cutâneas graves, incluindo síndrome de Stevens-Johnson, eritema multiforme e dermatite bolhosa foram relatadas.
Lesões, envenenamentos e complicações de procedimentos:
Foram relatados casos de fraturas atípicas do fêmur com o uso de bisfosfonatos, incluindo ibandronato de sódio; entretanto não foi estabelecida relação de causalidade.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Bonviva - Comprimidos Revestidos:
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Distúrbios gastrintestinais (doença de refluxo gastroesofágico, diarreia, dor abdominal, dificuldade na digestão, náusea, flatulência, gastrite, esofagite), dor de cabeça, sintomas gripais, fadiga, dores articulares e musculares (artralgia e mialgia), cãibra, rigidez muscular, exantema (erupção com vermelhidão da pele).
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
Distúrbios gastrintestinais (gastrite, esofagite, incluindo ulcerações esofágicas ou estreitamento do esôfago, vômitos e dificuldade para engolir, úlcera gástrica, melena (sangue nas fezes), distúrbios do sistema nervoso (tonturas), distúrbios musculoesqueléticos e do tecido conjuntivo (dor nas costas).
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
Distúrbios gastrintestinais (inflamação do duodeno), distúrbios do sistema imunológico (reações de hipersensibilidade), distúrbios da pele e do tecido subcutâneo: angioedema (inchaço semelhante à urticária, mas abaixo da pele), edema facial e urticária.
Achados laboratoriais anormais:
No estudo preliminar de três anos com Bonviva, 2,5 mg, diariamente (Estudo MF 4411), não houve diferenças em comparação com placebo no que diz respeito às anormalidades indicativas de disfunção do fígado ou dos rins, alterações hematológicas (sanguíneas), hipocalcemia (valores baixos de cálcio no sangue) ou hipofosfatemia (valores baixos de fosfato no sangue).
Semelhantemente, não foram notadas diferenças entre os grupos no estudo BM 16549 após um e dois anos.
Experiência pós-comercialização:
Desordens musculoesqueléticas e do tecido conjuntivo: muito raramente, foram relatados casos de osteonecrose de mandíbula e de outras regiões de boca e face, incluindo o canal auditivo externo em pacientes tratados com ibandronato de sódio.
Desordens oculares:
Foram relatados eventos de inflamação ocular, como uveíte, episclerite e esclerite, com o uso de bisfosfonatos, que incluem ibandronato de sódio. Em alguns casos, esses eventos não foram resolvidos até a descontinuação do uso do bisfosfonato.
Desordens do sistema imune:
Foram relatados casos de reação anafilática / choque anafilático, incluindo eventos fatais, em pacientes tratados com ibandronato de sódio. Reações alérgicas incluindo exacerbação de asma foram relatadas.
Reações adversas cutâneas graves, incluindo síndrome de Stevens-Johnson, eritema multiforme e dermatite bolhosa foram relatadas.
Lesões, envenenamentos e complicações de procedimentos:
Foram relatados casos de fraturas atípicas do fêmur com o uso de bisfosfonatos, incluindo ibandronato de sódio; entretanto não foi estabelecida relação de causalidade.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Composição
Bonviva - Solução Injetável:
Ibandronato de sódio monoidratado - 3,375 mg (equivalente a 3 mg de ácido ibandrônico em 3 mL de solução).
Excipientes: Cloreto de sódio, ácido acético glacial, acetato de sódio e água para injetáveis.
Bonviva - Comprimidos revestidos:
Ibandronato de sódio monoidratado - 168,75 mg (equivalente a 150 mg de ácido ibandrônico).
Excipientes: Lactose monoidratada, povidona, celulose microcristalina, crospovidona, ácido esteárico, dióxido de silício. Revestimento: hipromelose, dióxido de titânio, talco, macrogol 6.000.
Superdosagem
Não há nenhuma informação específica sobre tratamento de superdose de Bonviva intravenoso.
Bonviva - Solução Injetável:
Com base no conhecimento dessa classe de compostos, a superdosagem intravenosa pode resultar em hipocalcemia, hipofosfatemia e hipomagnesemia (valores baixos de cálcio, fosfato e magnésio no sangue, respectivamente).
Reduções clinicamente relevantes nos níveis séricos de cálcio, fósforo e magnésio devem ser corrigidas por meio de administração intravenosa de gluconato de cálcio, potássio ou fosfato de sódio e sulfato de magnésio, respectivamente.
Bonviva - Comprimidos Revestidos:
Não se dispõe de informações específicas sobre o tratamento da superdose com Bonviva.
Entretanto, superdose oral pode resultar em eventos adversos gastrintestinais, tais como mal-estar gástrico, queimação, esofagite, gastrite ou úlcera.
Em caso de superdose, deve-se administrar leite ou antiácidos. Devido ao risco de irritação esofágica, não se deve induzir o vômito, e o paciente deve permanecer sentado ou em pé e não deve se deitar.
Em caso de ingestão de doses excessivas, consulte seu médico ou um centro de intoxicações.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
É provável que suplementos à base de cálcio, antiácidos e alguns medicamentos orais que contenham cátions multivalentes (tais como alumínio, magnésio e ferro) interfiram na absorção de Ibandronato de sódio (substância ativa). Portanto, os pacientes devem esperar 60 minutos após ingerir Ibandronato de sódio (substância ativa), antes de tomarem outros medicamentos orais.
Foi demonstrada, em estudo de interação farmacocinética em mulheres na pós-menopausa, a ausência de qualquer interação potencial com tamoxifeno ou tratamentos de reposição hormonal (estrogênio). Não se observou interferência quando Ibandronato de sódio (substância ativa) foi administrado concomitantemente com melfalano / prednisolona em pacientes com mieloma múltiplo.
Em voluntários sadios masculinos e mulheres na pós-menopausa, a ranitidina intravenosa causou aumento na biodisponibilidade do Ibandronato de sódio (substância ativa) de cerca de 20%, provavelmente como resultado da redução da acidez gástrica. Entretanto, uma vez que esse aumento se manteve dentro da variação normal da biodisponibilidade do Ibandronato de sódio (substância ativa), não é necessário ajuste de doses, quando Ibandronato de sódio (substância ativa) for administrado com antagonistas dos receptores H2 ou outras substâncias que aumentem o pH gástrico.
Em relação à distribuição, não são consideradas prováveis interações medicamentosas clinicamente significativas, uma vez que o Ibandronato de sódio (substância ativa) não inibe as principais isoenzimas do sistema hepático do citocromo P450 humano e não induziu o sistema do citocromo P450 hepático em ratos. Além disso, a ligação às proteínas plasmáticas é baixa nas concentrações terapêuticas de Ibandronato de sódio (substância ativa), e, portanto, é improvável o deslocamento de outras substâncias. O Ibandronato de sódio (substância ativa) é eliminado apenas por excreção renal e não sofre biotransformação. A via secretória parece não incluir sistemas de transporte ácidos ou básicos envolvidos na excreção de outras substâncias.
Em um estudo com duração de um ano com mulheres na pós-menopausa com osteoporose (BM 16549), a incidência de eventos do trato gastrintestinal superior em pacientes que receberam concomitantemente aspirina ou anti-inflamatórios não esteroides foi semelhante nas pacientes tratadas com Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, ou 150 mg, uma vez por mês.
Em mais de 1.500 pacientes recrutadas no estudo BM 16549, que comparou a administração mensal e diária do Ibandronato de sódio (substância ativa), 14% das pacientes usavam bloqueadores da histamina (H2) ou inibidores da bomba de prótons.
Entre essas pacientes, a incidência de eventos gastrintestinais nas pacientes tratadas com Ibandronato de sódio (substância ativa), 150 mg, mensalmente, foi semelhante à das pacientes tratadas com 2,5 mg diariamente.
Interação Alimentícia
A presença de alimentos ou produtos que contenham cálcio e outros cátions (tais como alumínio, magnésio e ferro), incluindo leite e alimentos, provavelmente interferem com a absorção de Ibandronato de sódio (substância ativa) consistentemente com os achados dos estudos em animais. Portanto, a ingestão de tais produtos e alimentos deve ser postergada em 60 minutos após a administração oral de Ibandronato de sódio (substância ativa).
Ação da Substância
Resultados da eficácia
Tratamento da osteoporose na pós-menopausa
Ibandronato de sódio (substância ativa) administrado diariamente
Em um estudo preliminar sobre fraturas, com duração de três anos, randomizado, duplo-cego, controlado com placebo, demonstrou-se diminuição estatisticamente significativa e clinicamente relevante na incidência de novas fraturas vertebrais radiográficas morfométricas e clínicas. Ibandronato de sódio (substância ativa) foi avaliado em doses de 2,5 mg administradas diariamente e de 20 mg administradas de forma intermitente (20 mg em dias alternados, perfazendo um total de 12 doses no início de cada ciclo de três meses, seguido por um intervalo sem medicamento de nove a dez semanas).
Ibandronato de sódio (substância ativa) foi administrado uma hora antes da ingestão do primeiro alimento ou líquido do dia (período de jejum pós-dose). O estudo recrutou 2.946 mulheres com idade entre 55 e 80 anos (2.928 foram elegíveis para a avaliação de eficácia) que estavam há, pelo menos, cinco anos na menopausa, apresentavam densidade mineral óssea na coluna vertebral lombar de 2 a 5 DP (desvios-padrão) abaixo da média da pré-menopausa (escore T) em pelo menos uma vértebra [L1 – L4] e que apresentavam de uma a quatro fraturas vertebrais prevalentes. Todas as pacientes receberam 500 mg de cálcio e 400 UI de vitamina D diariamente.
Ibandronato de sódio (substância ativa) proporcionou redução estatística e clinicamente significativa na incidência de novas fraturas vertebrais com ambos os esquemas terapêuticos testados. O esquema de 2,5 mg diariamente reduziu a ocorrência de novas fraturas vertebrais comprovadas radiologicamente em 62% ao longo dos três anos de duração do estudo. As fraturas vertebrais diagnosticadas clinicamente também foram reduzidas em 49%. Além disso, o efeito pronunciado sobre as fraturas vertebrais também foi acompanhado por uma redução estatisticamente significativa na perda da altura (decorrente do achatamento de vértebras por fraturas vertebrais), em comparação com o placebo.
O efeito contra fraturas foi consistente durante o período de três anos de duração do estudo. Não houve nenhuma indicação de declínio do efeito no decorrer do tempo.
Embora o estudo clínico sobre fraturas do Ibandronato de sódio (substância ativa) não tenha sido especificamente desenhado para demonstrar eficácia antifratura nos casos de fraturas não vertebrais, observou-se redução relativa no risco, de magnitude semelhante (69%) à das fraturas vertebrais, para fraturas não vertebrais em um grupo de pacientes com risco elevado para fraturas (densidade mineral óssea no colo de fêmur ? escore T < -3,0 DP). A observação de eficácia em fraturas não vertebrais em subgrupos de alto risco é consistente com os achados de estudos clínicos de outros bisfosfonatos. Não foram conduzidos estudos especificamente desenhados para avaliar redução de risco de fraturas de fêmur.
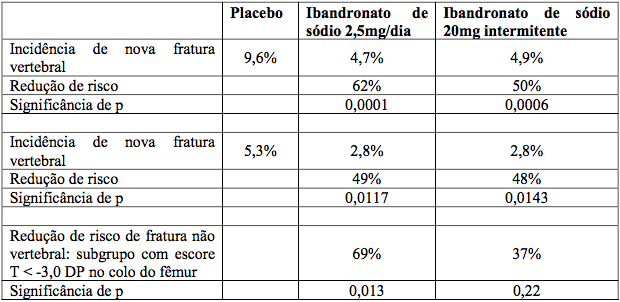
Portanto, esse estudo demonstrou a eficácia antifratura vertebral dos esquemas diários e intermitentes do ibandronato e a eficácia antifratura não vertebral do ibandronato 2,5 mg administrado diariamente em um subgrupo de pacientes de risco, isto é, que apresentavam escore T < -3,0 DP no colo do fêmur.
O aumento na densidade mineral óssea da coluna vertebral lombar, em três anos, comparado ao placebo, foi de 5,3% para o esquema de dose diária. Em comparação com os valores iniciais, esse aumento foi de 6,5%.
![]()
Os marcadores bioquímicos de remodelação óssea (tais como CTX urinário e osteocalcina sérica) apresentaram o padrão esperado de supressão para os níveis da pré-menopausa e atingiram a supressão máxima dentro de um período de três a seis meses. Observou-se redução clinicamente significativa de 50% a 78% nos marcadores de reabsorção óssea já em um mês após o início do tratamento com Ibandronato de sódio (substância ativa) 2,5 mg, diariamente, e 20 mg, intermitentemente, respectivamente. Diminuições nos marcadores bioquímicos de reabsorção óssea foram evidenciadas sete dias após início do tratamento.
Ibandronato de sódio (substância ativa), uma vez por mês – dose única mensal
Densidade mineral óssea (DMO)
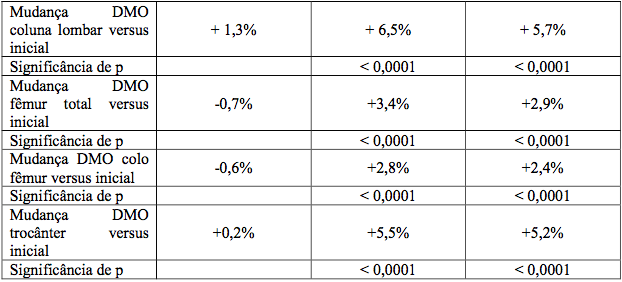
A administração de Ibandronato de sódio (substância ativa) uma vez por mês, demonstrou ser, pelo menos, tão eficaz quanto a administração de Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, no aumento da densidade mineral óssea (DMO) em um estudo multicêntrico, duplo-cego, de dois anos em mulheres na pós-menopausa e com osteoporose (densidade mineral óssea na coluna vertebral lombar inferior a -2,5 DP na avaliação inicial). Isso foi demonstrado tanto na análise primária do primeiro ano quanto na análise confirmatória do objetivo no segundo ano (Tabela 1).
Tabela 1: Variação média em relação à DMO inicial da coluna lombar, quadril total, colo femoral e trocânter após um ano (análise primária) e dois anos de tratamento (população per-protocol)
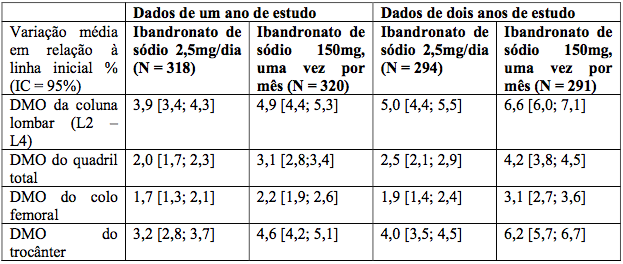
Além disso, Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, demonstrou ser superior a Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, por aumentar a densidade mineral óssea da coluna lombar em análise prospectivamente planejada em um ano, p = 0,002, e em dois anos, p < 0,001.
Ao fim de um ano (análise primária), 91,3% (p = 0,005) dos pacientes tratados com Ibandronato de sódio (substância ativa),150 mg, uma vez por mês, tiveram um aumento na DMO da coluna lombar superior ou igual à linha inicial (respondedores em relação à DMO), em comparação com 84% dos pacientes que receberam Ibandronato de sódio (substância ativa), 2,5 mg, diariamente. Aos dois anos, 93,5% (p = 0,004) dos pacientes que receberam Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, e 86,4% dos pacientes que receberam Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, responderam ao tratamento.
Para a densidade mineral óssea do quadril total, 90,0% (p < 0,001) dos pacientes tratados com Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, e 76,7% dos pacientes que receberam Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, tiveram aumentos na densidade mineral óssea do quadril total superior ou igual ao valor inicial, ao fim de um ano. Aos dois anos, 93,4% (p < 0,001) dos pacientes tratados com Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, e 78,4%, dos pacientes que receberam Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, tiveram aumentos na densidade mineral óssea do quadril total superior ou igual ao valor inicial.
Quando um critério mais rigoroso é considerado, que combina tanto a densidade mineral óssea da coluna lombar como do quadril total, 83,9% (p < 0,001) dos pacientes que receberam Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, e 65,7% dos pacientes que receberam Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, responderam ao tratamento em um ano. Aos dois anos, 87,1% (p < 0,001) e 70,5% dos pacientes atingiram esse critério no tratamento com 150 mg mensais e 2,5 mg diariamente, respectivamente.
Marcadores bioquímicos da remodelação óssea
Foram observadas reduções clinicamente significativas nos níveis do CTX sérico em todos os períodos de avaliação, isto é, 3, 6, 12 e 24 meses. Após um ano (análise primária), a variação média relativa do valor inicial foi de -76% para Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, e de -67% para Ibandronato de sódio (substância ativa), 2,5 mg, diariamente. Aos dois anos, a variação média relativa foi de -68% e -62%, nos 150 mg mensais e 2,5 mg diariamente, respectivamente.
Ao fim de um ano, 83,5% (p = 0,006) dos pacientes tratados com Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, e 73,9% dos pacientes que receberam Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, foram identificados como respondedores (definido como uma diminuição de ? 50% do valor inicial). Aos dois anos, 78,7% (p = 0,002) e 65,6% dos pacientes foram identificados como respondedores aos 150 mg mensais e 2,5 mg diariamente, respectivamente.
Com base nos resultados do estudo de um ano, espera-se que Ibandronato de sódio (substância ativa), 150 mg, uma vez por mês, seja tão eficaz quanto Ibandronato de sódio (substância ativa), 2,5 mg, diariamente, na prevenção de fraturas.
Implicações de doses esquecidas na eficácia (isto é, supressão de marcadores ósseos) foram exploradas usando-se um modelo farmacodinâmico de CTX urinário criado com os dados clínicos de 850 pacientes que receberam Ibandronato de sódio (substância ativa) em três estudos. As simulações com base no modelo mostram que se uma dose mensal única for esquecida, um pequeno aumento na área sob a curva de concentração versus tempo (ASC) do CTX urinário (correspondente a uma pequena redução na supressão percentual em relação ao valor inicial) poderá ocorrer (aumento de ~3,5% na ASC, quando comparada à ingestão correta do medicamento em 15 meses), com os perfis de CTX urinário se refazendo em seis meses. Se a dose for tomada com atraso, por exemplo, sete semanas após a última dose programada, ocorrerá um pequeno aumento transitório previsto de ~0,7%, com os perfis de CTX urinário se refazendo dentro de três meses.
Dessa forma, com base na modelagem matemática de um marcador de remodelação óssea (CTX urinário), não há preocupação de que uma dose atrasada em até três semanas ou mesmo uma dose perdida venha a comprometer a eficácia do produto.
Prevenção da osteoporose na pós-menopausa
Ibandronato de sódio (substância ativa), 2,5 mg, diariamente
A prevenção da perda óssea foi demonstrada em um estudo duplo-cego, controlado com placebo, com duração de dois anos, considerando-se a alteração na densidade mineral óssea lombar como critério de avaliação de resultado principal. Esse estudo comparou a administração diária de três doses diferentes de Ibandronato de sódio (substância ativa) (0,5 mg; 1,0 mg e 2,5 mg) com placebo. Um suplemento de 500 mg de cálcio por dia foi fornecido para cada paciente. O estudo recrutou 653 mulheres na pós-menopausa, sem osteoporose (648 foram elegíveis para avaliação de eficácia), estratificadas de acordo com o tempo de início da menopausa (1 – 3 anos e > 3 anos) e de acordo com a densidade mineral óssea da coluna vertebral lombar (escore T > -1, -1 a - 2,5).
A administração de Ibandronato de sódio (substância ativa), 2,5 mg, diariamente resultou em aumento médio na densidade mineral óssea de 3,1%, em comparação com o placebo, e de 1,9% em relação ao valor ao início do estudo. No grupo tratado com placebo, ocorreu diminuição na densidade mineral óssea de, aproximadamente, 1% na coluna vertebral lombar ao final de dois anos, confirmando a conhecida perda óssea acelerada logo após a menopausa. Independentemente do tempo de início da menopausa ou do grau de perda óssea pré-existente, o tratamento com ibrandonato de sódio resultou em resposta sobre a densidade mineral óssea lombar estatisticamente maior que a encontrada com o grupo tratado com placebo nos quatro grupos de estratificação. Setenta por cento das pacientes que receberam Ibandronato de sódio (substância ativa) responderam ao tratamento, tendo sido a resposta definida como aumento da densidade mineral óssea lombar em relação ao inicial.
O tratamento com Ibandronato de sódio (substância ativa) também resultou em aumento significativo na densidade mineral óssea do quadril total em 1,8%, em comparação com o grupo tratado com placebo (alteração média em relação ao inicial de 1,2%).
Observou-se redução clinicamente significativa nos marcadores bioquímicos de reabsorção óssea (CTX urinário) já em um mês após o início do tratamento.
Características Farmacológicas
Farmacodinâmica
A ação farmacodinâmica do Ibandronato de sódio (substância ativa) é a inibição da reabsorção óssea. In vivo, o Ibandronato de sódio (substância ativa) impede a destruição óssea induzida experimentalmente causada pelo término da função gonadal, por retinoides e por tumores ou extratos de tumores. Em ratos jovens tratados (fase de crescimento rápido), a reabsorção óssea endógena também é inibida, levando ao aumento da massa óssea, em comparação aos animais não tratados.
Os modelos em animais confirmam que o Ibandronato de sódio (substância ativa) é um inibidor altamente potente da atividade osteoclástica. Em ratos em fase de crescimento, não se evidenciou alteração da mineralização óssea, mesmo com doses acima de cinco mil (5.000) vezes a dose requerida para o tratamento da osteoporose.
A potência elevada e a margem terapêutica do Ibandronato de sódio (substância ativa) permitem esquemas posológicos mais flexíveis e tratamento intermitente, com longos intervalos sem medicamento, e em doses comparativamente baixas.
Em ratos, cães e macacos, tanto a administração diária quanto a intermitente (com longos intervalos sem medicamento) associaram-se à formação de tecido ósseo de qualidade normal e / ou com resistência mecânica aumentada, mesmo com doses além das farmacologicamente preconizadas, incluindo a variação de dose tóxica. Em humanos, a eficácia do Ibandronato de sódio (substância ativa), tanto em administração diária quanto intermitente, com intervalos livre de medicamento de nove a dez semanas, foi confirmada em estudo clínico, no qual se demonstrou que Ibandronato de sódio (substância ativa) apresenta eficácia contra fraturas.
Em mulheres na pós-menopausa, doses orais de Ibandronato de sódio (substância ativa), tanto em administração diária quanto intermitente com intervalos livre de medicamento de nove a dez semanas por trimestre, produziram alterações bioquímicas indicativas de inibição da reabsorção óssea dependente da dose, incluindo a supressão de marcadores bioquímicos urinários de degradação do colágeno do osso (tais como deoxipiridinolina e telopeptídeos C e N do colágeno tipo I).
Após descontinuação do tratamento, observa-se reversão dos marcadores ósseos, de volta aos índices patológicos pré-tratamento de reabsorção óssea elevada, associada à osteoporose pós-menopausa.
Análise histológica de biópsia óssea após dois e três anos de tratamento de mulheres na pós-menopausa mostrou tecido ósseo de qualidade normal e ausência de sinais de defeito da mineralização.
Em um estudo de bioequivalência de Fase I, realizado em 72 mulheres na pós-menopausa e que receberam 150 mg de Ibandronato de sódio (substância ativa) por via oral a cada 28 dias, perfazendo um total de quatro doses, observou-se inibição do CTX sérico após a primeira dose, já nas 24 horas após a administração da dose (inibição média de 28%), observando-se inibição média máxima (69%) seis dias depois. Após a terceira e a quarta dose, a inibição média máxima seis dias depois da administração foi de 74%, reduzindo-se para 56% 28 dias após a quarta dose. Na ausência de doses subsequentes, houve perda da supressão dos marcadores bioquímicos de reabsorção óssea.
Mecanismo de ação
O Ibandronato de sódio (substância ativa) é um bisfosfonato de terceira geração altamente potente, pertencente ao grupo dos bisfosfonatos nitrogenados, que age sobre o tecido ósseo e inibe especificamente a atividade do osteoclasto, não interferindo com o recrutamento de osteoclastos. A ação seletiva do Ibandronato de sódio (substância ativa) sobre o tecido ósseo baseia-se na alta afinidade desse composto para a hidroxiapatita que representa a matriz mineral do osso.
O Ibandronato de sódio (substância ativa) reduz a reabsorção óssea sem afetar diretamente a formação óssea. Em mulheres na pós-menopausa, reduz o índice elevado de remodelação óssea para níveis próximos aos níveis da pré-menopausa, levando a um ganho progressivo de massa óssea.
A administração diária ou intermitente do Ibandronato de sódio (substância ativa) resulta em redução da reabsorção óssea, refletida por níveis reduzidos de marcadores bioquímicos urinários e séricos de remodelação óssea, no aumento da densidade mineral óssea e na redução do risco de fraturas associado à osteoporose pós-menopausa.
Farmacocinética
Os efeitos farmacológicos do Ibandronato de sódio (substância ativa) não estão diretamente relacionados às concentrações plasmáticas efetivas. Isso foi demonstrado por vários estudos, em animais e em humanos, nos quais a eficácia do Ibandronato de sódio (substância ativa) foi demonstrada tanto após esquemas de administração diária quanto intermitentes, inclusive com intervalo de várias semanas sem medicamento (pelo menos seis semanas em ratos, 11 semanas em cães, 30 dias em macacos e, pelo menos, 9,5 semanas em humanos), desde que a mesma dose total fosse administrada durante esse período.
Absorção
A absorção do Ibandronato de sódio (substância ativa) pelo trato gastrintestinal superior é rápida após administração oral, e as concentrações plasmáticas aumentam de modo proporcional à dose até a dose de 50 mg por via oral. Com doses superiores a 50 mg, observam-se aumentos acima da proporcionalidade da dose. As concentrações plasmáticas máximas são atingidas dentro de 0,5 a duas horas (média de uma hora) em jejum, e a biodisponibilidade absoluta é de, aproximadamente, 0,6%. A absorção é prejudicada quando Ibandronato de sódio (substância ativa) é administrado juntamente com alimentos ou bebidas que não sejam água pura. A biodisponibilidade é reduzida em cerca de 90% quando Ibandronato de sódio (substância ativa) é administrado juntamente com uma refeição matinal padrão, em comparação com a biodisponibilidade observada em indivíduos que ingerem o medicamento em jejum. Não ocorre redução significativa na biodisponibilidade se Ibandronato de sódio (substância ativa) for administrado uma hora antes da refeição. A biodisponibilidade e, consequentemente, o ganho de densidade mineral óssea são reduzidos quando alimentos ou bebidas são ingeridos menos de uma hora após a administração de Ibandronato de sódio (substância ativa).
Distribuição
Após a exposição sistêmica inicial, o Ibandronato de sódio (substância ativa) liga-se rapidamente ao tecido ósseo ou é excretado pela urina. Em humanos, o volume de distribuição aparente terminal é de, pelo menos, 90 litros, e estima-se que a quantidade da dose que chega ao osso seja em torno de 40% a 50% da dose circulante. A ligação proteica em humanos é baixa (aproximadamente 85% de ligação com concentrações terapêuticas); portanto, o potencial para interações medicamentosas devidas a deslocamentos é baixo.
Metabolismo
Não há evidências de que o Ibandronato de sódio (substância ativa) seja metabolizado em animais ou em humanos.
Eliminação
A fração absorvida de Ibandronato de sódio (substância ativa) é retirada da circulação por meio de sequestro ósseo (40% a 50%), e o restante é eliminado sob forma inalterada pelos rins. A fração não absorvida é eliminada inalterada pelas fezes. A variação observada na meia-vida é ampla e dependente da dose e da sensibilidade do método de determinação, mas a meia-vida terminal geralmente encontra-se entre 10 – 72 horas. As concentrações plasmáticas iniciais caem rapidamente, atingindo 10% dos valores de pico dentro de três e oito horas após administração oral e intravenosa, respectivamente. A depuração total do Ibandronato de sódio (substância ativa) é baixa, com valores médios entre 84 e 160 mL/min. A depuração renal (cerca de 60 mL/min em mulheres sadias na pós-menopausa) representa 50% ? 60% da depuração total e está relacionada à depuração de creatinina.
Considera-se que a diferença entre a depuração aparente total e a depuração renal reflita a captação pelo osso.
Farmacocinética em populações especiais
Sexo
A biodisponibilidade e a farmacocinética do Ibandronato de sódio (substância ativa) em homens e mulheres são semelhantes.
Raça
Não há evidências de diferenças interétnicas clinicamente relevantes ou entre a distribuição do Ibandronato de sódio (substância ativa) em indivíduos da raça amarela e branca; contudo, os dados em indivíduos da raça negra são escassos.
Pacientes com insuficiência renal
A depuração do Ibandronato de sódio (substância ativa) em pacientes com vários graus de insuficiência renal relaciona-se linearmente com a depuração de creatinina.
Não há necessidade de ajuste de dose para pacientes com insuficiência renal leve a moderada (depuração de creatinina ? 30 mL/min), conforme demonstrado em estudo no qual a maioria dos pacientes se enquadrava nessas categorias.
Indivíduos com insuficiência renal grave (depuração de creatinina < 30 mL/min) em uso de Ibandronato de sódio (substância ativa) 10 mg por via oral diariamente, durante 21 dias, apresentaram concentrações plasmáticas duas a três vezes maiores que em indivíduos com função renal normal (depuração total = 129 mL/min). A depuração total do Ibandronato de sódio (substância ativa) foi reduzida para 44 mL/min nos indivíduos com disfunção renal grave. Após administração intravenosa de 0,5 mg, as depurações total, renal e não renal diminuíram em 67%, 77% e 50%, respectivamente, em indivíduos com disfunção renal grave. Entretanto, não houve redução da tolerabilidade associada com o aumento da exposição ao Ibandronato de sódio (substância ativa).
Pacientes com insuficiência hepática
Não se dispõe de dados sobre o uso de Ibandronato de sódio (substância ativa) em pacientes com disfunção hepática. O fígado não possui papel importante na depuração do Ibandronato de sódio (substância ativa), que não é metabolizado, eliminado apenas por excreção renal e por captação óssea. Portanto, não são necessários ajustes de dose em pacientes com disfunção hepática. Além disso, como a ligação proteica do Ibandronato de sódio (substância ativa) é baixa (85%) nas concentrações terapêuticas, é improvável que a hipoproteinemia das hepatopatias graves leve a aumentos clinicamente significativos na concentração de substância livre no plasma.
Pacientes idosos
Em uma análise multivariada, a idade não foi um fator independente para nenhum dos parâmetros farmacocinéticos estudados. Como a função renal diminui com a idade, esse é o único fator a ser levado em consideração.
Pacientes pediátricos
Não há dados sobre o uso de Ibandronato de sódio (substância ativa) em pacientes com menos de 18 anos.
Segurança pré-clínica
Os efeitos tóxicos em animais foram observados apenas com exposições consideradas suficientemente excessivas em relação à exposição terapêutica máxima em humanos, indicando pouca relevância para o uso clínico.
Carcinogenicidade
Não foi observada nenhuma indicação de potencial carcinogênico.
Mutagenicidade
Não foi observada nenhuma indicação de potencial genotóxico.
Cuidados de Armazenamento
Conservar em temperatura ambiente (entre 15 e 30 ºC).
Número de lote e datas de fabricação e validade: Vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Descarte de seringas / materiais perfurocortantes - Bonviva Solução Injetável:
Os seguintes pontos devem ser rigorosamente respeitados quanto ao uso e descarte de seringas e outros materiais perfurocortantes:
- As agulhas e seringas nunca devem ser reaproveitadas;
- Todas as agulhas e seringas utilizadas devem ser colocadas em recipiente de descarte apropriado à prova de perfurações;
- Manter o recipiente de descarte fora do alcance de crianças;
- A colocação do recipiente de descarte no lixo doméstico deve ser evitada;
- O descarte do recipiente deve ser realizado de acordo com as exigências locais ou conforme indicado pelo prestador de cuidados de saúde.
Descarte de medicamentos não utilizados e / ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Característica física:
Bonviva - Solução Injetável:
Bonviva já vem em uma seringa preenchida com solução injetável estéril. A solução é um líquido incolor e límpido.
Bonviva - Comprimidos Revestidos:
Os comprimidos de Bonviva são oblongos, brancos a quase brancos.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS-1.0100.0646
Farm. Resp.:
Tatiana Tsiomis Díaz - CRF-RJ nº 6942
Fabricado para
F. Hoffmann-La Roche Ltd, Basileia, Suíça
Por Vetter Pharma-Fertigung GmbH & Co. KG, Langenargen, Alemanha
Embalado por:
Roche Diagnostics GmbH, Mannheim, Alemanha
Registrado, importado e distribuído no Brasil por
Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2.020 CEP 22775-109 - Rio de Janeiro - RJ
CNPJ: 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289
www.roche.com.br
Uso restrito a hospitais.
Venda sob prescrição médica.