Comparamos o preço de Novopen - 4 3Ml Caneta Para Aplicação De Insulina, veja o menor preço

R$ 145,26
6
ofertasMelhores preços a partir de R$ 145,26 até R$ 543,29
Menor preço
vendido por Drogaria Catarinense
economize
73.26%
R$ 145,26
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Menor preço
vendido por Farmácia Preço Popular
economize
73.26%
R$ 145,26
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por 4Bio Medicamentos Especiais
economize
65.30%
R$ 188,50
Certificado de Qualidade ISO 9001. Entregas em todo Brasil. Confira!
vendido por Panvel Farmácias
economize
63.19%
R$ 199,99
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogaria Vera Cruz
economize
56.95%
R$ 233,90
Entregas para todo o Brasil. Clique e confira!
vendido por Promofarma
R$ 543,29
Para que serve
- Diabetes mellitus que requer tratamento com insulina.
- É indicado no tratamento de pacientes com diabetes melito para controle da taxa de glicose no sangue.
Contraindicação
- Hipersensibilidade ao princípio ativo ou a qualquer dos excipientes.
- Não é indicado nos casos de hipoglicemia (baixa taxa de glicose no sangue) e em pacientes alérgicos à insulina lispro ou a qualquer componente da fórmula.
- Este medicamento não deve ser usado por mulheres grávidas ou amamentando, sem orientação médica.
Como usar
Insulina (substância ativa) deve ser administrada por via subcutânea por injeção (em até 15 minutos antes ou imediatamente após uma refeição. A apresentação de Insulina (substância ativa) em frasco-ampola também pode ser administrada por bomba de infusão subcutânea externa e por infusão intravenosa.
A administração subcutânea deve ser realizada por injeção na parede abdominal, na coxa ou no músculo deltoide, ou por infusão subcutânea contínua na parede abdominal. Como ocorre com todas as Insulinas (substância ativa), os locais de injeção ou infusão dentro de uma determinada área (abdome, coxa ou deltoide) devem ser alternados de uma administração para a outra.
Como ocorre com todas as Insulinas (substância ativa), a taxa de absorção e, consequentemente, o início e a duração da ação podem ser alterados pelo local da administração, exercícios e outras variáveis.
Preparo e manipulação
Antes do primeiro uso, Insulina (substância ativa) deve ser mantida em temperatura ambiente por 1 a 2 horas.
Insulina (substância ativa) só deve ser utilizada se a solução estiver límpida, incolor, sem nenhuma partícula sólida visível e se tiver consistência aquosa.
As orientações para uso de Insulina (substância ativa) em bomba de infusão subcutânea contínua ou na caneta compatível para aplicação de Insulina (substância ativa) devem ser estritamente seguidas.
Os frascos-ampola ou os refis vazios nunca devem ser reutilizados, devendo ser adequadamente descartados.
Insulina (substância ativa) refil
Insulina (substância ativa) em refil para utilização com caneta compatível para aplicação de Insulina (substância ativa) não permite que o seu conteúdo seja misturado a nenhuma outra Insulina (substância ativa).
Se a caneta compatível para aplicação de Insulina (substância ativa) não estiver funcionando adequadamente, a solução pode ser retirada do refil com uma seringa (adequada para Insulina (substância ativa) com 100 UI/ml) e administrada.
Verifique sempre o manual para utilização da caneta compatível para aplicação de Insulina (substância ativa) e siga estritamente suas recomendações.
Insulina (substância ativa) frasco-ampola
Antes da retirada da Insulina (substância ativa) do frasco-ampola pela primeira vez, remover a tampa plástica protetora.
Não se deve agitar o frasco-ampola vigorosamente, pois pode causar a formação de espuma. A espuma pode interferir com a medida correta da dose.
Mistura de Insulinas (substância ativa) para administração subcutânea
Insulina (substância ativa) pode ser misturada à Insulina humana NPH.
Caso seja misturada à Insulina humana NPH, Insulina (substância ativa) deve ser a primeira a ser colocada na seringa. A administração deve ocorrer imediatamente após a mistura.
As misturas não devem ser administradas por via intravenosa.
Bomba de infusão subcutânea contínua
Insulina (substância ativa) pode ser usada para Infusão Subcutânea Contínua de Insulina (substância ativa) (ISCI) em sistemas de bomba adequados para infusão de Insulina (substância ativa).
Quando usada com uma bomba de infusão de Insulina (substância ativa), Insulina (substância ativa) não deve ser misturada com diluentes ou nenhuma outra Insulina (substância ativa). Os pacientes que utilizam a bomba de infusão subcutânea contínua devem ser orientados de forma abrangente a respeito do uso do sistema da bomba.
O cateter de infusão e o reservatório utilizados com Insulina (substância ativa) devem ser assepticamente trocados pelo menos a cada 48 horas. Estas instruções podem diferir das instruções dos manuais de bombsa em geral. É importante que as instruções específicas de Insulina (substância ativa) sejam seguidas com o uso deste medicamento. O não cumprimento das instruções específicas de Insulina (substância ativa) pode levar a sérios eventos adversos.
Os pacientes que administram Insulina (substância ativa) por ISCI devem ter à disposição um sistema de administração de Insulina (substância ativa) alternativo caso a bomba apresente falhas.
Infusão intravenosa
Para a administração intravenosa, Insulina (substância ativa) deve ser utilizada na concentração de 1 UI de Insulina glulisina / mL em sistemas de infusão contendo solução de cloreto de sódio 0,9% como fluido estéril e usando bolsas de infusão de policloreto de vinila (PVC) que contenha uma linha de infusão dedicada para este fim.
Após a diluição para uso intravenoso, tanto a solução como a bolsa de infusão devem ser inspecionadas visualmente quanto à presença de partículas e descoloração antes de ser administrada. A solução deve estar límpida, incolor e sem nenhuma partícula sólida visível. Nunca utilize a solução se ela estiver turva e se apresentar partículas sólidas.
Insulina (substância ativa) é incompatível com solução de dextrose e solução de Ringer, portanto, não pode ser usada com esses fluidos. Não existem estudos do uso de Insulina (substância ativa) com outros tipos de soluções.
Quando Insulina (substância ativa) é administrada por via intravenosa, não se deve misturá-la com diluentes que não seja a solução de cloreto de sódio 0,9% nem com outras Insulinas (substância ativa).
Não há estudos dos efeitos de Insulina (substância ativa) administrada por vias não recomendadas. Portanto, por segurança e para garantir a eficácia deste medicamento, a administração deve ser somente pela via recomendada para cada paciente.
Populações especiais
Em pacientes com insuficiência hepática ou renal, as exigências de Insulina (substância ativa) podem ser menores.
Conduta necessária caso haja esquecimento de administração
Caso tenha sido esquecida a administração de uma dose ou caso tenha sido administrada uma dose muito baixa de Insulina (substância ativa), o nível glicêmico pode se elevar demasiadamente. Deve-se verificar o nível glicêmico frequentemente e corrigir a hiperglicemia de acordo com a necessidade.
Posologia
Insulina (substância ativa) refil deve ser administrado por via subcutânea.
Insulina (substância ativa) frasco-ampola deve ser administrado por via subcutânea ou intravenosa.
Insulina (substância ativa) é uma Insulina humana recombinante análoga que demonstrou ser equipotente à Insulina humana. Uma unidade internacional de Insulina (substância ativa) tem o mesmo efeito hipoglicemiante de uma unidade internacional de Insulina humana regular. Após a administração subcutânea, seu início de ação é mais rápido e sua duração de ação mais curta.
A dose de Insulina (substância ativa) deve ser individualizada e determinada de acordo com as necessidades do paciente.
Insulina (substância ativa) deve normalmente ser usada em esquemas que incluem uma Insulina (substância ativa) de ação mais prolongada ou uma Insulina (substância ativa) basal análoga.
Precauções
Em decorrência da curta duração de ação de Insulina (substância ativa), os pacientes diabéticos também necessitam de uma Insulina (substância ativa) de ação mais prolongada ou de uma terapia com bomba de infusão de Insulina (substância ativa) para manter o controle adequado da glicose.
Qualquer alteração da Insulina (substância ativa) deve ser feita com cautela e apenas sob supervisão médica.
As alterações na potência da Insulina (substância ativa), no fabricante, no tipo (p. ex., regular, NPH, análogos), na espécie (animal, humana) ou no modo de fabricação (rDNA versus Insulina (substância ativa) de origem animal) podem resultar na necessidade de alteração da dose.
O tratamento antidiabético oral concomitante pode necessitar ser ajustado.
As necessidades de Insulina (substância ativa) podem ser alteradas durante condições intercorrentes, como doenças, distúrbios emocionais ou estresse.
Hipoglicemia
O tempo de ocorrência de hipoglicemia depende do perfil de ação das Insulinas (substância ativa) usadas e pode, portanto, variar quando o esquema terapêutico é alterado.
Em determinadas condições, como ocorre com todas as Insulinas (substância ativa), os sintomas de alerta de hipoglicemia podem ser alterados, menos pronunciados ou ausentes, por exemplo
- Se o controle glicêmico estiver consideravelmente melhor;
- Se a hipoglicemia estiver se desenvolvendo gradativamente;
- Em pacientes idosos;
- Quando uma neuropatia autônoma estiver presente;
- Em pacientes com longa história de diabetes;
- Em pacientes recebendo tratamento concomitante com alguns medicamentos.
Essas situações podem resultar em hipoglicemia severa (e, possivelmente, perda de consciência) antes que o paciente tenha consciência da hipoglicemia.
Bomba de infusão subcutânea contínua
O mau funcionamento da bomba de Insulina (substância ativa), do cateter de infusão ou erros de manipulação podem rapidamente levar o paciente a hiperglicemia, cetose e cetoacidose diabética. A rápida identificação e correção da causa da hiperglicemia, cetose ou cetoacidose diabética é necessária.
Injeção subcutânea temporária com Insulina (substância ativa) pode ser necessária. Pacientes que utilizam a terapia com bomba de infusão subcutânea contínua de Insulina (substância ativa) devem ser treinados a administrar Insulina (substância ativa) por injeção e ter um sistema de administração de Insulina (substância ativa) alternativo disponível.
A monitoração da glicose no sangue é recomendada em todos os pacientes diabéticos.
Gravidez
Não existem estudos clínicos bem controlados do uso de Insulina (substância ativa) em mulheres grávidas.
Uma quantidade limitada de dados em mulheres grávidas (menos de 300 resultados reportados) expostas à Insulina (substância ativa) glulisina indicou que não há problemas de segurança no uso da Insulina (substância ativa) glulisina durante a gravidez, no feto e nos recém-nascidos.
É primordial às pacientes diabéticas ou com histórico de diabetes gestacional a manutenção de um bom controle metabólico antes da concepção e durante toda a gravidez.
As necessidades de Insulina (substância ativa) podem diminuir durante o primeiro trimestre da gravidez, geralmente aumentam durante o segundo e o terceiro trimestres e rapidamente diminuem após o parto.
O monitoramento rigoroso do controle glicêmico nessas pacientes é essencial.
Deve-se questionar as pacientes diabéticas se elas estão grávidas ou se estão planejando engravidar.
Lactação
Não se sabe ao certo se Insulina (substância ativa) é excretada no leite materno.
A dose de Insulina (substância ativa) e a dieta podem precisar de ajuste em mulheres lactantes.
Categoria de risco na gravidez C.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Pacientes idosos
A hipoglicemia pode ser difícil de ser reconhecida em idosos.
Crianças
Insulina (substância ativa) pode ser administrada em crianças com idade igual ou superior a 4 anos. A administração de Insulina (substância ativa) em crianças menores de 4 anos ainda não foi estudada.
Insuficiência renal
As necessidades de Insulina (substância ativa), como ocorre com todas as Insulinas (substância ativa), podem ser menores em pacientes com insuficiência renal.
Insuficiência hepática
Em pacientes com insuficiência hepática, as necessidades de Insulina (substância ativa) podem ser menores devido a uma menor capacidade de gliconeogênese e redução do metabolismo de Insulina (substância ativa).
Alterações na capacidade de dirigir veículos e operar máquinas
A capacidade de concentração e reação do paciente pode estar prejudicada como resultado da hipoglicemia ou hiperglicemia ou, por exemplo, em decorrência de comprometimento visual. Isso pode constituir um risco em situações em que essas habilidades são de especial importância (p. ex., dirigir um carro ou operar máquinas).
Os pacientes devem ser aconselhados a tomar precauções para evitar a hipoglicemia durante a condução de veículos. Isso é particularmente importante nos pacientes que apresentam nível de consciência diminuído ou ausente dos sintomas de alerta da hipoglicemia ou que apresentam episódios frequentes de hipoglicemia. Deve-se considerar se é aconselhável dirigir veículos ou operar máquinas nessas circunstâncias.
Este medicamento pode causar doping.
Reações Adversas
Os eventos adversos observados foram os conhecidos para essa classe farmacológica e, consequentemente, comuns às Insulinas (substância ativa)
Reação muito comum (? 1/10)
Hipoglicemia, em geral, a reação adversa mais frequente da terapia com Insulina (substância ativa), pode ocorrer se a dose de Insulina (substância ativa) for muito alta em relação à necessidade de Insulina (substância ativa).
Reações comuns (? 1/100 e <1/10)
Alergia local em pacientes ocorre eventualmente como vermelhidão, inchaço e prurido no local da administração da Insulina (substância ativa). Essas reações geralmente desaparecem em alguns dias ou poucas semanas. Em alguns casos, essas reações podem estar relacionadas a fatores diferentes da Insulina (substância ativa), como irritantes em agentes de limpeza da pele ou técnica inadequada de administração.
Reações incomuns (? 1/1.000 e < 1/100)
Reações alérgicas sistêmicas à Insulina (substância ativa). Essas reações à Insulina (substância ativa) (incluindo a Insulina glulisina) podem, por exemplo, estar associadas à erupção cutânea (incluindo prurido) no corpo todo, falta de ar, sibilos, redução da pressão arterial, pulso rápido ou sudorese. Casos severos de alergia generalizada, incluindo reação anafilática, podem ser potencialmente fatais.
Reação rara (? 1/10.000 e < 1.000)
Como ocorre com qualquer terapia com Insulina (substância ativa), pode ocorrer lipodistrofia no local da administração e atraso na absorção da Insulina (substância ativa). O rodízio contínuo do local de injeção ou infusão na região de administração pode ajudar a reduzir ou prevenir essas reações.
Foram relatados erros de medicação nos quais outras Insulinas (substância ativa), particularmente Insulinas (substância ativa) de ação prolongada, foram administradas acidentalmente ao invés de Insulina glulisina.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
Várias substâncias afetam o metabolismo da glicose e podem exigir ajuste na dose da Insulina humana.
As substâncias que podem intensificar o efeito hipoglicemiante e aumentar a susceptibilidade à hipoglicemia são
Agentes hipoglicemiantes orais, inibidores da ECA, disopiramida, fibratos, fluoxetina, inibidores da MAO, pentoxifilina, propoxifeno, salicilatos e antibióticos sulfonamida.
As substâncias que podem reduzir o efeito hipoglicemiante são
Corticosteroides, danazol, diazóxido, diuréticos, glucagon, isoniazida, estrogênios e progestogênios (p. ex., em contraceptivos orais), derivados de fenotiazina, somatropina, agentes simpatomiméticos (p. ex., epinefrina, salbutamol, terbutalina), hormônios tireoideanos, inibidores da protease e medicamentos antipsicóticos atípicos (p. ex., olanzapina e clozapina).
Betabloqueadores, clonidina ou sais de lítio podem tanto potencializar quanto enfraquecer o efeito hipoglicemiante da Insulina (substância ativa). A pentamidina pode causar hipoglicemia, que pode ocasionalmente ser seguida de hiperglicemia.
Além disso, sob a influência de medicamentos simpatolíticos, como betabloqueadores, clonidina, guanetidina e reserpina, os sinais de contrarregulação adrenérgica podem estar reduzidos ou ausentes.
Medicamento - substância química
Nicotina
O efeito do fumo na farmacocinética e farmacodinâmica de Insulina (substância ativa) não foi estudado.
Medicamento - exame laboratorial
Não há dados disponíveis até o momento sobre a interferência de Insulina (substância ativa) glulisina em exames laboratoriais.
Interação Alimentícia
Álcool
Pode tanto potencializar quanto enfraquecer o efeito de diminuição da glicose no sangue, decorrente da Insulina (substância ativa).
Ação da Substância
Resultados de eficácia
Estudos clínicos
A eficácia e a segurança de Insulina (substância ativa) foram estudadas em pacientes adultos com diabetes Tipo 1 e Tipo 2 (n = 2.408). O parâmetro primário de eficácia foi o controle glicêmico, medido pela hemoglobina glicada (GHb) e expresso como equivalentes de hemoglobina A1c (A1C).
Diabetes Tipo 1 – Pacientes adultos
Um estudo controlado por medicamento ativo, randomizado, aberto e de 26 semanas (n = 672) foi conduzido em pacientes com diabetes Tipo 1 para avaliar a segurança e a eficácia de Insulina (substância ativa) em comparação à Insulina (substância ativa) lispro por via SC em até 15 minutos antes de uma refeição. A Insulina (substância ativa) glargina foi administrada uma vez por dia à noite como Insulina (substância ativa) basal. Antes do início do estudo, houve um período de introdução de 4 semanas com a combinação da Insulina (substância ativa) lispro e da Insulina (substância ativa) glargina seguido da randomização.
O controle glicêmico e as taxas de hipoglicemia que necessitaram de intervenção de terceiros foram equivalentes entre os dois regimes terapêuticos. O número de administrações diárias de Insulina (substância ativa) e as doses diárias totais de Insulina (substância ativa) e Insulina (substância ativa) lispro foram semelhantes. Foi observada diminuição da A1C em pacientes tratados com Insulina (substância ativa) sem aumento da dose basal de Insulina (substância ativa) (vide Tabela 1).
Tabela 1: Diabetes Mellitus Tipo 1 – Pacientes adultos:
| Duração do tratamento | 26 semanas | |
| Tratamento em combinação com as seguintes Insulinas (substância ativa) basais | Insulina (substância ativa) glargina | |
| APIDRA | Insulina (substância ativa) lispro | |
| Número de indivíduos tratados | 339 | 333 |
| A1C (%) | ||
| Média ao final do estudo | 7,46 | 7,45 |
| Alteração média ajustada em relação à Fase Basal | -0,14 | -0,14 |
| APIDRA - Insulina (substância ativa) lispro | 0,00 | |
| IC de 95% para diferença entre os tratamentos | (-0,09; 0,10) | |
| Dose da Insulina (substância ativa) basal (UI/dia) | ||
| Média ao final do estudo | 24,16 | 26,43 |
| Alteração média ajustada em relação à Fase Basal | 0,12 | 1,82 |
| Dose de Insulina (substância ativa) de curta duração (UI/dia) | ||
| Média ao final do estudo | 29,03 | 30,12 |
| Alteração média ajustada em relação à Fase Basal | -1,07 | -0,81 |
| Hipoglicemia (eventos/mês/paciente)* | 0,02 | 0,02 |
| Número médio de administrações de Insulina (substância ativa) ação curta por dia | 3,36 | 3,42 |
* Eventos que necessitaram de assistência de terceiros nos últimos 3 meses do estudo.
Diabetes Tipo 1 – Pacientes pediátricos
Um estudo clínico de Fase III controlado por medicamento ativo, aberto e com duração de 26 semanas (n = 572) avaliou a eficácia e segurança da Insulina glulisina em crianças e adolescentes com diabetes mellitus Tipo 1, em comparação com a Insulina (substância ativa) lispro, ambas administradas por via subcutânea pelo menos 15 minutos antes de uma refeição.
Como Insulina (substância ativa) basal, os pacientes receberam Insulina (substância ativa) glargina uma vez ao dia (à noite) ou NPH (protamina neutra de Hagedorn) duas vezes ao dia (de manhã e à noite). O estudo foi constituído por um período de introdução de 4 semanas, no qual os pacientes receberam NPH ou Insulina (substância ativa) glargina combinada com Insulina (substância ativa) lispro, seguido de uma fase de tratamento de 26 semanas.
O controle glicêmico, as taxas de hipoglicemia que necessitaram de intervenções de terceiros, e a frequência de episódios de hipoglicemia relatados como eventos adversos graves, foram comparáveis nos dois regimes de tratamento. Os pacientes que receberam a Insulina glulisina necessitaram de aumentos significativamente menores das doses diárias de Insulina (substância ativa) basal, de ação rápida e total, da fase basal até o desfecho, para alcançar um controle glicêmico similar aos pacientes que receberam a Insulina (substância ativa) lispro (vide Tabela 2).
Tabela 2: Diabetes Mellitus Tipo 1 – Pacientes pediátricos:
| Duração do tratamento | 26 semanas | |
| Tratamento em combinação com | NPH ou Insulina (substância ativa) glargina | |
| APIDRA | Insulina (substância ativa) lispro | |
| HbA1c (%) | ||
| Número de pacientes | 271 | 291 |
| Média na Fase Basal | 8,20 | 8,17 |
| Alteração média ajustada em relação à Fase Basal | 0,10 | 0,16 |
| APIDRA - Insulina (substância ativa) lispro | -0,06 | |
| IC de 95% para diferença entre os tratamentos | (-0,24; 0,12) | |
| Dose de Insulina (substância ativa) basal (UI/dia) | ||
| Média ao final do estudo | 28,41 | 28,86 |
| Alteração média ajustada em relação à Fase Basal | 1,09 | 2,22 |
| Dose de Insulina (substância ativa) de ação rápida (UI/dia) | ||
| Média ao final do estudo | 25,48 | 26,97 |
| Alteração média ajustada em relação à Fase Basal | 1,36 | 2,71 |
| Porcentagem de pacientes com uma média de injeções de Insulina (substância ativa) de ação rápida por dia ? 3 | 77,0 | 80,3 |
Diabetes Tipo 2 – Pacientes adultos
Um estudo controlado por medicamento ativo, randomizado, aberto e de 26 semanas de duração (n = 876) foi conduzido em pacientes com diabetes Tipo 2 tratados com Insulina (substância ativa) para avaliar a segurança e a eficácia de Insulina (substância ativa) administrada em até 15 minutos antes de uma refeição em comparação à Insulina humana regular administrada 30 a 45 minutos antes de uma refeição.
A Insulina humana NPH foi administrada duas vezes por dia como Insulina (substância ativa) basal. Todos os pacientes participaram de um período de introdução de 4 semanas com a combinação da Insulina humana regular com a Insulina humana NPH. O índice de massa corpórea (IMC) médio dos pacientes foi de 34,55 kg/m².
No momento da randomização, 58% dos pacientes estavam recebendo um agente antidiabético oral e foram orientados a continuar o uso na mesma dose. A maioria dos pacientes (79%) misturou uma Insulina (substância ativa) de curta duração com a Insulina humana NPH imediatamente antes da administração. Foi observada uma redução maior em relação à A1C da Fase Basal no grupo recebendo tratamento com Insulina (substância ativa).
Ao final do período de tratamento, os níveis de glicemia pós-prandial no grupo recebendo tratamento com Insulina (substância ativa) foram menores do que no grupo Insulina humana regular.
As taxas de hipoglicemia, que necessitaram de intervenção de terceiros, foram equivalentes entre os dois regimes terapêuticos. Não foram observadas diferenças entre os grupos Insulina (substância ativa) e Insulina humana regular no número de administrações diárias ou doses de Insulina (substância ativa) basal ou de curta duração. (vide Tabela 3).
Tabela 3: Diabetes Mellitus Tipo 2 – Pacientes adultos:
| Duração do tratamento | 26 semanas | |
| Tratamento em associação com as seguintes Insulinas (substância ativa) basais | Insulina humana NPH | |
| APIDRA | Insulina humana regular | |
| A1C (%) | ||
| Número de pacientes | 435 | 441 |
| Média ao final do estudo | 7,11 | 7,22 |
| Alteração média ajustada em relação à Fase Basal | -0,46 | -0,30 |
| APIDRA - Insulina humana regular | -0,16 | |
| IC de 95% para diferença entre os tratamentos | (-0,26; -0,05) | |
| Dose de Insulina (substância ativa) basal (UI/dia) | ||
| Média ao final do estudo | 65,34 | 63,05 |
| Alteração média ajustada em relação à Fase Basal | 5,73 | 6,03 |
| Dose de Insulina (substância ativa) de ação rápida (UI/dia) | ||
| Média ao final do estudo | 35,99 | 36,16 |
| Alteração média ajustada em relação à Fase Basal | 3,69 | 5,00 |
| Hipoglicemia (eventos/mês/paciente)* | 0,00 | 0,00 |
| Número médio de administrações de Insulina (substância ativa) de curta duração por dia | 2,27 | 2,24 |
Administração pré e pós-refeição (Diabetes Tipo 1)
Um estudo controlado por medicamento ativo, randomizado, aberto e de 12 semanas de duração (n = 860) foi conduzido em pacientes com diabetes Tipo 1 para avaliar a segurança e a eficácia de Insulina (substância ativa) administrada em diferentes pontos de tempo em relação a uma refeição. Insulina (substância ativa) foi administrada por via SC em até 15 minutos antes de uma refeição ou imediatamente após uma refeição e a Insulina humana regular foi administrada por via SC 30 a 45 minutos antes de uma refeição.
As comparações realizadas neste estudo foram Insulina (substância ativa) pré-refeição em comparação à Insulina humana regular, Insulina (substância ativa) pós-refeição em comparação à Insulina humana regular e Insulina (substância ativa) pós-refeição em comparação à Insulina (substância ativa) pré-refeição.
A Insulina (substância ativa) glargina foi administrada uma vez por dia ao deitar como Insulina (substância ativa) basal. Antes do início do estudo, houve um período de introdução de 4 semanas com a combinação de Insulina humana regular e Insulina (substância ativa) glargina seguido da randomização. O controle glicêmico e as taxas de hipoglicemia que necessitaram de intervenção de terceiros foram equivalentes para os esquemas terapêuticos.
Foram observadas reduções significativas da A1C em relação à Fase Basal em todos os três esquemas terapêuticos. Não foram observadas alterações em relação à Fase Basal entre os tratamentos no número diário total de administrações de Insulina (substância ativa). Foi observado um aumento da dose diária de Insulina (substância ativa) de curta duração com a Insulina humana regular (vide Tabela 4).
Tabela 4: Diabetes Mellitus Tipo 1 – Pacientes adultos:
 * Diferença entre os tratamentos da alteração média ajustada em relação à Fase Basal (IC de 98,33% para diferença entre os tratamentos): APIDRA pré-refeição versus Insulina humana regular - 0,13 (-0,26; 0,01); APIDRA pós-refeição versus Insulina humana regular 0,02 (-0,11; 0,16); APIDRA pós-refeição versus pré-refeição 0,15 (0,02; 0,29).
* Diferença entre os tratamentos da alteração média ajustada em relação à Fase Basal (IC de 98,33% para diferença entre os tratamentos): APIDRA pré-refeição versus Insulina humana regular - 0,13 (-0,26; 0,01); APIDRA pós-refeição versus Insulina humana regular 0,02 (-0,11; 0,16); APIDRA pós-refeição versus pré-refeição 0,15 (0,02; 0,29).
** Eventos que necessitaram de assistência de terceiros durante toda a fase de tratamento.
Infusão Subcutânea Contínua de Insulina (substância ativa) (ISCI) (Diabetes Tipo 1)
Para avaliar o uso de Insulina (substância ativa) para administração por bomba externa, um estudo randomizado, controlado por medicamento ativo e aberto de 12 semanas de duração (Insulina (substância ativa) versus Insulina (substância ativa) aspart) foi realizado em pacientes com diabetes Tipo 1 (n = 59).
Observou-se uma taxa mensal baixa de oclusão de cateter nos dois grupos de tratamento (Insulina (substância ativa): 0,08 oclusões/mês; Insulina (substância ativa) aspart: 0,15 oclusões/mês). Observou-se incidência semelhante de reações no local da infusão com Insulina (substância ativa) (n = 3/29; 10,3%) e Insulina (substância ativa) aspart (n = 4/30; 13,3%). Insulina (substância ativa) foi estudada nas seguintes bombas e equipamentos de infusão: Disetronic H-Tron plus V100 e D-Tron TM com cateteres Disetronic (Rapid, Rapid C e D e Tender); MiniMed Modelos 506, 507, 507c e 508 com catéteres MiniMed (Sof-set Ultimate QR e Quick-set).
Características farmacológicas
Propriedades farmacodinâmicas
Mecanismo de ação
A atividade principal das Insulinas (substância ativa) e dos análogos de Insulina (substância ativa), incluindo a Insulina glulisina, é a regulação do metabolismo de glicose. As Insulinas (substância ativa) diminuem os níveis de glicemia estimulando a captação periférica de glicose por músculos esqueléticos e gordura e inibindo a produção de glicose hepática. As Insulinas (substância ativa) inibem a lipólise nos adipócitos, inibem a proteólise e aumentam a síntese de proteínas.
Após a administração subcutânea, o efeito de Insulina (substância ativa) apresenta início de ação mais rápido e duração mais curta do que a Insulina humana regular.
As atividades hipoglicemiantes de Insulina (substância ativa) e da Insulina humana regular são equipotentes quando administradas por via intravenosa. Dois estudos de fase I avaliaram a administração intravenosa de Insulina (substância ativa). Nestes estudos este medicamento demonstrou ser seguro e bem tolerado.
Os estudos em voluntários saudáveis e pacientes diabéticos demonstraram que Insulina (substância ativa) apresenta início de ação mais rápido e duração de atividade mais curta do que a Insulina humana regular quando administrada por via subcutânea.
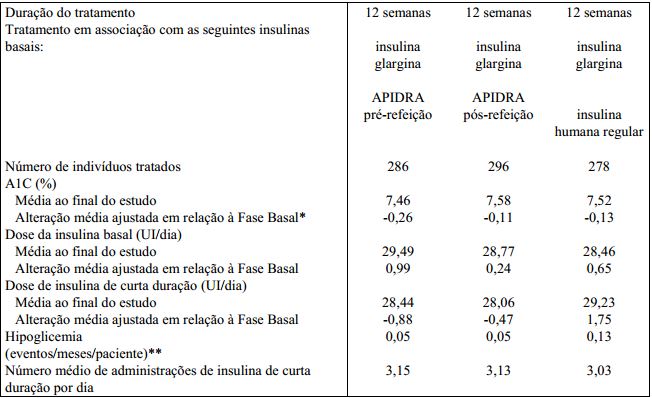
Em um estudo em pacientes com diabetes Tipo 1 (n = 20), os perfis de redução de glicose de Insulina (substância ativa) e da Insulina humana regular, na dose de 0,15 UI/kg, foram avaliados em vários pontos de tempo em relação a uma refeição padrão. (vide Figura 1).
Figura 1 Efeito hipoglicemiante por 6 horas. Insulina (substância ativa) administrada 2 minutos (Insulina-pré) antes do início de uma refeição em comparação à Insulina humana regular administrada 30 minutos (Regular - 30 min.) antes do início da refeição (Figura 1A) e em comparação à Insulina humana regular (Regular-pré) administrada 2 minutos antes de uma refeição (Figura 1B). Insulina (substância ativa) administrada 15 minutos (Insulina-pós) após o início de uma refeição em comparação à Insulina humana regular (Regular-pré) administrada 2 minutos antes de uma refeição (Figura 1C). No eixo X, zero (0) é o início de uma refeição de 15 minutos:
Propriedades farmacocinéticas
Absorção e biodisponibilidade
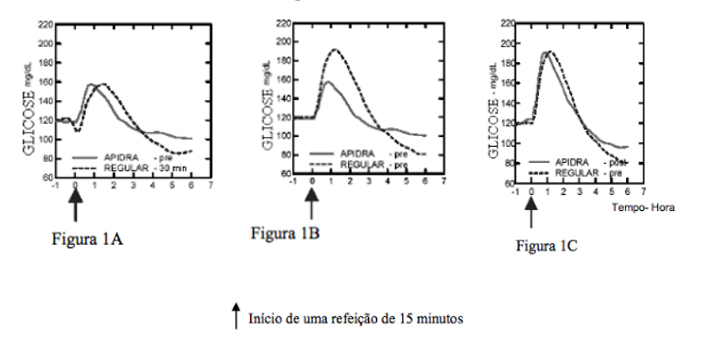
Os perfis farmacocinéticos em voluntários saudáveis e pacientes diabéticos (Tipo 1 ou 2) demonstraram que a absorção da Insulina glulisina foi cerca de 2 vezes mais rápida com concentração máxima aproximadamente 2 vezes maior do que a da Insulina humana regular.
Em um estudo em pacientes com diabetes Tipo 1 (n=20) após a administração SC de 0,15 UI/kg, o Tmáx foi de 55 minutos e a Cmáx de 82 ?UI/mL para Insulina glulisina em comparação a Tmáx de 82 minutos e Cmáx de 46 ?UI/mL para Insulina (substância ativa) humana regular. O tempo médio de residência da Insulina glulisina foi menor (98 min) do que o da Insulina humana regular (161 minutos) (vide Figura 2).
Figura 2 Perfil farmacocinético da Insulina glulisina e da Insulina humana regular em pacientes com diabetes Tipo 1 após uma dose de 0,15 UI/kg:
Quando Insulina (substância ativa) foi administrada por via SC em diferentes regiões do corpo, as curvas de concentração versus tempo foram semelhantes com uma absorção um pouco mais rápida quando administrada no abdome do que no músculo deltoide ou na coxa. A biodisponibilidade absoluta da Insulina glulisina após administração SC é de cerca de 70%, independentemente da região de administração (abdome 73%, deltoide 71%, coxa 68%).
Distribuição e eliminação
A distribuição e a eliminação da Insulina glulisina e da Insulina humana regular após a administração intravenosa são semelhantes com volumes de distribuição de 13 L e 21 L e meias-vidas de 13 e 17 minutos, respectivamente.
Após a administração subcutânea, a Insulina glulisina é eliminada mais rapidamente do que a Insulina humana regular com meia-vida aparente de 42 minutos em comparação a 86 minutos.
Raça e Sexo
Não estão disponíveis informações sobre os efeitos da raça e do sexo sobre a farmacocinética de Insulina (substância ativa). No entanto, em estudos clínicos Fase III em adultos (n=2.408), as análises de subgrupo por sexo não mostraram diferenças de segurança e eficácia entre Insulina (substância ativa) e outras formulações de Insulina (substância ativa) de curta duração.
Pacientes pediátricos
As propriedades farmacocinéticas e farmacodinâmicas de Insulina (substância ativa) e da Insulina humana regular foram avaliadas em um estudo conduzido em pacientes pediátricos com diabetes Tipo 1 ([crianças de 7 - 11 anos, n = 10] e adolescentes [ 12 - 16 anos, n = 10]). As diferenças relativas na farmacocinética e na farmacodinâmica entre Insulina (substância ativa) e Insulina humana regular em pacientes pediátricos com diabetes Tipo 1 foram semelhantes àquelas observadas em adultos saudáveis e adultos com diabetes Tipo 1.
Insuficiência hepática
O efeito da insuficiência hepática sobre a farmacocinética de Insulina (substância ativa) não foi estudado. No entanto, alguns estudos com Insulina humana demonstraram aumento dos níveis circulantes de Insulina (substância ativa) em pacientes com insuficiência hepática.
Obesidade
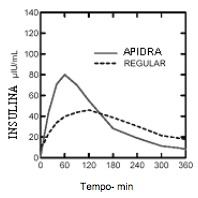
O início de ação mais rápido e a duração da atividade mais curta de Insulina (substância ativa) e da Insulina (substância ativa) lispro em comparação à Insulina humana regular foram mantidos em uma população obesa não diabética. A manutenção do início de ação rápida com a Insulina glulisina foi melhor do que com a Insulina (substância ativa) lispro (vide Figura 3).
Figura 3 Velocidades de infusão da glicose (VIG) após administração SC de 0,3 UI/kg de Insulina (substância ativa), Insulina (substância ativa) lispro ou Insulina humana regular em uma população obesa:
Insuficiência renal
Os estudos com Insulina humana demonstraram aumento dos níveis circulantes de Insulina (substância ativa) em pacientes com insuficiência renal. Em um estudo realizado em 24 indivíduos não diabéticos com uma ampla variedade de função renal (CrCl > 80 mL/min; 30-50 mL/min; <30 mL/min), as propriedades farmacocinéticas de Insulina (substância ativa) foram geralmente mantidas.
Gravidez
O efeito da gravidez sobre a farmacocinética e a farmacodinâmica de Insulina (substância ativa) não foi estudado.
Dados pré-clínicos de segurança
Carcinogênese
Ainda não foram realizados estudos padrão de carcinogenicidade de 2 anos de duração em animais para avaliar o potencial carcinogênico de Insulina (substância ativa).
Em ratos Sprague Dawley, foi realizado um estudo de toxicidade de dose repetida de 12 meses com Insulina glulisina nas doses de 2,5; 5; 20 ou 50 UI/kg duas vezes por dia (dose que resulta em uma exposição equivalente de aproximadamente 26, 54, 258, 662 vezes a Cmáx humana na dose média em seres humanos, respectivamente).
Houve uma incidência não dose dependente maior de tumores da glândula mamária em ratas tratadas com Insulina (substância ativa) em comparação aos controles não tratados.
A incidência de tumores mamários com Insulina (substância ativa) e Insulina humana regular foi semelhante. A importância desses achados para humanos ainda é desconhecida.
Nesse estudo, os efeitos da Insulina glulisina sobre a proliferação celular nas glândulas mamárias foram avaliados por imunohistoquímica para Ki-67. Não houve diferença significativa de proliferação das células mamárias entre a Insulina glulisina, a Insulina humana regular e os grupos controle.
Mutagênese
Insulina (substância ativa) não foi mutagênica nos seguintes testes: teste de Ames, teste in vitro de aberração cromossômica em mamíferos em células V79 e teste in vivo de aberração cromossômica em mamíferos (teste de micronúcleo de eritrócitos).
Teratogenicidade
Foram realizados estudos de teratologia e reprodução por via SC com Insulina glulisina em ratos e coelhos utilizando Insulina humana regular como agente comparador. O medicamento foi administrado a ratas durante toda a gestação até 10 UI/kg uma vez por dia (dose que resulta em uma exposição equivalente a aproximadamente 50 vezes a Cmáx humana na dose média em humanos). A Insulina glulisina não apresentou efeitos tóxicos sobre o desenvolvimento embrio-fetal em ratos.
O medicamento foi administrado a coelhas durante toda a gestação até 1,5 UI/kg/dia. Foram observados efeitos adversos sobre o desenvolvimento embrio-fetal apenas em doses tóxicas maternas indutoras de hipoglicemia. Foi observada maior incidência de perdas pós implantação e defeitos esqueléticos na dose de 1,5 UI/kg uma vez por dia (dose que resulta em uma exposição equivalente a aproximadamente 25 vezes a Cmáx humana na dose média em humanos) que também causou mortalidade em fêmeas.
Foi observada incidência um pouco aumentada de perdas pós implantação no nível de dose mais baixa seguinte de 0,5 UI/kg uma vez por dia (dose que resulta em uma exposição equivalente a aproximadamente 5 vezes a Cmáx humana na dose média em humanos) que também foi associada a hipoglicemia severa, mas não houve defeitos nessa dose. Não foram observados efeitos em coelhos na dose de 0,25 UI/kg uma vez por dia (dose que resulta em uma exposição equivalente a aproximadamente 3 vezes a Cmáx humana na dose média em humanos).
Os efeitos de Insulina (substância ativa) não diferiram daqueles observados com a Insulina humana regular subcutânea nas mesmas doses e foram atribuídos a efeitos secundários da hipoglicemia materna.
Comprometimento da fertilidade
Em estudos de fertilidade em ratos machos e fêmeas nas doses SC até 10 UI/kg uma vez por dia (dose que resulta em uma exposição equivalente a aproximadamente 50 vezes a Cmáx humana na dose média em humanos), não foram observados efeitos adversos sobre a fertilidade masculina e feminina ou no desempenho reprodutivo geral dos animais.