Bula
Avonex 30Mcg/0,5Ml 4 Seringas + 4 AgulhasATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Bula - Avonex 30Mcg/0,5Ml 4 Seringas + 4 Agulhas
Para que serve
É indicado no tratamento de esclerose múltipla recorrente- remitente (EM) Uma recorrência (ou surto) define-se como um agravamento dos sintomas da EM, seguidas de melhoria ou desaparecimento dos mesmos AVONEX (betainterferona 1a) mostrou-se eficaz em retardar a progressão da doença e reduzir a frequência dos surtos.
Também é indicado no tratamento de pacientes que tenham passado por eventos de desmielinização simples.
A administração de AVONEX (betainterferona 1a) deve ser interrompida em pacientes que desenvolvam esclerose múltipla progressiva.
Contraindicação
Este medicamento é contraindicado para uso por pacientes com história de hipersensibilidade à betainterferona natural ou recombinante, ou a qualquer outro componente da fórmula.
Este medicamento é contraindicado para uso por pacientes na gravidez e na amamentação.
Como usar
Se seu médico ou enfermeira recomendar a auto-injeção, você deverá ser instruído quanto a preparação e as técnicas de auto-injeção de AVONEX? (betainterferona 1a).
Não tente a auto-administração até que tenha certeza que entendeu todos os passos para a preparação do produto, bem como a aplicação de uma auto-injeção.
Cada embalagem de AVONEX (betainterferona 1a) contém 4 suportes plásticos selados, cada um com 1 seringa pronta para uso e 1 agulha 6 Conteúdo do suporte plástico:
Preparação:
Retire um suporte plástico do refrigerador Assegure-se que a seringa preenchida e a agulha estejam no suporte plástico selado antes do procedimento.
Deixe que o produto atinja a temperatura ambiente (15 a 30C) por aproximadamente 30 minutos antes da injeção Isto tornará a administração mais confortável.
Precauções
Advertências e Precauções: AVONEX (betainterferona 1a) deve ser administrado com cuidado em pacientes com depressão ou com histórico de depressão, principalmente pacientes com antecedentes de idéias suicidas Informe imediatamente ao seu médico qualquer sintoma de depressão e/ou pensamento suicida AVONEX (betainterferona 1a) deve ser administrado com cuidado em pacientes com histórico de convulsões e em pacientes recebendo tratamento com antiepiléticos.
Pacientes com doença cardíaca, como angina, insuficiência cardíaca congestiva ou arritmia, devem ser atentamente monitorados quanto à piora de sua condição clínica durante o tratamento com AVONEX? (betainterferona 1a).
Recomenda-se precaução e uma cuidadosa monitoração ao administrar AVONEX (betainterferona 1a) para pacientes com insuficiência renal e hepática graves.
Pacientes com mielossupressão podem requerer monitoramento mais intenso de contagem total de células sanguíneas, com contagem diferencial de células brancas e plaquetas.
A função da tireóide deve ser monitorada periodicamente AVONEX (betainterferona 1a) deve ser administrado com cuidado em pacientes com 12 a 16 anos de idade.
Gravidez e lactação:
As informações sobre o uso de AVONEX (betainterferona 1a) durante a gravidez são limitadas. Os dados disponíveis indicam que pode haver um aumento no risco de aborto espontâneo.
Se engravidar, suspenda o tratamento com AVONEX (betainterferona 1a) e procure imediatamente seu médico.
Mulheres em idade fértil devem utilizar métodos contraceptivos adequados.
Não se sabe se a betainterferona 1a é excretada no leite humano.
Reações Adversas
A incidência mais elevada de reações adversas associadas à terapêutica com Betainterferona 1A (substância ativa) está relacionada aos sintomas pseudogripais. Os sintomas tendem a ser mais significativos no início do tratamento e diminuem com o passar do tempo. Dependendo da formulação, aproximadamente 70% dos pacientes tratados com Betainterferona 1A (substância ativa) podem apresentar sintomas típicos da gripe nos primeiros seis meses de tratamento. De forma similar, aproximadamente 30% dos pacientes ou mais, dependendo da formulação, podem também apresentar reações no local da injeção, predominantemente inflamação leve ou eritema. Elevações assintomáticas nos parâmetros laboratoriais da função hepática e diminuição na contagem leucocitária também são frequentes.
Reações adversas por frequência
As reações adversas apresentadas a seguir foram identificadas em estudos clínicos, assim como a partir de relatos pós-comercialização (um asterisco [*] indica as reações adversas identificadas durante a vigilância pós-comercialização). As definições que se seguem aplicam-se à terminologia de frequência utilizada doravante.
- Reação muito comum (> 1/10);
- Reação comum (> 1/100 e < 1/10);
- Reação incomum (> 1/1.000 e < 1/100);
- Reação rara (> 1/10.000 e < 1/1.000);
- Reação muito rara (< 1/10.000);
- Frequência desconhecida (não pode ser calculada a partir dos dados disponíveis).
| Classe de sistema de órgãos | Categoria de frequência | Reações adversas |
| Distúrbios do sangue e do sistema linfático | Muito comuns | Neutropenia, linfopenia, leucopenia, trombocitopenia, anemia. |
| Raros | Microangiopatia trombótica, incluindo púrpura trombocitopênica trombótica/síndrome hemolíticourêmica*, pancitopenia*. | |
| Distúrbios endócrinos | Incomuns | Disfunção da tiroide, geralmente se apresentando como hipo ou hipertiroidismo. |
| Distúrbios do sistema imunológico | Raros | Reações anafiláticas*. |
| Distúrbios hepatobiliares | Muito comuns | Elevação assintomática das transaminases. |
| Comuns | Elevação grave das transaminases. | |
| Incomuns | Hepatite com ou sem icterícia*. | |
| Raros | Insuficiência hepática*, hepatite autoimune*. | |
| Distúrbios psiquiátricos | Comuns | Depressão, insônia. |
| Raros | Tentativa de suicídio*. | |
| Distúrbios do sistema nervoso | Muito comuns | Cefaleia. |
| Incomuns | Convulsões*. | |
| Frequência desconhecida | Sintomas neurológicos transitórios (como hipoestesia, espasmos musculares, paraestesia, dificuldade para caminhar, rigidez músculo-esquelética), que podem parecer exacerbações da esclerose múltipla*. | |
| Distúrbios oculares | Incomuns | Distúrbios da vascularização retiniana (como retinopatia, exsudato algodonoso, obstrução da artéria ou veia retiniana*. |
| Distúrbios vasculares | Incomuns | Distúrbios tromboembólicos*. |
| Distúrbios respiratórios, torácicos e do mediastino | Incomuns | Dispneia*. |
| Distúrbios gastrintestinais | Comuns | Diarreia, vômitos, náuseas*. |
| Distúrbios dos tecidos cutâneo e subcutâneo | Comuns | Prurido, erupção cutânea, erupção cutânea eritematosa, erupção máculo-papulosa, alopecia*. |
| Incomuns | Urticária*. | |
| Raros | Edema de Quincke (angioedema)*, eritema multiforme*, reações cutâneas do tipo eritema multiforme*, Síndrome de Stevens-Johnson*. | |
| Distúrbios músculo-esqueléticos e do tecido conjuntivo | Comuns | Mialgias, artralgias |
| Raros | Lúpus eritematoso induzido por medicamentos*. | |
| Distúrbios gerais e alterações no local de administração | Muito comuns | Inflamação no local da injeção, reações no local da injeção (como inchaço, hematomas, vermelhidão), sintomas do tipo gripal. |
| Comuns | Dor no local da injeção, fadiga, calafrios, febre. | |
| Incomuns | Necrose no local da injeção, massa no local da injeção, abcesso no local da injeção, infecção no local da injeção (que pode ser grave)*, aumento da sudorese*. | |
| Raros | Celulite no local da injeção, que pode ser grave.* |
A maioria das reações adversas observadas com a Betainterferona 1A (substância ativa) são habitualmente leves e reversíveis, regredindo com a redução da dose. No caso de efeitos indesejáveis graves ou persistentes, a dose de Betainterferona 1A (substância ativa) pode ser temporariamente reduzida ou interrompida, segundo critério médico.
Betainterferona 1A (substância ativa), como qualquer outra Betainterferona 1A (substância ativa), apresenta potencial para induzir lesão hepática grave. O mecanismo da rara disfunção hepática sintomática é desconhecido. A maioria dos casos de lesão hepática grave ocorre durante os primeiros seis meses de tratamento. Não foram identificados fatores de risco específicos. O tratamento com Betainterferona 1A (substância ativa) deve ser suspenso caso ocorra icterícia ou outros sintomas clínicos de disfunção hepática.
A administração de interferonas tem sido associada à anorexia, tonturas, ansiedade, arritmias, vasodilatação e palpitações, menorragia e metrorragia.
Durante o tratamento com Betainterferona 1A (substância ativa), pode ocorrer um aumento da formação de autoanticorpos.
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Composição
Cada 0,5 mL contém: betainterferona 1a 30 mcg (6 000 000 UI) Excipientes: acetato de sódio triidratado, ácido acético, cloridrato de arginina, polissorbato 20 e água para injetáveis.
Interação Medicamentosa
Não foram efetuados estudos de interações medicamentosas com Betainterferona 1A (substância ativa) em seres humanos.
Tem sido relatado que as interferonas podem reduzir em seres humanos e animais a atividade das enzimas dependentes do citocromo P450. É necessário cautela ao se administrar Betainterferona 1A (substância ativa) em combinação com medicamentos que têm índice terapêutico estreito e que sejam em grande parte dependente do sistema hepático citocromo P450 de depuração, por exemplo, antiepilépticos e algumas classes de antidepressivos.
A interação do Betainterferona 1A (substância ativa) com corticosteroides ou hormônio adrenocorticotrófico (ACTH) não foi estudada sistematicamente. Estudos clínicos indicam que pacientes com esclerose múltipla podem receber Betainterferona 1A (substância ativa) e corticosteroides ou ACTH durante os surtos.
Ação da Substância
Resultados de eficácia
Esclerose múltipla recidivante-remitente
O estudo PRISMS demonstrou que pacientes com esclerose múltipla recidivante apresentaram maior benefício, por meio de avaliação clínica e de ressonância magnética por imagem (RMI), com o uso de 44 µg (3 x semana), em comparação com a menor dose de 22 µg (3 x semana). Os dados de quatro anos também demonstraram que a progressão da incapacidade, surtos e atividade na RMI foram insignificantes nos pacientes que receberam Betainterferona 1A (substância ativa) 44 µg (3 x semana) durante o estudo e maiores no grupo que recebeu placebo durante 1-2 anos, seguido de Betainterferona 1A (substância ativa) 22 µg (3 x semana) nos anos 3-4 (The PRISMS Study Group & the University of Britsh Columbia MS/MRI Analysis Group, 2001).
Ocorreu uma potencial perda dos benefícios do tratamento com Betainterferona 1A (substância ativa) devido à demora do início do tratamento ou por perda de cursos de tratamento tempo-dose dependentes não ótimos, que não puderam ser posteriormente recuperados. Além disso, como o processo dadoença evoluiu, diminuiu a extensão dos benefícios que poderiam ser obtidos com a Betainterferona 1A (substância ativa). Em estudos clínicos realizados com pacientes portadores de esclerose múltipla secundária progressiva com surtos, foi demonstrado que o tratamento com Betainterferona 1A (substância ativa) trouxe um benefício significativo relacionado à exacerbação. Nenhum efeito significativo pôde ser demonstrado em pacientes com EM secundária progressiva mais avançada (sem surtos).
A segurança e eficácia do Betainterferona 1A (substância ativa) têm sido avaliadas em pacientes com esclerose múltipla recidivanteremitente com doses variando entre 11 e 44 microgramas (3-12 MUI), administradas por via subcutânea três vezes por semana. Com a posologia autorizada, Betainterferona 1A (substância ativa) 44 microgramas demonstrou diminuir a incidência (cerca de 30% ao fim de 2 anos) e a gravidade dos surtos clínicos. A proporção de pacientes com progressão da incapacidade, conforme definida por pelo menos o aumento de um ponto na EDSS, confirmada após três meses, sofreu uma redução de 39% (placebo) para 27% (Betainterferona 1A (substância ativa) 44 microgramas).
Ao fim de 4 anos, a redução da taxa média de exacerbações foi de 22% no grupo de pacientes tratados com Betainterferona 1A (substância ativa) 22 microgramas e de 29% no grupo de pacientes tratados com Betainterferona 1A (substância ativa) 44 microgramas, em comparação com um grupo de pacientes tratados com placebo durante 2 anos e com Betainterferona 1A (substância ativa) 22 ou 44 durante os 2 anos seguintes.
Esclerose múltipla secundária progressiva
Num estudo de três anos em pacientes com esclerose múltipla secundária progressiva (EDSS 3-6.5), Betainterferona 1A (substância ativa) não apresentou um efeito significativo na progressão da incapacidade, mas reduziu a taxa de surtos em aproximadamente 30%.
Se a população de pacientes for dividida em 2 subgrupos (os que apresentaram surtos no período precedente de 2 anos à inclusão no estudo e os que não apresentaram), não se observa qualquer efeito na incapacidade dos pacientes sem surtos, mas nos pacientes com surtos a proporção de progressão da incapacidade no fim do estudo apresentou uma redução de 70% (placebo) para 57% (Betainterferona 1A (substância ativa) 22 microgramas combinado com Betainterferona 1A (substância ativa) 44 microgramas). Os resultados obtidos posteriormente neste subgrupo deverão ser interpretados com precaução.
Evento clínico único sugestivo de esclerose múltipla
Um ensaio clínico controlado com Betainterferona 1A (substância ativa) com duração de dois anos foi realizado em pacientes com um único evento clínico sugestivo de desmielinização causada por esclerose múltipla. Os pacientes incluídos no estudo tinham pelo menos duas lesões clinicamente silenciosas na imagem por ressonância magnética ponderada em T2, com um tamanho de pelo menos 3 mm, em que pelo menos uma foi ovoide, periventricular ou infratentorial. Qualquer outra doença diferente da esclerose múltipla que pudesse explicar melhor os sinais e sintomas do paciente tinha de ser excluída.
Os pacientes foram selecionados aleatoriamente em duplo-cego em grupos recebendo Betainterferona 1A (substância ativa) 44 microgramas administrado três vezes por semana, Betainterferona 1A (substância ativa) 44 microgramas administrado uma vez por semana ou placebo. Se ocorresse um segundo evento clínico desmielinizante confirmando a esclerose múltipla definida, os pacientes mudavam para a posologia recomendada de Betainterferona 1A (substância ativa) 44 microgramas administrado três vezes por semana numa concepção aberta, mantendo-se simultaneamente a ocultação relativamente à seleção aleatória inicial.
A média de idade foi de 29 anos, variando de 17 a 51 anos. Os resultados da eficácia de Betainterferona 1A (substância ativa) 44 microgramas administrado três vezes por semana comparativamente com placebo obtidos neste estudo são os seguintes:
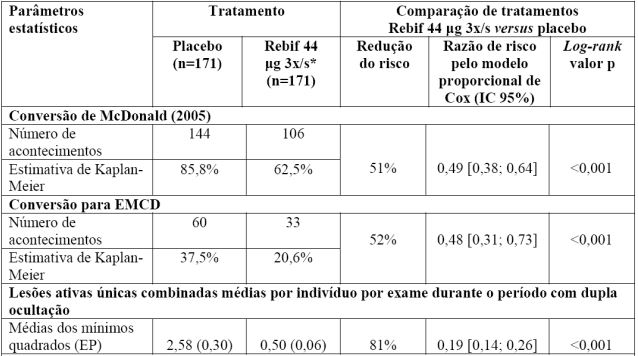 *3x/s - Três vezes por semana.
*3x/s - Três vezes por semana.
Até o momento não existe uma definição bem estabelecida de paciente em alto risco, embora a abordagem mais conservadora seja a de aceitar pelo menos nove lesões hiperintensas em T2 na RMN inicial e pelo menos uma nova lesão em T2, ou uma nova lesão intensificada com Gd numa RMN de seguimento efetuada pelo menos um mês após a RMN inicial. Em qualquer dos casos, o tratamento só deve ser considerado em pacientes classificados como de alto risco.
Uso em idosos
Não existem dados disponíveis relativos ao uso do Betainterferona 1A (substância ativa) em pacientes idosos para o tratamento de evento clínico único sugestivo de esclerose múltipla.
Esclerose múltipla primária progressiva
Betainterferona 1A (substância ativa) não foi ainda investigado em pacientes com esclerose múltipla primária progressiva, não devendo ser utilizado nestes pacientes.
Características Farmacológicas
Propriedades farmacodinâmicas
As interferonas são um grupo de glicoproteínas endógenas com propriedades imunomoduladoras, antivirais e antiproliferativas. Betainterferona 1A (substância ativa) partilha a mesma sequência de aminoácidos com a Betainterferona 1A (substância ativa) humana endógena. É produzido em células de mamífero (ovário de hamster chinês), sendo, portanto, glicosilado como a proteína natural. O mecanismo de ação preciso do Betainterferona 1A (substância ativa) na escl rose múltipla continua ainda em estudo.
Independentemente da via de administração, alterações farmacodinâmicas pronunciadas estão associadas com a administração de Betainterferona 1A (substância ativa). Após uma dose única, a atividade intracelular e sérica da 2’5’OAS sintetase e as concentrações séricas de beta-2 microglobulina e de neopterina aumentam dentro de 24 horas, e começam a diminuir em 2 dias. As administrações por via intramuscular e subcutânea produzem respostas totalmente sobreponíveis.
Marcadores de resposta biológica (por exemplo, 2',5'-OAS atividade, neopterina e beta-2 microglobulina) são induzidos pela Betainterferona 1A (substância ativa) após doses subcutâneas administradas a voluntários sadios e a pacientes com esclerose múltipla. Os tempos para as concentrações de pico após uma única injeção subcutânea foram de 24 a 48 horas para neopterina, beta-2 microglobulina e 2'5'OAS, 12 horas para MX1 e 24 horas para a expressão dos genes OAS1 e OAS2. Foram observados picos de altura e tempo semelhantes para a maioria destes marcadores após a primeira e a sexta administrações. A administração de Betainterferona 1A (substância ativa) 22 microgramas três vezes por semana inibiu a liberação de citocinas pró-inflamatórias (IFN-?, IL-1, IL-6, TNF-? e TNF-?) induzida por mitogênio por células mononucleares de sangue periférico que, em média, foi perto de duas vezes aquela observada com Betainterferona 1A (substância ativa) 22 ou 66 microgramas administrado uma vez por semana.
São desconhecidas as relações entre os níveis séricos de Betainterferona 1A (substância ativa) e as atividades farmacodinâmicas mensuráveis para o(s) mecanismo(s) pelo(s) qual(is) a Betainterferona 1A (substância ativa) exerce seus efeitos sobre a esclerose múltipla. Não foram observados efeitos relacionados com o sexo nos parâmetros farmacodinâmicos.
Propriedades farmacocinéticas
Absorção
Após a administração intravenosa em voluntários sadios, a Betainterferona 1A (substância ativa) demonstra um declínio multiexponencial marcado, com níveis séricos proporcionais à dose. A meia-vida inicial é da ordem de minutos e a meia-vida terminal de várias horas. Quando administrado por via subcutânea ou intramuscular, os níveis séricos da Betainterferona 1A (substância ativa) permanecem baixos, mas são ainda mensuráveis até 12 a 24 horas após a administração. As administrações por via subcutânea ou intramuscular de Betainterferona 1A (substância ativa) produzem uma exposição equivalente à Betainterferona 1A (substância ativa).
Distribuição
Concentrações máximas foram observadas 3-8 horas após injeções subcutâneas repetidas de Betainterferona 1A (substância ativa) em doses de 22 e 44 microgramas.
Eliminação
Após doses subcutâneas repetidas em voluntários sadios, os principais parâmetros farmacocinéticos (AUCtau e Cmax) aumentaram proporcionalmente ao aumento da dose de 22 microgramas para 44 microgramas. A meia-vida aparente é estimada em 50 a 60 horas, o que está em consonância com a acumulação observada após administração de doses múltiplas.
Metabolismo
A Betainterferona 1A (substância ativa) é metabolizada e excretada principalmente pelo fígado e pelos rins.
Não foram observados efeitos relacionados com o sexo nos parâmetros farmacocinéticos. Não foi estabelecida a farmacocinética de Betainterferona 1A (substância ativa) em pacientes pediátricos e geriátricos ou em pacientes com insuficiência renal ou hepática.
Dados pré-clínicos
Os dados não clínicos não revelam riscos especiais para o ser humano, segundo estudos convencionais de farmacologia de segurança, toxicidade de dose repetida e genotoxicidade.
Betainterferona 1A (substância ativa) não foi avaliado com relação à carcinogenicidade. Um estudo de toxicidade embriofetal em macacos demonstrou não haver evidência de alterações reprodutivas. Com base em observações com outras interferonas alfa e beta, não pode ser excluído um risco aumentado de aborto. Não existe informação disponível sobre os efeitos do interferona beta-1a na fertilidade masculina.