Bula
Blaztere - Ácido ZoledrnicoATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Bula - Blaztere - Ácido Zoledrnico
Para que serve
Este medicamento é usado para tratar a metástase óssea e reduzir a quantidade de cálcio no sangue de pacientes com hipercalcemia induzida por tumor (HIT).
Blastere também é indicado para a prevenção de eventos relacionados ao esqueleto, como fraturas de ordem patológica, compressão medular, radioterapia e cirurgia ortopédica ou hipercalcemia induzida por tumor, em pacientes com câncer metastático ósseo.
Como Blastere funciona?
O ácido zoledrônico faz parte de uma nova classe de bisfosfonatos de alta potência com atuação específica nos ossos. Dentre os fármacos inibidores da reabsorção óssea, o ácido zoledrônico é um dos mais potentes conhecidos até o momento.
Devido a sua elevada afinidade pelas células ósseas mineralizadas, os bisfosfonatos atuam de forma seletiva nos ossos, porém o mecanismo de ação preciso que leva a inibição da atividade dos osteoclastos ainda é desconhecido.
O ácido zoledrônico apresenta diversas propriedades anti-tumorais, podendo contribuir para a eficácia global no tratamento da doença óssea metastática.
Contraindicação
Blaztere não deve ser usado, por pacientes alérgicos ao ácido zoledrônico bem como outros bisfosfonatos (grupo de substâncias do Blaztere) ou a qualquer ingredientes da fórmula.
Blaztere é contraindicado para uso em mulheres grávidas e/ou em período de amamentação.
Blastere é contra indicado para crianças.
Como usar
Blaztere pode ser preparado e administrado apenas por um profissional de saúde com experiência na administração de bisfosfonatos intravenosos, e que esteja em ambiente hospitalar ou em clínicas com infra-estrutura adequada.
A solução contendo Blaztere deve ser administrada por infusão intravenosa única em não menos que 15 minutos em um cateter separado de todas as outras drogas.
Blaztere deve ser primeiramente reconstituído com 5 mL de água para injeção, obtendo assim, uma solução de concentração de 0,8 mg/mL.
O conteúdo remanescente do frasco-ampola deve ser descartado. Imediatamente após a reconstituição a solução deve ser diluída em bolsas de 100 mL.
Se uma dose menor de Blaztere for necessária, retire primeiramente o volume apropriado da solução reconstituída e dilua em 100 mL de solução estéril de cloreto de sódio 0,9% ou solução de glicose 5% para infusão.
Não misture a solução concentrada de Blaztere com soluções contendo cálcio ou outro cátion bivalente como solução de Ringer lactato.
A freqüência para você receber o Blaztere deve ser decidida pelo seu médico.
Se você está sendo tratado para a prevenção de eventos relacionados ao esqueleto, com tumor avançado com comprometimento ósseo a dose recomendada para o tratamento é de 4 mg de Blaztere ( 1 dose por infusão), a cada 3 a 4 semanas.
Suplementos orais diários de cálcio 500 mg e vitamina D 400 UI são recomendados aos pacientes, desde o início do tratamento.
Se você está sendo tratado para HIT (hipercalcemia induzida por tumor), a dose recomendada é de 4 mg de Blaztere (1 dose por infusão).
A sua adequada hidratação deve ser verificada antes do início da infusão do Blaztere.
O que devo fazer quando eu me esquecer de usar Blaztere?
Este medicamento é restrito para uso hospitalar, não podendo ser utilizado diretamente pelo paciente.
Precauções
Antes de iniciar o tratamento com Blaztere é importante informar seu medico se:
- Você utiliza outro medicamento a base de ácido zoledrônico;
- Você já apresentou ou apresenta problemas renais;
- Você já apresentou ou apresenta problemas no fígado;
- Você já apresentou ou apresenta problemas no coração;
- Você faz ou pretende fazer algum tipo de tratamento odontológico;
Se você estiver sob tratamento odontológico avise seu dentista do seu tratamento com Blaztere.
Procedimentos odontológicos invasivos devem ser evitados.
Antes do uso de Blaztere certifique-se que você ingeriu líquido suficiente conforme orientação médica, para evitar sua desidratação.
Interação medicamentosa
Avise seu médico quais os medicamentos que você use ou tenha usado, incluindo aqueles que não foram prescritos por um médico.
Seu médico deve ser informado caso você faça uso de aminoglicanos (tipo de medicamento usado para infecções graves), pois a combinação desse tipo de medicamento com Blaztere, pode fazer com que o nível de cálcio no sangue se torne muito baixo.
Advertências
Gravidez
Este medicamento não pode ser usado durante a gravidez, Avise seu médico no caso de estar ou desconfiar que possa estar grávida.
Lactação
Este medicamento não deve ser utilizado em período de amamentação.
Avise seu médico caso esteja amamentando. A eliminação do ativo de Blaztere, no leite humano não é conhecida.
Uso em idosos
Pacientes idosos podem fazer o uso de Blaztere. Não existem evidências de necessidade de precauções adicionais ao uso de Blaztere em pacientes idosos.
Efeitos sobre a habilidade de dirigir veículos e, ou operar máquinas
Não existem estudos realizados sobre a habilidade de dirigir veículos e ou operar máquinas para pacientes em tratamento com Blaztere, é recomendado cautela para execução de atividades que necessitem de sua atenção.
Informe ao seu médico ou cirurgião dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
Avise imediatamente seu médico sobre qualquer um dos seguintes eventos adversos
Aumento da temperatura corpórea. Pacientes em uso de Blaztere têm relatado comumente dores de cabeça e sintomas e gripe como febre, fadiga, fraqueza, sonolência, calafrios, e dores ósseas, musculares e nas juntas.
Na maioria dos casos nenhum tratamento específico é necessário e os sintomas diminuem após algumas horas ou dias.
Casos muito raros foram relatados de dores graves e ocasionalmente incapacitante nos ossos, músculos e/ou nas juntas.
Raramente (reação incomum), osteonecrose de mandíbula (dano ósseo da mandíbula) pode ocorrer em alguns pacientes. Sintomas desta reação adversa podem ser: dor na boca, nos dentes ou na mandíbula, feridas ou inchaço no interior da boca, dormência ou "sensação de mandíbula pesada" ou dente mole.
Se você sentir qualquer um destes sintomas, avise seu oncologista ou seu dentista imediatamente.
Outras reações adversas são
Reações gastrintestinais tais como náuseas e vômitos foram relatados, bem como perda de apetite.
Ocasionalmente os eventos adversos podem também incluir reações de hipersensibilidade, pressão arterial alta, dificuldade respiratória, tontura, distúrbios do sono, formigamento ou dormência nas mãos e pés, ou diarréia.
Também foram relatados ocasionalmente casos de pressão arterial baixa, os quais, em casos muito raros, resultaram em desmaio.
Casos de rash (bolinhas vermelhas na pele), coceira e dor no peito foram observados.
Raramente podem ocorrer batimento cardíaco lento e confusão mental.
Como com os outros bisfosfonatos (o grupo de substâncias do Blaztere), casos de conjuntivite tem sido relatados.
Foram relatados alterações na função renal através de exames de sangue (níveis mais altos de creatinina) com o uso de Blaztere; tais alterações também são conhecidas por ocorrerem com outras drogas deste tipo. Adicionalmente alguns casos de doença nos rins têm sido reportados, mas não está claro se são causados devido ao tratamento com Blaztere.
Anemia, uma condição na qual o número de células vermelhas sanguíneas é reduzido, foi relatada; contagem baixa de células brancas e de plaquetas foram observados em alguns casos. Os níveis de cálcio, fosfato, magnésio e potássio no sangue podem se tornar muito baixos sem sintomas, seu médico deverá monitorá-los e tomar as medidas necessárias.
As reações adversas são classificadas de acordo de acordo com sua freqüência
| Alterações sanguineas e do Sistema Linfático | |
| Comum | Anemia |
| Pouco Comum | Trompocitopenia e leucopenia |
| Raro | Pancitopenia |
| Alterações do Sistema Nervoso | |
| Comum | Cefaléia |
| Pouco Comum | Tontura, parestesias, alteração do paladar, hipoestesia, hiperestesia e tremores |
| Alterações Psiquiátricas | |
| Pouco Comum | Ansiedade e alteração do sono |
| Raro | Confusão |
| Alterações oculares | |
| Comum | Conjuntivite |
| Pouco Comum | Visão turva |
| Raro | Uveíte, epselerite |
| Alterações gastrointestinais | |
| Comum | Náusea, vómito,anorexia |
| Pouco Comum | Diarréia, obstipação (constipação), dor abdominal, dispepsia,estomatite e boca seca |
| Alterações respitarórias, torácicas e do mediastino | |
| Pouco Comum | Dispinéia e tosse |
| Alterações da Pele e tecidos subcutâneo | |
| Pouco Comum | Prurido, rash ( erupção cutânea - incluindo rash eritematoso e macular) e hiperhidrose |
| Alterações musculo-esqueléticas,do tecidoconjuntivo e ósseo | |
| Comum | Dor óssea, mialgia, artralgia, dor generalizada |
| Pouco Comum | Câimbras musculares |
| Alterações Cardiovasculares | |
| Pouco Comum | Hipertensão e hipotenção |
| Raro | Bradicardia |
| Alterações renais e urinárias | |
| Comum | Insuficiência renal |
| Pouco Comum | Insuficiência renal aguda, hematúria e proteinúria |
| Alterações do Sistema Imunológico | |
| Pouco Comum | Reação de hipersensibilidade |
| Raro | Edema angioneurótico |
| Alterações gerais e do local de administração | |
| Comum | Febre, síndrome tipo gripe (incluindo fadiga, arrepios, mal estar e rubor) |
| Pouco Comum | Astenia, edema periférico, reação do local de administração (incluindo dor, irritação, tumefação, enduração), dor torácica e aumento de peso |
| Alterações laboratoriais | |
| Muito Comum | Hipofosfatemia |
| Comum | Aumento dos níveis sanguineos de creatinina e uréia, hipocalcemia |
| Pouco Comum | Hipomagnesemia, hipocalcemis |
| Raro | Hipercalcemia, hipermatremia |
Composição
Cada frasco-ampola contém:
4mg de ácido zoledrônico (anidro*).
*Equivalente a 4,264mg de ácido zoledrônico monoidratado.
Excipientes: manitol e citrato de sódio.
Superdosagem
Caso você tenha recebido doses maiores que a recomendada, você deve ser monitorado por um médico, nesse caso, pode ser observada, in Blaztere suficiência renal (incluindo falência renal) e anormalidades de eletrólitos séricos (incluindo cálcio, fósforo e magnésio). Uma infusão de suplemento de cálcio pode se fazer necessária.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível . Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações previstas a serem consideradas
Recomenda-se precaução quando os bisfosfonatos como o Ácido Zoledrônico (substância ativa) são administrados com aminoglicosídeos, calcitonina ou diuréticos de alça, uma vez que estes agentes podem ter um efeito aditivo, resultando num nível sérico de cálcio mais baixo durante períodos mais prolongados do que o requerido.
Recomenda-se precaução quando o Ácido Zoledrônico (substância ativa) é usado com outros fármacos potencialmente nefrotóxicos.
Outras interações a serem consideradas
Recomenda-se precaução quando o Ácido Zoledrônico (substância ativa) é administrado com medicamentos antiangiogênicos uma vez que um aumento na incidência de osteonecrose da mandíbula foi observado em pacientes tratados concomitantemente com esses medicamentos.
Ausência de interações
Nos estudos clínicos, o Ácido Zoledrônico (substância ativa) foi administrado concomitantemente com agentes anticancerígenos, diuréticos (exceto para diuréticos de alça, ver seção anterior), antibióticos e analgésicos, sem ocorrência de interações clinicamente aparentes.
Nenhum ajuste da dose de Ácido Zoledrônico (substância ativa) foi necessário quando coadministrado com a talidomida, exceto em pacientes com insuficiência renal leve a moderada no início do estudo.
A coadministração de talidomida (100 ou 200mg uma vez ao dia) com o Ácido Zoledrônico (substância ativa) (4mg administrado como uma infusão de 15 minutos) não alterou significativamente a farmacocinética do Ácido Zoledrônico (substância ativa) e o clearance (depuração) de creatinina de pacientes com mieloma múltiplo.
Ação da Substância
Resultados de eficácia
Resultados dos estudos clínicos na prevenção de eventos relacionados ao esqueleto em pacientes com câncer metastático no osso:
O Ácido Zoledrônico (substância ativa) foi comparado ao placebo na prevenção de eventos relacionados ao esqueleto (ERE) em pacientes adultos com câncer de próstata, 214 homens recebendo Ácido Zoledrônico (substância ativa) 4mg versus 208 homens recebendo placebo. Após o tratamento inicial de 15 meses, 186 pacientes continuaram por até 9 meses adicionais, totalizando 24 meses de terapia duplo-cega. O Ácido Zoledrônico (substância ativa) 4mg demonstrou vantagem significativa sobre o placebo na proporção de pacientes apresentando no mínimo um evento relacionado ao esqueleto (ERE) (38% para Ácido Zoledrônico (substância ativa) 4mg versus 49% para placebo, p = 0,028), prolongando a mediana do tempo até o primeiro ERE (488 dias para Ácido Zoledrônico (substância ativa) 4mg versus 321 dias para placebo, p = 0,009), e reduzindo a incidência anual de eventos por paciente – taxa de morbidade esquelética (0,77 para Ácido Zoledrônico (substância ativa) 4mg versus 1,47 para placebo, p = 0,005).
A análise de múltiplos eventos mostrou uma redução de 36% no risco de desenvolvimento de eventos relacionados ao esqueleto no grupo recebendo Ácido Zoledrônico (substância ativa) comparado ao grupo recebendo placebo (p = 0,002). A dor foi medida no início e periodicamente durante o estudo. Os pacientes recebendo Ácido Zoledrônico (substância ativa) relataram menor aumento da dor do que aqueles recebendo placebo, e as diferenças atingiram significância nos meses 3, 9, 21 e 24. Pacientes que receberam Ácido Zoledrônico (substância ativa) apresentaram menos fraturas patológicas. Os resultados do tratamento foram menos acentuados em pacientes com lesões blásticas. Os resultados de eficácia são fornecidos na Tabela 1.
Tabela 1. Resultados de eficácia (pacientes com câncer da próstata tratados com terapêutica hormonal)
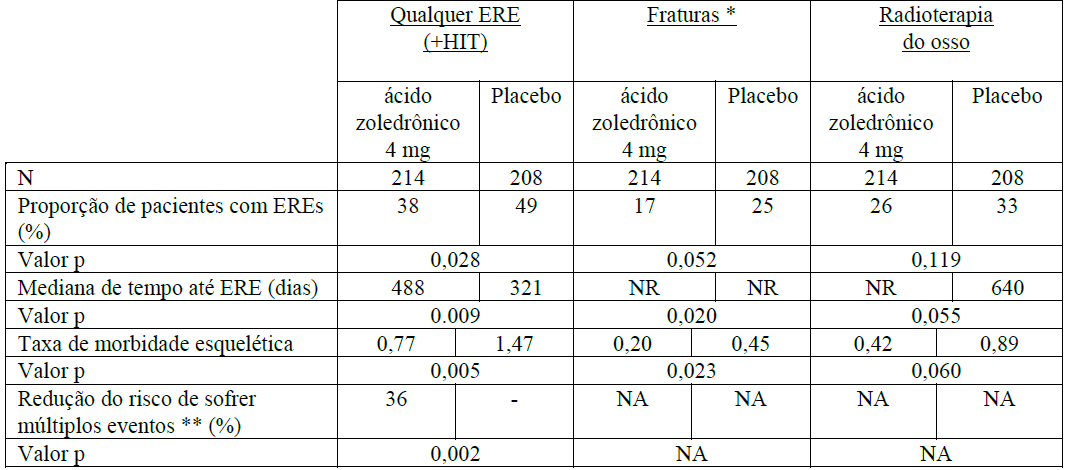 * Inclui fraturas vertebrais e não vertebrais.
* Inclui fraturas vertebrais e não vertebrais.
** Representa todos os eventos relacionados ao esqueleto, o número total bem como o tempo até cada evento durante o estudo clínico.
NR = Não Alcançado.
NA = Não Aplicável.
Num segundo estudo, o Ácido Zoledrônico (substância ativa) reduziu o número de EREs e prolongou em mais de dois meses a mediana de tempo até um ERE na população de pacientes adultos com outros tumores sólidos envolvendo os ossos, cuja mediana de sobrevida era de apenas seis meses [134 pacientes com câncer de pulmão de células não pequenas (CPNPC), 123 com outros tumores sólidos tratados com o Ácido Zoledrônico (substância ativa) versus 130 pacientes com CPNPC, 120 com outros tumores sólidos tratados com placebo]. Após um tratamento inicial de 9 meses, 101 pacientes foram admitidos na extensão de 12 meses do estudo, e 26 completaram o total de 21 meses. O Ácido Zoledrônico (substância ativa) 4mg reduziu a proporção de pacientes com EREs (39% para o Ácido Zoledrônico (substância ativa) 4mg versus 48% para placebo, p = 0,039), prolongou a mediana de tempo até o primeiro ERE (236 dias para o Ácido Zoledrônico (substância ativa) 4mg versus 155 dias para placebo, p = 0,009), e reduziu a incidência anual de eventos por paciente – taxa de morbidade esquelética (1,74 para o Ácido Zoledrônico (substância ativa) 4mg versus 2,71 para placebo, p = 0,012). A análise de múltiplos eventos mostrou uma redução de 30,7% no risco de desenvolvimento de eventos relacionados ao esqueleto no grupo recebendo Ácido Zoledrônico (substância ativa) comparado ao grupo recebendo placebo (p= 0,003). O efeito do tratamento em pacientes com câncer de pulmão de células não pequenas pareceu ser menor do que nos pacientes com outros tumores sólidos. Os resultados de eficácia são fornecidos na Tabela 2.
Tabela 2. Resultados de eficácia (pacientes com CPNPC e outros tumores sólidos, exceto câncer de mama e de próstata)

 * Inclui fraturas vertebrais e não vertebrais.
* Inclui fraturas vertebrais e não vertebrais.
** Representa todos os eventos relacionados ao esqueleto, o número total bem como o tempo até cada evento durante o estudo clínico.
NR = Não Alcançado.
NA = Não Aplicável.
Em um terceiro estudo de fase III, randomizado, duplo-cego, comparando o Ácido Zoledrônico (substância ativa) 4mg a pamidronato 90mg, 1122 pacientes adultos (564 recebendo o Ácido Zoledrônico (substância ativa) 4mg e 558 recebendo pamidronato 90mg) com mieloma múltiplo ou câncer de mama, e com pelo menos uma lesão óssea, foram tratados com Ácido Zoledrônico (substância ativa) 4mg ou pamidronato 90mg a cada 3 a 4 semanas. Oito pacientes foram excluídos da análise de eficácia devido a não adesão às boas práticas clínicas. Seiscentos e seis pacientes foram admitidos na fase de extensão duplo-cega de 12 meses. A terapia total teve duração de 24 meses.
Os resultados demonstraram que o Ácido Zoledrônico (substância ativa) 4mg mostrou eficácia comparável ao pamidronato 90mg na prevenção de eventos relacionados ao esqueleto. As análises de múltiplos eventos revelaram uma redução de risco significativa de 16% (p = 0,030) em pacientes tratados com o Ácido Zoledrônico (substância ativa) 4mg. Os resultados de eficácia são fornecidos na Tabela 3.
Tabela 3. Resultados de eficácia (pacientes com câncer da mama e mieloma múltiplo)
 * Inclui fraturas vertebrais e não vertebrais.
* Inclui fraturas vertebrais e não vertebrais.
** Representa todos os eventos relacionados ao esqueleto, o número total bem como o tempo até cada evento durante o estudo clínico.
NR = Não Alcançado.
NA = Não Aplicável.
Nos estudos clínicos realizados em pacientes adultos com metástases ósseas ou lesões osteolíticas, o perfil de segurança global entre todos os grupos tratados (Ácido Zoledrônico (substância ativa) 4mg, e pamidronato 90mg e placebo) foi semelhante no tipo e gravidade.
O Ácido Zoledrônico (substância ativa) também foi estudado em um ensaio clínico placebo-controlado, randomizado, duplo-cego, em 228 pacientes adultos com metástases ósseas decorrentes de câncer de mama visando avaliar o efeito de o Ácido Zoledrônico (substância ativa) na razão da taxa de eventos relacionados ao esqueleto (ERE), calculado através do número total de eventos relacionados ao esqueleto (excluindo hipercalcemia e ajustado para fratura pré-existente), dividido pelo período total de risco. Os pacientes receberam tanto o Ácido Zoledrônico (substância ativa) 4mg ou placebo a cada 4 semanas por um ano e foram distribuídos entre grupo tratado com o Ácido Zoledrônico (substância ativa) e grupo placebo.
A razão da taxa de eventos relacionados ao esqueleto em um ano foi de 0,61, indicando que o tratamento com o Ácido Zoledrônico (substância ativa) reduziu a taxa de ocorrência de eventos relacionados ao esqueleto em 39% comparado com o grupo placebo (p = 0,027).
A proporção de pacientes com pelo menos um evento relacionado ao esqueleto (excluindo hipercalcemia) foi de 29,8% no grupo tratado com o Ácido Zoledrônico (substância ativa) versus 49,6% no grupo placebo (p = 0,003). O tempo mediano para detecção do primeiro evento relacionado ao esqueleto no braço em uso de o Ácido Zoledrônico (substância ativa) ao final do estudo não foi alcançado e foi significativamente prolongado quando comparado ao grupo placebo (p = 0,007). O Ácido Zoledrônico (substância ativa) reduziu o risco de eventos relacionados ao esqueleto em 41% em análises de evento múltiplo (razão de risco = 0,59, p = 0,019) quando comparado ao grupo placebo.
No grupo tratado com o Ácido Zoledrônico (substância ativa), ocorreu redução dos escores de dor comparado ao nível basal (usando o BPI “Brief Pain Inventory”) a partir da quarta semana de tratamento e a cada subsequente avaliação durante o estudo, enquanto que o escore de dor no grupo placebo não alterou ou aumentou a partir do nível basal (Figura 1). O Ácido Zoledrônico (substância ativa) inibiu a piora do escore analgésico mais que o grupo placebo. Adicionalmente, 71,8% dos pacientes tratados com o Ácido Zoledrônico (substância ativa) versus 63,1% dos pacientes do grupo placebo demonstraram melhora ou nenhuma alteração no índice de desempenho segundo ECOG (“Easter Cooperative Oncology Group”) na observação final.
Figura 1: Alteração média nos escores de dor a partir dos níveis basais segundo BPI (“Brief Pain Inventory”) do grupo tratado em função do tempo de estudo

Resultados de estudo clínico no tratamento da HIT (hipercalcemia induzida por tumor)
Estudos clínicos na hipercalcemia induzida por tumor demonstraram que o efeito do Ácido Zoledrônico (substância ativa) se caracteriza pela diminuição do cálcio sérico e da excreção urinária de cálcio.
Para avaliar os efeitos do Ácido Zoledrônico (substância ativa) versus pamidronato 90mg, combinaram-se os resultados de dois estudos pivotais multicêntricos em pacientes adultos com hipercalcemia induzida por tumor (HIT) numa análise pré-planejada. Os resultados mostraram que o Ácido Zoledrônico (substância ativa) 4mg e 8mg foram estatisticamente superiores ao pamidronato 90mg para a proporção de pacientes que respondem completamente, no 7º dia e 10° dia. Verificou-se uma normalização mais rápida do cálcio sérico corrigido no 4° dia para 8mg de Ácido Zoledrônico (substância ativa) e no 7° dia para 4mg e 8mg de Ácido Zoledrônico (substância ativa). Foram observadas as seguintes taxas de resposta: vide Tabela 4.
Tabela 4. Proporção de respostas completas por dia nos estudos HIT combinados


O tempo médio para atingir a normocalcemia foi de 4 dias. No 10° dia, a taxa de resposta foi de 87 a 88% para os grupos em tratamento com o Ácido Zoledrônico (substância ativa) versus 70% para pamidronato 90mg. O tempo médio para recidivas (retorno dos níveis do cálcio sérico corrigido pela albumina ? 2,9mmol/L) foi de 30 a 40 dias para pacientes tratados com o Ácido Zoledrônico (substância ativa) versus 17 dias para aqueles tratados com pamidronato 90mg.
Os resultados mostraram que o tempo para recaída em ambas as doses de Ácido Zoledrônico (substância ativa) foi estatisticamente superior ao do pamidronato 90mg. Não houve diferenças estatisticamente significativas entre as duas doses de Ácido Zoledrônico (substância ativa).
Nos estudos clínicos realizados em pacientes com hipercalcemia induzida por tumor, o perfil de segurança global entre todos os grupos tratados (Ácido Zoledrônico (substância ativa) 4 e 8mg e pamidronato 90mg) foi semelhante no tipo e gravidade.
Características farmacológicas
Grupo farmacoterapêutico: bisfosfonato.
Código ATC: M05 BA08.
Farmacodinâmica
O Ácido Zoledrônico (substância ativa) é um fármaco altamente potente pertencente a classe de medicamentos bisfosfonatos que atuam especificamente no osso. É um dos mais potentes inibidores da reabsorção óssea osteoclástica conhecida até o momento.
A ação seletiva dos bisfosfonatos no osso é baseada na sua elevada afinidade por osso mineralizado, mas o mecanismo molecular preciso que conduz à inibição da atividade osteoclástica é ainda desconhecido. Nos estudos de longo prazo em animais, o Ácido Zoledrônico (substância ativa) inibe a reabsorção óssea sem afetar adversamente a formação, mineralização ou propriedades mecânicas do osso.
Além de ser um inibidor muito potente da reabsorção óssea, o Ácido Zoledrônico (substância ativa) também tem várias propriedades antitumorais que poderiam contribuir para a sua eficácia global no tratamento da doença óssea metastática. As seguintes propriedades foram demonstradas nos estudos pré-clínicos:
- - In vivo: inibição da reabsorção óssea osteoclástica, alterando o microambiente da medula óssea, tornando-a menos propícia ao crescimento das células tumorais, atividade antiangiogênica e atividade antinociceptiva.
- - In vitro: inibição da proliferação dos osteoblastos, atividade citostática e pró-apoptótica direta sobre as células tumorais, efeito citostático sinérgico com outros fármacos antineoplásicos e atividade antiadesão/invasão.
Farmacocinética
Infusões únicas e múltiplas de 2, 4, 8 e 16mg de Ácido Zoledrônico (substância ativa), com a duração de 5 e 15 minutos, em 64 pacientes com metástases ósseas, originaram os seguintes dados farmacocinéticos.
Não há dados disponíveis de farmacocinética para o Ácido Zoledrônico (substância ativa) em pacientes com hipercalcemia.
Após início da infusão de Ácido Zoledrônico (substância ativa), as concentrações plasmáticas de fármaco aumentaram rapidamente, atingindo o máximo no final do período de infusão, seguidas por uma rápida diminuição para < 10% do valor máximo após 4 horas e < 1% do valor máximo após 24 horas, com um período subsequente prolongado de concentrações muito baixas, não excedendo 0,1% do valor máximo previamente à segunda infusão do fármaco no 28° dia.
Distribuição:
O Ácido Zoledrônico (substância ativa) demonstra baixa afinidade para os componentes celulares do sangue humano, com concentração média plasmática de 0,59 numa faixa de concentração de 30 ng/mL a 5000 ng/mL. A ligação às proteínas plasmáticas é baixa, com a fração não ligada que varia de 60% em 2 ng/mL até 77% em 2000 ng/mL de Ácido Zoledrônico (substância ativa).
Biotransformação / metabolismo:
O Ácido Zoledrônico (substância ativa) não é metabolizado e é excretado inalterado por via renal. O Ácido Zoledrônico (substância ativa) não inibe as enzimas do P450 humano in vitro.
Eliminação:
O Ácido Zoledrônico (substância ativa) administrado intravenosamente é eliminado em três fases: desaparecimento bifásico rápido da circulação sistêmica, com meia-vida t1/2 alfa de 0,24 horas e t1/2 beta de 1,87 horas, seguido de uma longa fase de eliminação, com meia-vida de eliminação terminal t1/2 gama de 146 horas. Não ocorreu acúmulo de fármaco no plasma após administração de doses múltiplas do fármaco a cada 28 dias. Durante as primeiras 24 horas, 39 ± 16% da dose administrada é recuperada na urina, enquanto a restante se encontra ligada principalmente ao tecido ósseo. Do tecido ósseo é liberado novamente para a circulação sistêmica, muito lentamente, e eliminado por via renal. O clearance (depuração) corpóreo total é de 5,04 ± 2,5 L/h, independentemente da dose.
Linearidade / não-linearidade:
A farmacocinética do Ácido Zoledrônico (substância ativa) é independente da dose. O aumento do tempo de infusão de 5 para 15 minutos provocou uma diminuição de 30% na concentração de Ácido Zoledrônico (substância ativa) no final da infusão, no entanto não demonstrou alteração na área sob a curva, da concentração plasmática versus tempo.
Populações Especiais
Insuficiência hepática:
Não estão disponíveis dados de farmacocinética para o Ácido Zoledrônico (substância ativa) em pacientes com insuficiência hepática. O Ácido Zoledrônico (substância ativa) não inibe as enzimas do P450 humano in vitro, não demonstrou biotransformação, e em estudos em animais, menos de 3% da dose administrada foi recuperada nas fezes, sugerindo a não existência de um papel relevante da função hepática na farmacocinética do Ácido Zoledrônico (substância ativa).
Insuficiência renal:
O clearance (depuração) renal do Ácido Zoledrônico (substância ativa) foi correlacionado com o clearance (depuração) da creatinina, em que o clearance (depuração) renal representa 75 ± 33% do clearance (depuração) da creatinina, a qual mostrou valores médios de 84 ± 29mL/min (média de 22 a 143mL/min) nos64 pacientes com câncer estudados. A análise populacional mostrou que para um paciente com clearance (depuração) da creatinina de 50mL/min (insuficiência moderada), estima-se um clearance (depuração) correspondente para o Ácido Zoledrônico (substância ativa) de 72%, daquele de um paciente com clearance (depuração) da creatinina de 84mL/min. Os dados farmacocinéticos disponíveis em pacientes com insuficiência renal grave são limitados [clearance (depuração) da creatinina < 30mL/min]. O uso de Ácido Zoledrônico (substância ativa) não é recomendado em pacientes com insuficiência renal grave.
Efeito por sexo, idade e raça:
Os três estudos de farmacocinética realizados em pacientes com câncer com metástase óssea não revelaram qualquer efeito, por sexo, raça, idade (faixa de 38-84 anos), e peso corporal no clearance (depuração) do Ácido Zoledrônico (substância ativa) total.
Dados de Segurança pré-clínicos
Estudos de toxicidade:
Em estudos parenterais em bolus, o Ácido Zoledrônico (substância ativa) foi bem tolerado quando administrado por via subcutânea em ratos e por via intravenosa em cães em doses diárias de até 0,02mg/kg, durante 4 semanas. A administração por até 52 semanas, de 0,001mg/kg/dia por via subcutânea em ratos e 0,005mg/kg/ por via intravenosa uma vez a cada 2 a 3 dias em cães foi igualmente bem tolerada.
Em estudos de infusão intravenosa, tolerabilidade renal foi observada em ratos em doses de até 0,6mg/kg e em cães de até 0,5mg/kg, mas com intervalos de dosagem diferentes.
O achado mais frequente nos estudos de repetição de doses consistiu no aumento primário na metáfise esponjosa dos ossos longos em animais em crescimento em quase todas as doses, uma descoberta que reflete a atividade anti-reabsorção farmacológica do composto.
O rim foi identificado como um principal órgão-alvo de toxicidade, em estudos parenterais com Ácido Zoledrônico (substância ativa). Nos estudos de infusão venosa, a tolerabilidade renal foi observada em ratos que receberam infusões com doses de até seis infusões de 0,6mg/kg em intervalos de 3 dias, enquanto que cinco infusões de 0,25mg/kg administradas em intervalos de 2 a 3 semanas foram bem toleradas em cães.
Toxicidade na reprodução:
Estudos de teratogenicidade foram realizados em duas espécies, ambas com administração subcutânea de Ácido Zoledrônico (substância ativa). A teratogenicidade foi observada em ratos em doses ? 0,2mg/kg/dia e manifestada por malformações externas, viscerais e esqueléticas. No teste em ratos, foi observada distócia com menor dose (0,01mg/kg/dia).
Não foram observados efeitos teratogênicos ou embrio/fetal em coelhos, apesar da toxicidade materna marcada em 0,1mg/kg/dia. Efeitos adversos maternos foram associados com, e podem ter sido causados por, hipocalcemia induzida por medicação.
Mutagenicidade:
O Ácido Zoledrônico (substância ativa) não foi mutagênico nos testes in vitro e in vivo de mutagenicidade realizados.
Carcinogenicidade:
Em estudo oral de carcinogenicidade em roedores, o Ácido Zoledrônico (substância ativa) revelou não ter potencial carcinogênico.
Cuidados de Armazenamento
Blaztere deve ser mantido a temperatura ambiente (entre 15°C a 30°C).
Após o preparo, manter sob refrigeração entre 2°C e 8°C, durante no máximo 24 horas.
A solução refrigerada deve alcançar a temperatura ambiente antes da administração (entre 15°C a 30°C).
Número de lote e datas de fabricação e validade: vide a embalagem.
Não use medicamento com prazo de validade vencido. Guarde-o em sua embalagem original.
Dizeres Legais
Reg. MS 1.5143.0016.001-9.
Farm. Resp.:
Bruno Ditura
CRF-SP nº 46.455.
Fabricado e Embalado por:
Dr. Reddy's Laboratories Ltd.
Plot No. 137,138, 145 e146 S.V.C.I.E.,
Bollaram , Jinnaram Mandal,
Medack District, Telangana – Índia.
Registrado e Importado por:
Dr. Reddy's Farmacêutica do Brasil Ltda.
Av. Guido Caloi, 1985 - Galpão 11
Jd. São Luiz - São Paulo - SP
CEP 05802-140
CNPJ 03.978.166/0001-75.
Uso restrito a hospitais.
Uso sob prescrição médica.
Venda proibida ao comércio.