Bula
Myograf 300Mcg Solução Injeta Myograf 300Mcg Solução Injetável 5 Frasco 1MlATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Bula - Myograf 300Mcg Solução Injeta Myograf 300Mcg Solução Injetável 5 Frasco 1Ml
Para que serve
PARA QUE ESTE MEDICAMENTO É INDICADO Este medicamento é destinado ao tratamento e prevenção da neutropenia, que é uma diminuição de neutrófilos (células brancas) no sangue Myograf® (filgrastim) é indicado para os seguintes casos: 1 Neutropenia resultante de quimioterapia citotóxica (medicamentos utilizados para morte das células do câncer) Em pacientes com câncer recebendo quimioterapia mielossupressora (que causa supressão da produção de células sanguíneas da medula óssea), especialmente após mielossupressão severa pelo tratamento com antineoplásicos, o filgrastim auxilia na profilaxia da neutropenia, diminuindo a queda dos níveis de neutrófilos, encurtando a duração da neutropenia e acelera a recuperação dos níveis de neutrófilos, desse modo, reduz os riscos de complicações infecciosas 2 Neutropenia após transplante de medula óssea 3 Neutropenia causada pela síndrome mielodisplásica (proliferação clonal das células da medula óssea caracterizada por pancitopenia devido a defeitos de maturação), neutropenia causada pela anemia aplásica (neutropenia causada por falha na medula óssea em produzir número adequado de elementos sanguíneos periféricos); neutropenia congênita (neutropenia presente desde o nascimento), neutropenia idiopática (neutropenia de causa desconhecida), síndrome mielodisplásica com neutropenia e neutropenia periódica Myograf_bula_paciente 20/05/2013 2 2
Contraindicação
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO Myograf® (filgrastim) é contra-indicado a pacientes com história de hipersensibilidade conhecida ao filgrastim, a outros componentes da fórmula e a proteínas derivadas de Escherichia coli Também é contra-indicado a pacientes com grave distúrbio funcional renal, hepático, pulmonar ou cardiovascular, a pacientes com leucemia mielóide com decréscimo não aparente de granulócitos (grupo de células brancas, dividido em neutrófilos, eosinófilos e basófilos) imaturos na medula óssea e a pacientes com leucemia mielóide com granulócitos imaturos encontrados no sangue periférico 4
Como usar
COMO DEVO USAR ESTE MEDICAMENTO Modo de usar Myograf® (filgrastim) deve ser administrado por via subcutânea ou infusão intravenosa durante 30 minutos Myograf® (filgrastim) não pode ser diluído em soluções de cloreto de sódio, pois pode ocorrer precipitação Se necessário, pode ser diluído em solução de glicose 5% O filgrastim pode ser adsorvido em vidro ou materiais plásticos e, portanto, não deve ser diluído abaixo da concentração mínima recomendada de 2 mcg/mL Quando o produto for diluído a uma concentração inferior a 15 mcg/mL de filgrastim, deve-se adicionar albumina sérica humana a uma concentração final de 2 mg/mL, para proteger da adsorção Usar somente uma dose por frasco; não reutilizar o frasco Descartar porções não usadas do produto Os medicamentos de uso parenteral devem ser inspecionados visualmente quanto à presença de partículas, antes da administração Posologia O esquema de dose de Myograf® (filgrastim) depende da queda do nível de neutrófilos e da intensidade de quimioterapia Myograf® (filgrastim) não deve ser administrado antes de 24 a 48 horas após a quimioterapia citotóxica Para pacientes com neutropenia grave e em esquemas de quimioterapia intensiva, é adequado administrar 2,5 mcg/kg/dia de Myograf® (filgrastim) continuamente por pelo menos 7 dias até que os neutrófilos voltem aos níveis normais de 5,0 x 109/L Para pacientes com esquemas de quimioterapia leve e supressão da medula óssea não severa, é recomendado administrar uma dose baixa de Myograf® (filgrastim) de 1,25 mcg/kg/dia, para profilaxia da neutropenia, até que a contagem dos neutrófilos retorne aos níveis seguros e permaneçam estáveis Para pacientes com queda aparente na contagem de neutrófilos após a quimioterapia (< 1,0 x 109/L), é recomendado administrar 5 mcg/kg/dia de Myograf® (filgrastim) até que os neutrófilos voltem aos níveis normais de 5,0 x 109/L O uso de Myograf® (filgrastim) pode ser descontinuado quando a contagem de neutrófilos estiver estável - Tumor: Myograf® (filgrastim) é indicado para neutropenia induzida por quimioterapia A dose inicial recomendada para pacientes adultos com queda na contagem de neutrófilos para 1,0 x 109/L (leucócitos 2,0 x 109/L) é 2 a 5 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia após o início da quimioterapia A dose inicial recomendada para pacientes pediátricos com queda na contagem de neutrófilos para 0,5 x 109/L (leucócitos 1,0 x 109/L) é 2 a 5 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia após o início da quimioterapia O uso de Myograf® (filgrastim) deve ser descontinuado quando a contagem de neutrófilos retornar a 5,0 x 109/L e leucócitos a 10,0 x 109/L Myograf_bula_paciente 20/05/2013 5 - Neutropenia causada por quimioterapia em leucemia aguda: para pacientes com leucemia aguda após quimioterapia, cujos níveis de leucócitos são menores que 1,0 x 109/L, mieloblasto (célula precursora de granulócito, que dá origem a neutrófilos, eosinófilos e basófilos maduros) da medula óssea é aparentemente decrescente, ou mieloblasto não é encontrado no sangue periférico, a dose recomendada de Myograf® (filgrastim) para pacientes adultos é de 2 a 5 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia; para pacientes pediátricos é de 2 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia O uso de Myograf® (filgrastim) deve ser descontinuado quando a contagem de neutrófilos retornar a 5,0 x 109/L e leucócitos a 10,0 x 109/L - Síndrome mielodisplásica com neutropenia: a dose recomendada de Myograf® (filgrastim) para pacientes adultos com contagem de neutrófilos inferior a 1,0 x 109/L é de 2 a 5 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia O uso de Myograf® (filgrastim) deve ser descontinuado quando a contagem de neutrófilos retornar a 5,0 x 109/L - Neutropenia causada por anemia aplásica: a dose recomendada de Myograf® (filgrastim) para pacientes adultos com contagem de neutrófilos inferior a 1,0 x 109/L é de 2 a 5 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia Descontinuar ou diminuir a dose conforme a contagem de neutrófilos retornar a 5,0 x 109/L - Neutropenia periódica, neutropenia associada com doença autoimune e neutropenia crônica: a dose recomendada de Myograf® (filgrastim) para pacientes adultos e pediátricos com contagem de neutrófilos inferior a 1,0 x 109/L é de 1 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia Descontinuar ou diminuir a dose conforme a contagem de neutrófilos retornar a 5,0 x 109/L - Aumento de neutrófilos em pacientes recebendo transplante de medula óssea: A dose recomendada de Myograf® (filgrastim) para pacientes adultos é de 2 a 5 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia, do 2º ao 5º dia do transplante de medula óssea; e para pacientes pediátricos é 2 mcg/kg/dia, por administração intravenosa ou subcutânea, uma vez ao dia, do 2º ao 5º dia do transplante de medula óssea O uso de Myograf® (filgrastim) deve ser descontinuado quando a contagem de neutrófilos retornar a 5,0 x 109/L e leucócitos a 10,0 x 109/L Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento Não interrompa o tratamento sem o conhecimento do seu médico 7 O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO Myograf® (filgrastim) deve ser administrado no mesmo horário todos os dias Se a dose for esquecida, entre em contato com o médico ou enfermeiro O esquecimento de doses pode comprometer a eficácia do tratamento Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista 8
Precauções
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO Myograf® (filgrastim) deve ser usado sob a supervisão de um médico Myograf® (filgrastim) deve ser administrado após 24 a 48 horas após o término da quimioterapia Não deve ser administrado antes ou concomitantemente com a quimioterapia O hemograma completo deve ser realizado duas vezes por semana durante a terapia com filgrastim, para o monitoramento da contagem de neutrófilos A segurança e eficácia da administração crônica de filgrastim não foram estabelecidas Em estudos clínicos de administração crônica, não foram observadas reações alérgicas, exceto aumento no tamanho do baço relatado em literatura estrangeira Na literatura também foram relatadas algumas reações alérgicas, tais como exantema (erupção cutânea), urticária (reação vascular da pele, caracterizada por vermelhidão e formação de feridas), edema (inchaço) da face, dispnéia (falta de ar), taquicardia (aumento da frequência dos batimentos cardíacos) e hipotensão (pressão arterial anormalmente baixa), ocorrendo em 30 minutos após o uso da medicação (a taxa de ocorrência < 1/4000) Se essas reações ocorrerem, o uso de filgrastim deve ser descontinuado imediatamente e terapia apropriada iniciada A maioria desses sintomas desaparecerá logo após o início do uso de anti-histamínicos, corticosteróides, agente broncoespasmolítico e/ou adrenalina Uso em pacientes idosos: a função fisiológica de pacientes idosos é comparativamente baixa Cuidados devem ser tomados na administração, especialmente na escolha e intervalo das doses Myograf_bula_paciente 20/05/2013 3 Uso pediátrico: cuidados devem ser tomados para o uso pediátrico de filgrastim Não é recomendado o uso em recém-nascidos e lactentes, visto que a segurança não foi estabelecida O filgrastim tem sido utilizado no tratamento de pacientes pediátricos de 4 meses a 17 anos, uma vez ao dia Não foram observados efeitos de toxicidade a longo prazo nessas crianças e seu crescimento, desenvolvimento, características sexuais e endócrinas não foram alteradas Gravidez: a segurança do uso de filgrastim em mulheres grávidas não foi estabelecida Na ausência de dados clínicos na gravidez, o benefício terapêutico deve ser avaliado em relação aos riscos potenciais para o curso da gravidez Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista Lactação: não é conhecido se filgrastim é excretado no leite humano Devido aos riscos potenciais aos lactentes, a amamentação não é recomendada em mulheres que recebem Myograf® (filgrastim) Interações medicamentosas: considerando a sensibilidade das células mielóides de rápida divisão, o uso de filgrastim não é recomendado no período de 24 horas antes e até 24 a 48 horas após à quimioterapia citotóxica Interações medicamentosas entre filgrastim e outros fármacos não foram completamente avaliadas Fármacos que podem potencializar a liberação de neutrófilos, como lítio, devem ser utilizados com cautela Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento Não use medicamento sem o conhecimento do seu médico Pode ser perigoso para a sua saúde 5 ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO Conservar o produto sob refrigeração (2 a 8 °C) Não congelar Proteger da luz Evitar agitação Prazo de validade: 24 meses a partir da data de fabricação Número de lote e datas de fabricação e validade: vide embalagem Não use medicamento com o prazo de validade vencido Guarde-o em sua embalagem original Myograf® (filgrastim) apresenta-se na forma de solução incolor a levemente amarelada, límpida e livre de material particulado visível Antes de usar, observe o aspecto do medicamento Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo Todo medicamento deve ser mantido fora do alcance das crianças Myograf_bula_paciente 20/05/2013 4 6
Reações Adversas
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR Myograf_bula_paciente 20/05/2013 6 De acordo com o estudo pós-comercialização realizado para o produto Myograf®
(filgrastim) foram observadas as seguintes reações adversas: Reações comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento): dor óssea, febre, fadiga e astenia (fraqueza) Reações incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento): anorexia, rash cutâneo (vermelhidão na pele), náusea, vômito, febre neutrofílica, dor de cabeça, dor no peito, dores, diarréia e dor de garganta Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): inflamação da membrana mucosa, dispnéia, constipação e elevação das enzimas aspartato e alanina aminotransferase Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento Informe também à empresa através do seu serviço de atendimento 9 O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO A administração de filgrastim acima da dose segura pode causar hematúria, presença de proteína na urina e aumento significativo da atividade de fosfatase alcalina no soro sangüíneo Porém, após 5 semanas de recuperação, todos os índices voltam ao normal Quando administrado muito acima da dose segura, pode causar diminuição do apetite, redução do peso corpóreo, fraqueza, como também hematúria, presença de proteína na urina e lesão aparente no fígado; esses sintomas são eliminados ou aliviados rapidamente com a suspensão do medicamento Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível Ligue para 0800 722 6001, se você precisar de mais orientações
Composição
COMPOSIÇÃO Cada frasco-ampola de Myograf® contém: filgrastim (rHuG-CSF) 300 mcg veículo: ácido acético, acetato de sódio, manitol, polissorbato 80 e água para injeção q s p 1 mL INFORMAÇÕES AO PACIENTE 1
Interação Medicamentosa
Não foram ainda estabelecidas a segurança e a eficácia de Filgrastim (substância ativa) quando administrado no mesmo dia que a quimioterapia citotóxica mielossupressora. Tendo em vista a sensibilidade da rapidez da divisão das células mieloides à quimioterapia citotóxica mielossupressora, a utilização de Filgrastim (substância ativa) não é recomendada no período que decorre entre as 24 horas anteriores e às 24 horas posteriores à quimioterapia. Evidências preliminares obtidas a partir de um grupo pequeno de pacientes tratados concomitantemente com Filgrastim (substância ativa) e 5-fluoruracila indicam que a gravidade da neutropenia pode ser exacerbada.
Nos estudos clínicos conduzidos não foram investigadas as possíveis interações do Filgrastim (substância ativa) com outros fatores de crescimento hematopoiéticos e com citocinas.
Considerando que o lítio promove a liberação de neutrófilos, é provável que possa potencializar o efeito de Filgrastim (substância ativa). No entanto, esta interação não foi formalmente investigada e não existe qualquer evidência de que tal interação possa ser prejudicial.
Ação da Substância
Resultados de eficácia
A eficácia e segurança clínica do Filgrastim (substância ativa) foram avaliadas em três estudos clínicos fase III.
Câncer de mama
Estudo clínico fase III, multinacional, multicêntrico, randomizado e controlado de comparação entre Filgrastim (substância ativa) vs. comparador vs. placebo, conduzido em 348 pacientes com câncer de mama tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 4 ciclos de docetaxel 75mg/m2 IV e doxorrubicina 60mg/m2 IV no 1° dia.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN): a duração de neutropenia severa no ciclo 1 foi de 1,1 dias (faixa de 0 a 5) para pacientes tratados com o Filgrastim (substância ativa) e o medicamento comparador e 3,8 dias (faixa de 0 a 9) em pacientes que utilizaram o placebo.
Os resultados foram similares no total de pacientes tratados, confirmando a comparabilidade de Filgrastim (substância ativa) e o medicamento comparador.
Incidência de neutropenia febril (FN): no ciclo 1, a incidência de neutropenia febril observada ou definida em protocolo foi consideravelmente menor nos grupos tratados com Filgrastim (substância ativa) e com o medicamento comparador, comparado aos grupos que receberam o placebo (12,1% vs. 12,5% vs. 36,1%). Não houve diferenças significativas entre o Filgrastim (substância ativa) e o medicamento comparador na incidência de neutropenia febril no ciclo 1 ou nos demais ciclos.
Contagem absoluta de neutrófilos (ANC): no ciclo 1, grupos que receberam Filgrastim (substância ativa) e o medicamento comparador apresentaram um aumento significativo de ANC após o 2° dia de tratamento, atingindo contagem máxima no 3° dia de tratamento.
Em seguida, os grupos demonstraram diminuição de ANC a 0,7 x 109/L no 7° dia e alcançaram novamente uma contagem máxima no 11° dia. No grupo que recebeu placebo, não houve aumento inicial de ANC, sendo observada diminuição constante a partir do 2° dia, atingindo um nível consideravelmente baixo (0,2 x 109/L) no 11° dia.
No ciclo 1, o tempo médio de recuperação na contagem absoluta de neutrófilos foi similar nos grupos de que receberam o Filgrastim (substância ativa) e o medicamento comparador (8 dias) e consideravelmente maior no grupo que recebeu placebo (15 dias).
Nos ciclos 2 a 4, o ANC foi similar para todos os grupos (~1,0 x 109/L) e o tempo médio de recuperação na contagem absoluta de neutrófilos foi de 8 dias para todos os grupos.
Neste estudo clínico fase III, conduzido com pacientes de alto-risco ou com câncer de mama avançado, Filgrastim (substância ativa) demonstrou ser superior ao placebo, e com eficácia comparável à do medicamento comparador na redução da duração de neutropenia severa induzida pela quimioterapia, no aumento da contagem absoluta de neutrófilos e na redução do tempo de recuperação da contagem absoluta de neutrófilos. O Filgrastim (substância ativa) e o medicamento comparador também demonstraram eficácia equivalente na redução da incidência de neutropenia febril quando comparados ao placebo.
Os resultados de eficácia deste estudo são sumarizados na tabela a seguir: *Pacientes deste grupo receberam placebo no ciclo 1 e Filgrastim (substância ativa) nos ciclos de 2 a 4;
*Pacientes deste grupo receberam placebo no ciclo 1 e Filgrastim (substância ativa) nos ciclos de 2 a 4;
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
**Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
trec: Tempo para recuperação da contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril.
Câncer de pulmão
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em 240 pacientes com câncer de pulmão tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 6 ciclos com derivados de platina. O regime de terapia mais comum utilizado foi cisplatina + etoposídeo ou gencitabina em 49% e 15% dos pacientes, respectivamente. Outros regimes incluíram cisplatina + vinorelbina e combinações de carboplatina + vinorelbina, etoposídeo, gencitabina ou paclitaxel.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN): a duração de neutropenia severa no ciclo 1 foi de 0,5 dias para pacientes tratados com o Filgrastim (substância ativa) e 0,3 dias para os pacientes tratados com o medicamento comparador. A estimativa de análise de covariância (ANCOVA) entre o Filgrastim (substância ativa) e o medicamento comparador foi de 0,157 dias. O intervalo de confiança de 95% (-0,114 a 0,428 dias) foi incluído na faixa pré-definida de equivalência (-1 a 1 dia), indicando que a duração de neutropenia severa (DSN) não foi diferente para o Filgrastim (substância ativa) e o medicamento comparador.
Contagem absoluta de neutrófilos (ANC): o perfil de contagem absoluta de neutrófilos foi similar em todos os ciclos para o medicamento comparador e o Filgrastim (substância ativa). Houve um aumento inicial de ANC significativo atingindo contagem máxima no 5° dia e subsequente diminuição nos 11° e 12° dias. ANC atingiu uma segunda contagem máxima no 14° dia e retornou próxima a contagem basal, gradualmente, até o 21° dia. A contagem absoluta de neutrófilos foi comparável entre os grupos que receberam o medicamento comparador e Filgrastim (substância ativa) no ciclo 1 (2,1 vs. 2,9 x 109/L) e após migrarem do medicamento comparador para Filgrastim (substância ativa) no ciclo 4 (2,3 vs. 3,2 x 109/L). No tempo médio de recuperação na contagem absoluta de neutrófilos houve diferenças mínimas entre os grupos no ciclo 1 (6,3 vs. 4,5 dias) que persistiu até o ciclo 4 quando Filgrastim (substância ativa) foi administrado em ambos os grupos (6,4 vs. 4,5 dias).
Incidência de neutropenia febril (FN):
No ciclo 1, a incidência observada ou definida em protocolo foi de 15,0% no grupo que recebeu o Filgrastim (substância ativa) e 8,8% no grupo que recebeu o medicamento comparador. Estatisticamente, esta diferença não é significativa (p=0,23). No ciclo 4, após os pacientes migrarem do medicamento comparador para Filgrastim (substância ativa), a incidência de neutropenia febril foi de 4,3% e 3,3%, respectivamente (p=0.90). Nos outros ciclos, a incidência de neutropenia febril foi de 33,1% e 23,8% nos pacientes sob tratamento com o Filgrastim (substância ativa) e o medicamento comparador, respectivamente.
Neste estudo clínico fase III, conduzido com pacientes com câncer de pulmão sob tratamento quimioterápico citotóxico, a profilaxia primária com Filgrastim (substância ativa) e o medicamento comparador demonstraram eficácia e segurança equivalentes. O perfil de contagem absoluta de neutrófilos, incluindo a duração de neutropenia severa foi similar entre ambos os medicamentos. Diferenças estatisticamente não significativas entre o Filgrastim (substância ativa) e o medicamento comparador na incidência de neutropenia febril podem ser atribuídas às diferentes características dos pacientes.
Os resultados de eficácia deste estudo são sumarizados na tabela a seguir:
| Filgrastim (substância ativa) (n=160) | Comparador * (n=80) | |
| DSN (dias) | ||
| Ciclo 1 | 0,5 | 0,3 |
| ? DSN, dias (95% CI)* | 0,157 (-0,114, 0,428) | |
| Ciclo 4 | 0,4 | 0,3** |
| ANC nadir, 109/L | ||
| Ciclo 1 | 2,1 | 2,9 |
| Ciclo 4 | 2,3 | 3,2** |
| Tempo de recuperação ANC (dias) | ||
| Ciclo 1 | 6,3 | 4,5 |
| Ciclo 4 | 6,4 | 4,5** |
| Incidência de neutropenia febril‡ (%) | ||
| Ciclo 1 | 15,0 | 8,8 |
| Ciclo 4 | 4,3 | 3,3** |
| Todos os ciclos | 33,1 | 23,8 |
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
*Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
**Após migrar do medicamento comparador para o Filgrastim (substância ativa);
‡ Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril.
Linfomas Não-Hodgkin
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em pacientes com linfoma não-Hodgkin. Durante o estudo, os pacientes estavam sob tratamento quimioterápico, de no máximo 6 ciclos, com ciclofosfamida, doxorrubicina, vincristina e prednisona (CHOP). Tratamento adicional com rituximabe (anticorpo monoclonal anti-CD20) foi utilizado a critério de médico.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN):
A duração de neutropenia severa no ciclo 1 foi de 0,5 dias para pacientes tratados com o Filgrastim (substância ativa) e 0,9 dias para os pacientes tratados com o medicamento comparador. A estimativa de análise de covariância (ANCOVA) entre o Filgrastim (substância ativa) e o medicamento comparador foi de -0,378 dias. O intervalo de confiança de 95% (-0,837 a 0,081 dias) foi incluído na faixa pré-definida de equivalência (-1 a 1 dia), indicando que a duração de neutropenia severa (DSN) foi similar para o Filgrastim (substância ativa) e o medicamento comparador (p=0.11). A duração de neutropenia severa (DSN) no ciclo 4, após os pacientes migrarem do Filgrastim (substância ativa) para o medicamento comparador foi de, respectivamente, 0,2 e 0,7 dias para o grupo que recebeu Filgrastim (substância ativa) e o grupo que recebeu o medicamento comparador.
Contagem absoluta de neutrófilos (ANC):
O perfil de contagem absoluta de neutrófilos foi similar em todos os ciclos para o medicamento comparador e o Filgrastim (substância ativa). No ciclo 1, houve um aumento inicial de ANC significativo atingindo contagem máxima no 4° dia e subsequente diminuição no 9° dia. O ANC atingiu uma segunda contagem máxima no 11° dia e retornou próxima a contagem basal, gradualmente, até o 21° dia. A contagem absoluta de neutrófilos foi comparável entre os grupos que receberam o medicamento comparador e o Filgrastim (substância ativa) no ciclo 1 (1,7 vs. 1,1 x 109/L) e após migrarem do Filgrastim (substância ativa) para o medicamento comparador no ciclo 4 (2,1 vs. 1,8 x 109/L). O tempo médio de recuperação na contagem absoluta de neutrófilos nos pacientes que receberam o Filgrastim (substância ativa) e o medicamento comparador foi respectivamente de 6,0 e 6,7 dias no ciclo 1, e 4,9 e 6,1 dias no ciclo 4.
Incidência de neutropenia febril (FN):
No ciclo 1, a incidência observada ou definida em protocolo foi de 11,1% no grupo que recebeu o Filgrastim (substância ativa) e 20,7% no grupo que recebeu o medicamento comparador (p=0.12). As taxas de incidência no ciclo 4 foram respectivamente 31,7% e 41,4% (p=0.21).
Este estudo clínico fase III foi conduzido em pacientes com linfoma não-Hodgkin tratados com o regime quimioterápico CHOP, com ou sem rituximabe. Os resultados do estudo confirmaram que a profilaxia primária com o Filgrastim (substância ativa) é tão eficaz quanto com o medicamento comparador na redução da duração de neutropenia severa e na incidência de neutropenia febril. O perfil de contagem absoluta de neutrófilos foi similar entre ambos os medicamentos no ciclo 1.
Os resultados de eficácia resumidos estão demonstrados a seguir:? *Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
*Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
**Após migrar do medicamento comparador para o Filgrastim (substância ativa);
‡ Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril;
n.a.: Não avaliado
Característias Farmacológicas
Grupo Farmacoterapêutico:
Imunoestimuladores, Fatores Estimuladores de Colônias.
Código ATC: L03AA02.
Propriedades farmacodinâmicas
Filgrastim (substância ativa), é uma glicoproteína que regula a produção e a liberação de neutrófilos funcionais da medula óssea. O Filgrastim (substância ativa) provoca, em um período de 24 horas, um aumento significativo da contagem de neutrófilos no sangue periférico, com pequenos aumentos de monócitos. Em alguns pacientes com neutropenia crônica grave, o Filgrastim (substância ativa) pode também induzir um pequeno aumento do número de eosinófilos e basófilos circulantes em relação aos valores basais; alguns destes pacientes podem apresentar eosinofilia ou basofilia antes do tratamento. Elevações nas contagens de neutrófilos são dosedependentes nas doses recomendadas. Os neutrófilos produzidos em resposta ao Filgrastim (substância ativa) apresentam função normal ou aumentada, conforme demonstrado em testes de funções fagocítica e quimiostática. Após o término do tratamento com Filgrastim (substância ativa), a contagem de neutrófilos circulantes diminui em 50% dentro de 1 a 2 dias, e para níveis normais dentro de 1 a 7 dias.
O uso de Filgrastim (substância ativa) em pacientes submetidos à quimioterapia citotóxica leva a reduções significativas na incidência, gravidade e duração da neutropenia e da neutropenia febril. O tratamento com Filgrastim (substância ativa) reduz significativamente a duração da neutropenia febril, a utilização de antibióticos e o tempo de hospitalização após quimioterapia de indução para leucemia mieloide aguda ou terapia mieloablativa seguida de transplante de medula óssea. A incidência de relatos de febre e infecções não foi reduzida em nenhum destes quadros clínicos. A duração da febre não diminuiu nos pacientes que receberam terapia mieloablativa seguida de transplante de medula óssea.
A utilização de Filgrastim (substância ativa), isoladamente ou após quimioterapia, mobiliza as células progenitoras hematopoiéticas para o sangue periférico. Estas células progenitoras do sangue periférico (CPSP) autólogas podem ser coletadas e infundidas após terapia citotóxica de dose elevada, em substituição ou em adição ao transplante de medula óssea. A infusão de CPSP acelera a recuperação hematopoiética, reduzindo a duração do risco de complicações hemorrágicas e a necessidade de transfusões de plaquetas.
Os receptores de CPSP alogênicas mobilizadas com Filgrastim (substância ativa) tiveram uma recuperação hematológica significativamente mais rápida, levando a uma diminuição significativa do tempo de recuperação de plaquetas quando comparado com o transplante alogênico de medula óssea.
Um estudo Europeu retrospectivo que avaliou o uso de fator estimulador de colônias de granulócitos (G-CSF) após transplante alogênico de medula óssea em pacientes com leucemia aguda sugeriu risco aumentado de doença do enxerto contra hospedeiro (graft-versus-host disease - GVHD), mortalidade relacionada ao tratamento (TRM) e mortalidade quando o G-CSF foi administrado. Outro estudo retrospectivo internacional, conduzido em pacientes com leucemias mieloides aguda e crônica, não foi observado risco de GVHD, TRM e mortalidade. Uma metanálise de estudos de transplantes alogênicos, incluindo resultados de nove estudos randomizados prospectivos, 8 estudos retrospectivos e 1 estudo de caso-controle, não detectou efeito sobre o risco de GVHD aguda, GVHD crônica ou mortalidade relacionada ao tratamento.
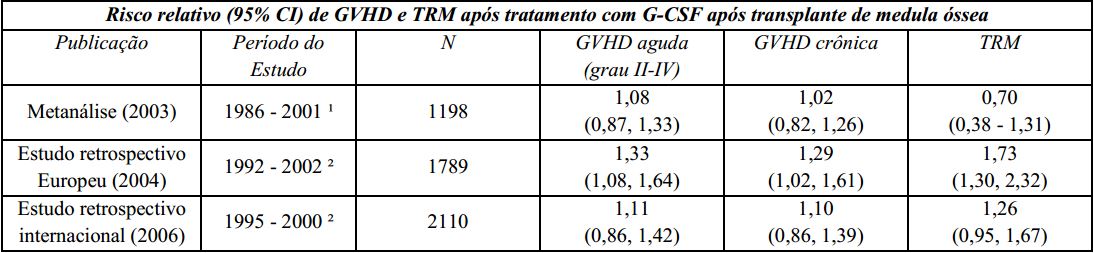 GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
TRM: mortalidade relacionada ao tratamento;
G-CSF: fator estimulador de colônias de granulócitos;
¹ A análise incluiu estudos envolvendo transplante de medula óssea durante este período; alguns estudos utilizaram GM-CSF (fator estimulador de colônias de macrófagos e granulócitos);
² A análise incluiu pacientes recebendo transplante de medula óssea durante este período.
Previamente ao transplante de CPSP alogênicas, a utilização de Filgrastim (substância ativa) para a mobilização de CPSP em doadores saudáveis permite um cultivo de 4 x 106 células CD34+ /kg de peso corporal do receptor na maioria dos doadores, após duas leucaféreses. Para estes doadores saudáveis é dada uma dose de 10 mcg/kg/dia, administrada por via subcutânea durante 4 a 5 dias consecutivos.
O uso de Filgrastim (substância ativa) em pacientes com neutropenia crônica grave (neutropenia congênita grave, neutropenia cíclica e neutropenia idiopática), induz um aumento sustentado das contagens absolutas de neutrófilos no sangue periférico e uma redução das infecções e eventos relacionados.
O Filgrastim (substância ativa), assim como com outros fatores de crescimento hematopoiéticos, demonstrou in vitro propriedades estimuladoras sobre as células endoteliais humanas.
Propriedades Farmacocinéticas
A depuração de Filgrastim (substância ativa), tanto após administração subcutânea como intravenosa, demonstrou seguir uma farmacocinética de primeira ordem. A meia-vida de eliminação sérica do Filgrastim (substância ativa) é de aproximadamente 3,5 horas, com uma taxa de depuração de aproximadamente 0,6mL/min/kg. A infusão contínua com Filgrastim (substância ativa) durante um período de até 28 dias, em pacientes em recuperação de transplante autólogo de medula óssea, não apresentou evidência de acumulação do fármaco e de meias-vidas comparáveis. Há uma correlação linear positiva entre a dose e a concentração sérica de Filgrastim (substância ativa), se administrado por via intravenosa ou por via subcutânea. Após administração subcutânea das doses recomendadas, as concentrações séricas mantiveramse acima dos 10 ng/mL, durante 8 a 16 horas. O volume de distribuição no sangue é aproximadamente de 150mL/kg.
Em pacientes com câncer, o perfil farmacocinético do Filgrastim (substância ativa) e do medicamento comparador foi comparável após administração única e após administrações múltiplas por via subcutânea.
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram risco especial para humanos com base em estudos convencionais de segurança farmacológica, genotoxicidade e tolerância local.
Os dados pré-clínicos de estudos convencionais de toxicidade de doses múltiplas demonstraram os efeitos farmacológicos esperados, incluindo aumento da contagem leucocitária, hiperplasia mieloide da medula óssea, hematopoiese extramedular e dilatação esplênica.
Não foram observados efeitos sobre a fertilidade de ratos do sexo masculino e feminino, assim como sobre a gestação em ratos. Não existe evidência a partir dos estudos conduzidos em ratos e coelhos de que o Filgrastim (substância ativa) seja teratogênico. Foi observada incidência aumentada de perda embrionária em coelhos, porém não foi observada má formação.
Dizeres Legais
DIZERES LEGAIS VENDA SOB PRESCRIÇÃO MÉDICA USO RESTRITO A HOSPITAIS MS 1 0646 0170 Farm Resp : Francisco Antonio Pinheiro Vilar - CRF-SP Nº 8 299 Fabricado por: Xiamen Amoytop Biotech Co , Ltd Wengjiao Road, 330 Haicang, Xinyang Industrial Zone Xiamen, Fujian, China Myograf_bula_paciente 20/05/2013 7 Importado e Embalado por: Laboratório Químico Farmacêutico Bergamo Ltda Rua Rafael de Marco, 43 – Pq Industrial – Jd das Oliveiras Taboão da Serra – SP CNPJ: 61 282 661/0001-41 Indústria Brasileira Esta bula foi aprovada pela Anvisa em 26/06/2013 SAC Bergamo 0800-113653 www laboratoriobergamo com br