Hoje o Cliquefarma traz aqui no blog um assunto bastante comentado, os remédios de marca. Você sabe o que são? Confira agora mesmo um artigo completo sobre isso e depois nos conte o que achou!
Medicamentos de Marca ou de Referência
Também chamados de medicamentos de referência, os medicamentos de marca podem ser classificados como as fórmulas pioneiras desenvolvidas para variados fins. Ou seja, um medicamento de marca é o primeiro, o inovador que por meio de investimento, pesquisas e fases laboratoriais desenvolveu certa fórmula química para determinada causa.
Podemos citar como exemplos de medicamentos de marca: Aspirina da Bayer, Dorflex da Sanofi, Benegrip da Hypera Pharma, Neosaldina da Takeda, Cataflam da Novartis, entre tantos outros. Por serem os primeiros a apresentar tais princípios ativos, suas marcas ficam conhecidas no mercado e assim são denominados medicamentos de marca ou medicamentos de referência.
Após o surgimento de algum medicamento de marca, posteriormente, aparecem os medicamentos similares (com o mesmo princípio ativo mas sem a marca e sem bioequivalência*) ou genéricos (com bioequivalência e substâncias idênticas). Obviamente, os medicamentos de marca advêm dos feitos da indústria farmacêutica. Cada laboratório de desenvolvimento de medicamentos é licenciado para pesquisar, desenvolver, comercializar e distribuir os produtos.
Quando começou?
Este é um setor que começou a ganhar atenção e recursos financeiros entre as décadas de 1920 e 1930, época em que a sociedade em geral sofria com pestes e muitas doenças se espalhavam das mais variadas maneiras.
Em resumo, pode-se dizer que, atualmente, para que os medicamentos de marca sejam feitos e devidamente testados (por vezes, durante anos) são necessários altos investimentos. Assim, quando uma nova fórmula é descoberta, a empresa farmacêutica pode requerer a patente do remédio inédito. Portanto, se outra empresa interessar-se em fabricar o medicamento, é preciso pagar royalties, e assim se dá o início do lucro no segmento.
Vale ressaltar a importância dos medicamentos de marca, que induzem diagnósticos, alavancam pesquisas e contribuem com a evolução da ciência.
O que é a Lei de intercambialidade?
Para entendermos isso, primeiro é preciso explicarmos a diferença entre Medicamentos Referência, Genéricos e Similares. Confira:
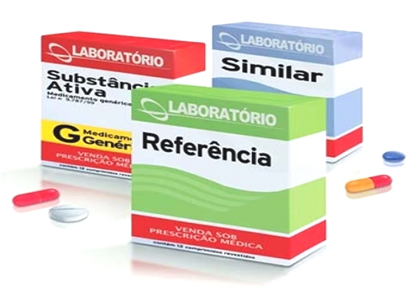
REFERÊNCIA
Como vimos até agora – afinal, este é o maior objetivo do artigo – é todo medicamento “originador”, cuja eficácia, segurança e qualidade foram comprovadas cientificamente. Todo medicamento referência possui o nome comercial (marca) em suas embalagens.
GENÉRICO
É igual ao medicamento referência, onde exclusivamente se apresenta com o nome da substância ativa. Não sendo permitida, desta forma, a utilização de nome comercial (marca). Desde 1999, todos os medicamentos genéricos precisavam comprovar a sua eficácia, segurança e qualidade através de estudos de bioequivalência¹ com o seu originador (referência).
SIMILAR
É todo medicamento, que contém o mesmo ou os mesmos princípios ativos, apresenta mesma concentração, forma farmacêutica, via de administração, posologia e indicação terapêutica, e que é equivalente ao medicamento referência registrado na ANVISA, podendo diferir somente em características relativas ao tamanho e forma do produto, prazo de validade, embalagem, rotulagem, excipientes e veículo, devendo sempre ser identificado por nome comercial (marca).
Como funciona a lei?
Até dezembro de 2014, todos os medicamentos similares precisaram comprovar, junto a ANVISA, a sua eficácia e segurança através de estudos de bioequivalência* com o seu originador (referência). Os medicamentos ainda estavam sob análise e à medida que foram sendo aprovados, foram disponibilizados na listagem oficial da ANVISA de medicamentos similares intercambiáveis.
A Anvisa publicou a Resolução da Diretoria Colegiada (RDC) Nº 58/2014, que estabelece os procedimentos para a intercambialidade de medicamentos similares com o medicamento de referência. Ou seja, os requisitos necessários para que o similar possa substituir o medicamento de referência. Pela nova regra, os similares que já tenham comprovado equivalência farmacêutica com o medicamento de referência da categoria poderiam declarar na bula que são substitutos ao de marca.
A medida poderia ser adotada pelos fabricantes a partir de 1º de janeiro de 2015 e teria 12 meses para fazer a alteração nas bulas. A Anvisa também mantém uma lista atualizada dos similares intercambiáveis para orientar médicos, farmacêuticos e pacientes sobre quais produtos possuem equivalência comprovada na Agência.
*Bioquivalência: Segundo o Ministério da Saúde, é a condição que se dá entre dois produtos farmacêuticos que são equivalentes entre si, e que mostram uma mesma ou similar biodisponibilidade segundo uma série de critérios.
RDC ANVISA N. 58, DE 10 DE OUTUBRO DE 2014
Dispõe sobre as medidas a serem adotadas junto à Anvisa pelos titulares de registro de medicamentos para a intercambialidade de medicamentos similares com o medicamento de referência.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere os incisos III e IV, do art. 15 da Lei n.º 9.782, de 26 de janeiro de 1999, o inciso V, e §§ 1º e 3º do art. 5 do Regimento Interno aprovado nos termos do Anexo I da Portaria nº 650 da ANVISA, de 29 de maio de 2014, tendo em vista os incisos III, do art. 2º, III e IV, do art. 7º da Lei nº 9.782, de 1999, o Programa de Melhoria do Processo de Regulamentação da Agência, instituído por meio da Portaria nº 422, de 16 de abril de 2008, em reunião realizada em 09 de outubro de 2014, adota a seguinte Resolução da Diretoria Colegiada e eu, Diretor-Presidente, determino a sua publicação:
Art. 1º Esta Resolução determina as medidas a serem adotadas junto à Anvisa pelos titulares de registro de medicamentos para a intercambialidade de medicamentos similares com os respectivos medicamentos de referência.
- 1º A adoção das medidas previstas nesta Resolução é obrigatória para todos os titulares de registro de medicamentos cujos estudos mencionados no art. 2º tenham sido aprovados pela Anvisa.
- 2º Os medicamentos isentos de prescrição não são objeto desta Resolução.
Art. 2º Será considerado intercambiável o medicamento similar cujos estudos de equivalência farmacêutica, biodisponibilidade relativa/bioequivalência ou bioisenção tenham sido apresentados, analisados e aprovados pela ANVISA.
Parágrafo único. A ANVISA publicará em seu sítio eletrônico a relação dos medicamentos similares, indicando os medicamentos de referência com os quais são intercambiáveis.
Art. 3º A informação a respeito da intercambialidade a que se refere o art. 2º constará na bula do medicamento similar.
Art. 4º O peticionamento da notificação de alteração de texto de bula deverá ser eletrônico, conforme código de assunto específico e seguir o guia de submissão eletrônica de texto de bula.
- 1º As empresas detentoras de registros de medicamentos similares intercambiáveis, terão o prazo de 1 (um) ano a contar de sua inclusão na relação a que se refere o art. 2º para notificar à ANVISA a adaptação da bula, nos termos do caput deste artigo.
- 2º A adaptação prevista no parágrafo anterior é de implementação imediata e não depende de manifestação da ANVISA.
- 3º Os medicamentos similares intercambiáveis que não tiverem suas bulas alteradas no prazo definido no § 1º deste artigo não poderão ser comercializados no país.
- 4º Os medicamentos produzidos até a notificação da alteração de bula poderão ser comercializados até o término de sua validade.
Art. 5º Para efeito de avaliação das petições de renovação de registro de medicamentos similares cujos estudos de equivalência farmacêutica, biodisponibilidade relativa/bioequivalência ou bioisenção ainda não tenham sido analisados, a ANVISA publicará Instrução Normativa definindo os critérios e ordem de sua avaliação.
Art. 6º O Anexo I da RDC nº 47/2009 fica acrescido da seguinte redação:
I – IDENTIFICAÇÃO DO MEDICAMENTO:
…
“Para medicamentos constantes da relação a que se refere o art. 2º da RDC nº 58, de 10 de outubro de 2014, incluir a frase:
MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA”
Art. 7º Esta Resolução entra em vigor em 1º de janeiro de 2015.
DIRCEU BRÁS APARECIDO BARBANO
Diretor-Presidente
O que é intercambialidade?
Intercambialidade indica a possibilidade de substituição de um medicamento prescrito pelo profissional da saúde por um medicamento genérico ou similar, desde que este conste na lista de medicamentos similares intercambiáveis disponibilizada pela ANVISA.
A intercambialidade somente acontecerá se houver estudo de bioequivalência, bioisenção* e/ou equivalência farmacêutica** entre as partes. Portanto, nenhum similar poderá ser intercambiável com outro similar.
Como a empresa comprova que um medicamento é intercambiável?
Medicamentos considerados intercambiáveis são aqueles que apresentam junto a ANVISA (Agência Nacional de Vigilância Sanitária) a sua eficácia e segurança através de estudos de bioequivalência (BQV)/biodisponibilidade***, bioisenção* ou equivalência farmacêutica** com o seu originador.
O estudo de BQV é realizado sempre entre o medicamento referência e medicamento de estudo (genérico ou similar).
Todos os medicamentos são intercambiáveis?
Não. Para algumas categorias, como: Medicamentos Isentos de Prescrição (MIP), Fitoterápicos, Biológicos e Medicamentos Específicos (Exemplos: vitaminas, ácido fólico, minerais, diosmina, hesperidina, quercetina, timomodulina, aminoácidos, entre outros) a intercambialidade não pode acontecer. Ou seja, o paciente deve seguir a terapia com o medicamento indicado pelo prescritor. Medicamentos similares não podem ser intercambiáveis por outros similares e tampouco por genéricos.
Por que nem todos os medicamentos similares entraram na lista de produtos intercambiáveis aprovados pela ANVISA?
Todos os produtos similares tiveram que apresentar seus testes para ANVISA até dezembro de 2014, porém nem todos os dossiês foram avaliados e aprovados até a presente data. Os medicamentos serão incluídos na lista oficial da ANVISA à medida que seus estudos forem analisados e aprovados.
*Bioisenção: a bioisenção pode ser definida como a não exigência de um estudo de biodisponibilidade relativa ou de bioequivalência “in vivo” para o registro de um medicamento pela autoridade sanitária, quando um ensaio in vitro adequado pode substituir o estudo in vivo.
**Equivalência farmacêutica: Dois medicamentos são considerados farmaceuticamente equivalentes se apresentarem: quantidades idênticas (doses) do mesmo fármaco, mesma natureza química (isto é; mesma base, sal, éster etc.) e mesma forma farmacêutica.
***Biodisponibilidade: Indica a velocidade e a extensão de absorção de um princípio ativo em uma forma de dosagem, a partir de sua curva concentração/tempo na circulação sistêmica ou sua excreção na urina.
Classificação dos medicamentos: de referência, similar e genérico
Classificação dos medicamentos: comprar um medicamento pode ser uma tarefa complexa. A legislação para a fabricação de remédios sofreu alterações nas últimas décadas e ainda causa confusão.
Como conseguimos entender até o momento, a classificação dos medicamentos é dividida em três categorias diferentes, sendo elas: referência, similares e genéricos. No entanto, você sabe quais são as diferenças e semelhanças entre esses medicamentos e de que maneira eles são regulamentados? Para entender melhor a classificação dos medicamentos, vamos explicar para você o que é cada categoria e suas implicações. Então, continue a leitura!
Medicamentos de referência
Os medicamentos de referência são conhecidos como medicamentos de marca. Em geral, eles são os primeiros de determinado tipo no mercado. Isso quer dizer que, quando eles foram desenvolvidos pelas indústrias farmacêuticas, não existiam outros produtos específicos para um determinado tratamento ou que tivessem determinada combinação de princípios ativos.
Para ser aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) como medicamento de referência, a medicação precisa comprovar cientificamente suas principais características, subdivididas em:
- eficácia
- segurança;
- qualidade.
As listas dos medicamentos de referência possuem centenas de produtos listados, citamos mais acima alguns e agora veja outros, por exemplo:
- Buscopan;
- Rivotril;
- Tylenol;
- Viagra.
Medicamentos similares
Já os medicamentos similares foram regulamentados pela Anvisa no ano de 2003. Eles também possuem nome comercial. Entretanto, para que sejam considerados similares, os laboratórios que os fabricam precisam apresentar estudos comparando o medicamento similar ao de referência. É necessário que seja comprovada:
- equivalência farmacêutica;
- perfil de dissolução;
- bioequivalência / biodisponibilidade relativa (BD/BE).
Como também já explicado, em 2014, a ANVISA passou a relacionar em seu site todos os medicamentos similares, indicando os medicamentos de referência com os quais eles são intercambiáveis. O objetivo foi tornar essas informações mais acessíveis para a população e para os profissionais da saúde.
Todos os medicamentos similares também precisam trazer essa informação em suas bulas. Assim sendo, é preciso que conste que eles são medicamentos similares e qual o medicamento de referência aos quais são equivalentes. O medicamento similar, portanto, é uma “cópia” do medicamento de referência, mas pode ser diferente dele em aspectos como:
- embalagem;
- rótulo;
- posologia;
- tamanho, cor e forma do produto;
- prazo de validade.
Ou seja, um medicamento de referência líquido pode ter um similar em formato de comprimido, por exemplo. O nome do medicamento similar é sua marca.
Medicamentos genéricos
Os medicamentos genéricos foram criados em 1999. Eles não possuem nome comercial, trazem no rótulo apenas o princípio ativo do medicamento. As vantagens dos genéricos, segundo a ANVISA, são:
- menor preço — o genérico deve ser, no mínimo, 35% mais barato que o medicamento de referência;
- concorrência — o que estimula os medicamentos de referência a baixarem seus preços;
- maior acesso da população aos medicamentos — na medida em que os genéricos são mais baratos que os medicamentos de referência, grande parte da população pode adquiri-los com mais facilidade.
De acordo com a legislação, a embalagem dos genéricos deve ter uma tarja amarela com a frase “Medicamento Genérico”.
Para que um medicamento seja considerado genérico, ele deve ter o mesmo princípio ativo, na mesma dosagem e formato que um medicamento de referência. Até mesmo a forma de tomar o remédio genérico deve ser igual à do medicamento de referência. A ANVISA realiza testes para garantir que os genéricos tenham a mesma formulação e atuação do medicamento de marca.
Caso o médico prescreva um medicamento pelo nome da marca, o farmacêutico pode substituir o produto por um genérico, desde que a troca seja anotada na prescrição médica.
O genérico só pode ser desenvolvido depois que a patente do produto de marca expira. No Brasil, a patente é válida por 20 anos. É por isso que medicamentos novos não possuem genérico.
Em casos específicos, a patente pode ser quebrada antes. Foi o caso dos medicamentos para HIV, cuja patente foi quebrada, pois era uma questão de interesse nacional que houvesse medicamentos mais baratos para tratar a AIDS.
Intercambialidade
Quando o indivíduo chega na farmácia com a receita de um medicamento de referência, vai poder ser questionado pelo farmacêutico se deseja uma opção mais barata do produto, tal qual um genérico ou similar.
Ele pode também perguntar ao profissional se existe um remédio similar que seja equivalente ou mesmo um genérico, cujo preço seja mais em conta.
No caso do paciente escolher o medicamento similar, caberá ao farmacêutico usar a lista de intercambialidade que está disponível no site da ANVISA. No entanto, caso o estabelecimento tenha um produto similar equivalente, ele vai poder comprar do mesmo modo e pagando mais barato.
Genérico versus equivalentes
Os medicamentos genéricos podem ser intercambiáveis com os de referência, assim como os medicamentos equivalentes. Todavia, as versões genéricas não são intercambiáveis com os medicamentos similares e vice-versa.
Troca de medicamentos
No caso de precisar trocar a medicação, a Agência alerta que é necessário consultar a lista oficial de intercambialidade. Do mesmo modo que já acontece com os genéricos, os farmacêuticos de todo o Brasil podem realizar a intercambialidade dos medicamentos de referência pelos similares equivalentes.
Logo que a Lei foi introduzida, para que a troca fosse efetuada, era preciso que tanto os consumidores quanto os farmacêuticos exigissem uma consulta à listagem oficial de intercambialidade. É importante destacar que as trocas deviam seguir a tabela, uma vez que cada medicamento de referência ia ter um similar correspondente. Hoje em dia, os farmacêuticos e clientes provavelmente já estão mais acostumados com isso, mas em qualquer dúvida, a lista continua vigente no site.
Segundo a ANVISA, no caso da medicação similar não constar da lista, o farmacêutico não poderia fazer a intercambialidade, pois não teria autorização para isso. A situação se repetiria caso o médico tivesse optado por receitar um medicamento genérico.
A Agência Nacional de Vigilância Sanitária ainda afirma que a intercambialidade somente está autorizada para os medicamentos de referência e seus similares ou genéricos respectivos, não sendo possível de um genérico para um similar.
A restrição é feita para garantir a segurança terapêutica do paciente, uma vez que os testes de bioequivalência dos remédios genéricos ou similares são feitos utilizando somente o medicamento de referência como parâmetro para análise, o que assegura a eficiência e a resposta para qual o organismo necessita.
No caso do médico escrever nominalmente na receita que não aceita a intercambialidade, o farmacêutico vai ter que respeitar a posição do profissional e não efetuar a troca.
O que prevalece é a ética e o respeito de sempre!
Sempre lembrando, queridos leitores, que é possível completar que os pacientes apresentam total liberdade de solicitar ao médico que receite um similar no momento de prescrever a medicação, assim como já é comum no país fazer o pedido de um genérico para o profissional responsável.
Para que uma política tenha sucesso vai ter que depender das parcerias e da liberdade que farmacêuticos e médicos possam oferecer aos pacientes. Em vista disso, o paciente deve exigir sem receio que outras medicações sejam prescritas.
Do mesmo modo, o farmacêutico tem por obrigatoriedade apresentar todas as alternativas e deixar que o consumidor escolha o que lhe é mais conveniente comprar. A ética e o compromisso têm sido a bandeira da comunidade farmacêutica no país até os dias de hoje. Espera-se que a ação prevaleça também com a chegada dos similares equivalentes nas farmácias de todo o território nacional.
Ainda podemos dizer que os médicos são orientados a prescrever receitas, de preferência, com os medicamentos de referência ou genéricos. Pois, entende-se que enquanto não existir segurança específica sobre a intercambialidade entre os de referências e os similares, o profissional não pode receitar o similar. Entretanto, desde a Resolução nº 134/2003, os fabricantes necessitam apresentar às autoridades competentes estudos comparativos com as medicações de referência, de acordo com a ANVISA. Essas comprovações se referem à bioequivalência, ou seja, o similar pode ser uma opção ao medicamento de referência.
O órgão também explica que as indústrias farmacêuticas tiveram cerca de dez anos para apresentar pesquisas com o propósito de comprovar a função. Desde o ano de 2013, os medicamentos similares são equivalentes aos de referências, podendo ser diferentes apenas ao tamanho e ao formato dos produtos, assim como prazo de validade, embalagem, rotulagem, veículo e excipientes — substâncias que completam a massa e o volume na cápsula, de modo que seja identificado pela marca ou nome comercial.
Nos dias de hoje, todas as medicações similares que estão distribuídas sob o balcão de uma drogaria devem passar pelo teste. Em seu site a Agência disponibiliza uma lista constantemente atualizada da classificação dos medicamentos, sejam de referência, similar ou genérico, que costumam ser intercambiáveis entre si.
Atualmente, é possível ir a drogaria com uma receita do remédio de referência e solicitar ao farmacêutico que lhe mostre um medicamento genérico ou similar e vice-versa, sem que o tratamento seja prejudicado, sendo que os similares devem ser bioequivalentes aos seus respectivos medicamentos de referência.
Caso haja dúvidas, é importante que você procure na embalagem do produto a seguinte frase: “Medicamento similar equivalente ao medicamento de referência”. Se ela estiver especificada, pode-se fazer uso da medicação tranquilamente.
Agora, imagine que você passou em consulta no Sistema Único de Saúde (SUS) e o médico responsável prescreveu a receita de um remédio genérico. Ao ir na farmácia, você somente vai poder pedir a versão genérica ou o medicamento de referência e jamais o similar. Portanto, fica claro que a intercambialidade é apenas entre a medicação original e a testada, seja ela genérica ou similar.
Isso se deve ao fato das indústrias farmacêuticas responsáveis pelos medicamentos genéricos ou similares apresentarem ao órgão competente (ANVISA) os testes que asseguram a intercambialidade somente em relação aos de referência, e não ao genérico ou similar. Em vista disso, é necessário ficar bastante atento.
Agora que você já sabe sobre a classificação dos medicamentos e como é feita a intercambialidade entre eles, vai ficar mais fácil e seguro adquirir os remédios nas farmácias e drogarias de todo o país. Converse com o seu médico e esclareça quaisquer dúvidas que ainda possa ter em relação ao assunto, afinal a nossa saúde deve estar sempre em primeiro lugar! E se tiver qualquer dúvida a esse respeito, deixe seu comentário no box abaixo que teremos o maior prazer em ajudar você!