Comparamos o preço de Aprovel - 150Mg C 30 Comprimidos, veja o menor preço

R$ 180,17
RReferência
3
ofertasMelhores preços a partir de R$ 180,17 até R$ 240,99
Oferta patrocinada
vendido por Drogaria São Paulo
economize
25.24%
R$ 180,17
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por AAZ Farma
economize
3.40%
R$ 232,80
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria!
vendido por Drogaria Araújo
R$ 240,99
Para que serve
Aprovel é indicado para o tratamento da hipertensão (pressão alta). Pode ser usado isoladamente ou em associação com outros agentes anti-hipertensivos (ex.: diuréticos tiazídicos, agentes bloqueadores beta-adrenérgicos e agentes bloqueadores dos canais de cálcio de longa duração).
Aprovel é indicado para o tratamento da doença renal (dos rins) em pacientes com hipertensão e diabetes tipo 2.
Nessa população, Aprovel reduz a taxa de progressão da nefropatia (doença no rim) conforme medida pela ocorrência da duplicação do valor de creatinina sérica (parâmetro utilizado para avaliar a função dos rins) e doença renal em estágio final (necessidade de diálise ou transplante renal).
Como Aprovel funciona?
Aprovel é um medicamento que possui em sua fórmula uma substância chamada irbesartana. Esta substância age no organismo reduzindo a pressão arterial em pacientes com ou sem doença renal e diabetes tipo 2.
Tempo médio de início de ação
O efeito anti-hipertensivo da irbesartana é perceptível após a primeira dose, evidenciando-se substancialmente em 1-2 semanas, e o efeito máximo ocorre após 4-6 semanas.
Contraindicação
Aprovel é contraindicado caso você apresente alergia à irbesartana ou a qualquer outro componente da fórmula.
Aprovel não deve ser coadministrado com medicamentos que contenham alisquireno em pacientes com diabetes ou que apresentem insuficiência renal (redução da função dos rins) moderada a severa (taxa de filtração glomerular < 60 mL/min/1,73 m2).
Aprovel também não deve ser coadministrado com inibidores da enzima conversora de angiotensina (ECA) em pacientes com nefropatia diabética (doença no rim ocasionada pela diabetes).
Como usar
Este medicamento não deve ser partido ou mastigado.
Os comprimidos de Aprovel podem ser administrados com ou sem a presença de alimentos, com líquido, por via oral.
Posologia
A dose inicial habitual de Aprovel é de 150 mg uma vez ao dia. Se você necessitar de redução adicional da pressão arterial a dose pode ser aumentada, com orientação médica, para 300 mg, uma vez por dia. Caso a pressão arterial não seja adequadamente controlada com Aprovel isoladamente, seu médico poderá adicionar um diurético (ex.: hidroclorotiazida 12,5 mg por dia) ou outro fármaco anti-hipertensivo (ex.: agente bloqueador beta-adrenérgico ou agente bloqueador do canal de cálcio de longa duração).
Pacientes com hipertensão e doença renal diabética tipo 2:
300 mg de Aprovel, uma vez ao dia, é a dose de manutenção preferida.
Não há estudos dos efeitos de Aprovel administrado por vias não recomendadas. Portanto, por segurança e para garantir a eficácia deste medicamento, a administração deve ser somente por via oral.
Posologia para populações especiais
Pacientes Idosos:
Entre os pacientes que receberam irbesartana nos estudos clínicos não foram observadas diferenças globais em termos de eficácia ou segurança entre os pacientes idosos (acima de 65 anos) e os pacientes mais jovens. Desta forma, geralmente não é necessária redução da dose para os pacientes idosos.
Pacientes Pediátricos:
A segurança e a eficácia em pacientes pediátricos não foram estabelecidas.
Pacientes com Depleção (diminuição) de Volume Intravascular:
Caso você apresente hiponatremia (deficiência de sódio no sangue) e/ou hipovolemia (diminuição do volume sanguíneo) severas (por exemplo, pacientes tratados vigorosamente com diuréticos ou submetidos à hemodiálise), esta condição deve ser corrigida antes da administração de Aprovel, ou uma dose inicial mais baixa deve ser considerada. Se a pressão arterial não for adequadamente controlada, a dose poderá ser aumentada.
Pacientes com Insuficiência Renal (dos rins) ou Hepática (do fígado):
Geralmente não é necessária redução da dose em pacientes com insuficiência hepática leve a moderada ou com insuficiência renal (independentemente do grau de disfunção).
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Aprovel?
Caso esqueça de administrar uma dose, administre-a assim que possível. No entanto, se estiver próximo do horário da dose seguinte, espere por este horário, respeitando sempre o intervalo determinado pela posologia. Nunca devem ser administradas duas doses ao mesmo tempo.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico.
Precauções
Hipotensão - Pacientes com depleção de volume (volume de sangue circulante diminuído)
Aprovel foi raramente associado com hipotensão (pressão baixa) em pacientes hipertensos sem outras doenças associadas. Pode ocorrer hipotensão sintomática, assim como com os inibidores da ECA (classe de medicamentos utilizados para tratar a hipertensão), em pacientes com diminuição de volume/sódio, como, por exemplo, em pacientes tratados vigorosamente com diuréticos e/ou restrição de sal ou submetidos à hemodiálise (processo de filtragem e depuração de substâncias indesejáveis do sangue). A depleção de volume e/ou sódio deve ser corrigida antes de se iniciar a terapia com irbesartana, ou o uso de uma dose inicial inferior deve ser considerado.
Morbidade e Mortalidade Fetal/Neonatal (recém-nascido)
Embora não haja experiência com o uso de Aprovel por mulheres grávidas, foi reportado que a exposição “in utero” aos inibidores da ECA durante o segundo e o terceiro trimestres de gravidez causa danos e morte do feto, portanto, Aprovel não deve ser usado durante a gravidez.
Se for detectada gravidez durante a terapia, Aprovel deverá ser descontinuado assim que possível. Nos raros casos em que não há alternativa adequada para a terapia com medicamentos que atuam no sistema renina-angiontensina (sistema que regula o controle da pressão arterial) para uma paciente em particular, o médico deve informar a mãe sobre o potencial risco para o feto e realizar ultrassonografias periódicas para avaliar o ambiente intra-amniótico.
Gerais
Como consequência da inibição do sistema renina-angiotensina-aldosterona, podem ocorrer alterações da função renal em indivíduos predispostos. O uso de medicamentos que afetam esse sistema em pacientes cuja função renal depende da atividade do sistema renina-angiotensina-aldosterona [p. ex., pacientes com insuficiência cardíaca congestiva severa (incapacidade do coração efetuar as suas funções de forma adequada) ou em pacientes com hipertensão com estenose (estreitamento) unilateral ou bilateral da artéria renal], foi associado à oligúria (diminuição de produção de urina) e/ou azotemia progressiva (excesso de ureia e outros componentes nitrogenados no sangue) e (raramente) à insuficiência renal aguda (redução grave da função do rim) e/ou morte. A possibilidade da ocorrência de um efeito similar com o uso de um antagonista dos receptores da angiotensina II, incluindo a irbesartana, não pode ser excluída.
Em um estudo com irbesartana foi demonstrado que nenhum paciente hipertenso e diabético tipo 2 com proteinúria (perda excessiva de proteínas através da urina) (? 900 mg/dia), apresentou uma elevação aguda precoce da creatinina sérica atribuída à estenose da artéria renal.
Bloqueio duplo do sistema renina-angiotensina-aldosterona
O bloqueio duplo do sistema renina-angiotensina-aldosterona através da combinação de Aprovel com inibidores da ECA ou com alisquireno não é recomendado, uma vez que existe um aumento do risco de hipotensão, hipercalemia (nível alto de potássio no sangue) e alterações na função renal comparado com a monoterapia.
O uso de Aprovel em combinação com alisquireno é contraindicado em pacientes com diabetes mellitus ou com insuficiência renal.
O uso de Aprovel em combinação com inibidores da ECA é contraindicado em pacientes com nefropatia diabética.
Informe ao seu médico se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento);
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento);
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento);
- Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento);
- Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento);
- Reação desconhecida (não pode ser estimada a partir dos dados disponíveis).
As reações adversas que ocorreram em pacientes utilizando Aprovel foram, geralmente, leves e transitórias e sem relação com a dose. A incidência destas reações não foi relacionada à idade, sexo ou raça.
Outros eventos clínicos de relação provável, possível ou incerta com a terapia que ocorreram com frequência de pelo menos 1% dos pacientes tratados com a irbesartana ou placebo (fármaco ou procedimento inerte), incluem: fadiga (cansaço), edema (inchaço), náuseas (enjoo), vômitos, tontura e dor de cabeça.
Outros eventos clínicos de relação provável, possível ou incerta com a terapia que ocorreram com frequência de 0,5% a <1% e com incidência similar ou ligeiramente maior nos pacientes tratados com a irbesartana do que no tratamento com o placebo, incluem: dor no peito, tosse, diarreia, dispepsia (má digestão)/azia, tontura (ortostática – ao assumir a posição de pé), disfunção sexual e taquicardia. Nenhum dos eventos apresentou diferença estatisticamente significativa entre os pacientes tratados com a irbesartana e com o placebo.
Estudos Clínicos em Hipertensão (pressão alta) e Doença Renal Diabética Tipo 2
Em estudos clínicos com pacientes com hipertensão e doença renal diabética tipo 2, as experiências adversas com o fármaco foram similares àquelas em estudos clínicos com pacientes hipertensos, com exceção dos sintomas ortostáticos [tontura, tontura ortostática e hipotensão ortostática (queda significativa da pressão arterial após assumir a posição de pé)] observados no Estudo com irbesartana na Nefropatia (doença renal) Diabética (proteinúria > 900 mg/dia e creatinina sérica de 1,0 – 3,0 mg/dL).
Os sintomas ortostáticos que ocorreram mais frequentemente no grupo com Aprovel neste estudo foram: tontura 10,2%, tontura ortostática 5,4%, hipotensão ortostática 5,4%.
Experiência de Pós-comercialização na hipertensão
Assim como com outros antagonistas de receptores da angiotensina II, casos muito raros de reações de hipersensibilidade (angioedema - inchaço em região subcutânea ou em mucosas, geralmente de origem alérgica, urticária) foram relatados a partir do início da comercialização da monoterapia com a irbesartana.
Os seguintes eventos adversos foram relatados durante a farmacovigilância:
Tontura, astenia (fraqueza), hipercalemia (nível alto de potássio no sangue), mialgia (dor muscular), icterícia (cor amarelada da pele e olhos), elevação dos testes de função hepática, hepatite (inflamação do fígado), tinido (zumbido no ouvido) e diminuição da função renal, incluindo casos de insuficiência dos rins em pacientes de risco.
Alterações nos Testes Laboratoriais
Nos estudos clínicos controlados sobre hipertensão, não ocorreram alterações clinicamente significativas nos parâmetros laboratoriais. Não é necessária monitoração especial dos parâmetros laboratoriais para pacientes com hipertensão essencial recebendo terapia com Aprovel.
Em dois estudos clínicos com pacientes com hipertensão e doença renal diabética tipo 2, foi relatado o seguinte:
- - Hipercalemia (aumento dos níveis de potássio no sangue): No estudo com irbesartana na nefropatia diabética (INDT), o percentual de pacientes com hipercalemia (> 6 mEq/L) foi 18,6% no grupo tratado com Aprovel.
- Em outro estudo, o percentual de pacientes com hipercalemia (> 6 mEq/L) foi 1,0% no grupo tratado com Aprovel.
Informe ao seu médico ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também a empresa através do seu serviço de atendimento.
População Especial
Gravidez e amamentação
Quando for detectada gravidez, Aprovel deverá ser descontinuado tão logo quanto possível.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Informe imediatamente seu médico em caso de suspeita de gravidez.
A irbesartana é excretada no leite de ratas lactantes. Não se sabe se a irbesartana ou seus metabólitos são excretados no leite humano. O médico deve tomar a decisão sobre a descontinuação da amamentação ou do tratamento, levando-se em conta a importância de Aprovel no tratamento da mãe e o risco potencial para o bebê.
Pacientes Idosos
Entre os pacientes que receberam irbesartana nos estudos clínicos não foram observadas diferenças globais em termos de eficácia ou segurança entre os pacientes idosos (acima de 65 anos) e os pacientes mais jovens. Desta forma, geralmente não é necessária redução da dose para os pacientes idosos.
Pacientes Pediátricos
A segurança e a eficácia em pacientes pediátricos não foram estabelecidas.
Pacientes com Insuficiência Renal (dos rins) ou Hepática (do fígado)
Geralmente não é necessária redução da dose em pacientes com insuficiência hepática leve a moderada ou com insuficiência renal (independentemente do grau de disfunção).
Pacientes com Depleção (diminuição) de Volume Intravascular
Caso você apresente hiponatremia (deficiência de sódio no sangue) e/ou hipovolemia (diminuição do volume sanguíneo) severas (por exemplo, pacientes tratados vigorosamente com diuréticos ou submetidos à hemodiálise), esta condição deve corrigida antes da administração de Aprovel, ou deve-se considerar uma dose inicial mais baixa. Se a pressão arterial não for adequadamente controlada, a dose poderá ser aumentada.
Alterações na capacidade de dirigir veículos e operar máquinas
Os efeitos de irbesartana na habilidade de dirigir e operar máquinas não foram estudados, mas com base nas propriedades farmacodinâmicas, é improvável que a irbesartana afete esta habilidade. Quando você for dirigir ou operar máquinas, leve em consideração que, durante o tratamento da hipertensão, pode ocorrer tontura e cansaço ocasional.
Composição
Aprovel 150 mg:
Cada comprimido revestido contém 150 mg de irbesartana.
Excipientes: lactose monoidratada, hipromelose, croscarmelose sódica, celulose microcristalina, dióxido de silício, estearato de magnésio, cera de carnaúba, dióxido de titânio e macrogol 3000.
Aprovel 300 mg:
Cada comprimido revestido contém 300 mg de irbesartana.
Excipientes: lactose monoidratada, hipromelose, croscarmelose sódica, celulose microcristalina, dióxido de silício, estearato de magnésio, cera de carnaúba, dióxido de titânio e macrogol 3000.
Superdosagem
Doses diárias de até 900 mg/dia durante 8 semanas não revelaram toxicidade na experiência com adultos expostos. Não há informação específica disponível para o tratamento da superdose com Aprovel. O paciente deve ser intensamente monitorado e o tratamento deve ser sintomático e de suporte.
As medidas sugeridas incluem indução da emese (vômito) e/ou lavagem gástrica. A irbesartana não é removida do organismo por hemodiálise.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Com base em estudos in vitro, não se espera que ocorram interações com fármacos cujo metabolismo é dependente das isoenzimas CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2D6, CYP2E1 ou CYP3A4 do citocromo P450.
A irbesartana é primariamente metabolizada pela CYP2C9, no entanto, durante estudos clínicos de interação medicamentosa, não se observaram interações farmacodinâmicas significativas quando a irbesartana foi coadministrada com a varfarina (fármaco metabolizado pela CYP2C9).
A irbesartana não afeta a farmacocinética da digoxina ou da sinvastatina.
Os parâmetros farmacocinéticos da irbesartana não são afetados pela coadministração com a nifedipina ou a hidroclorotiazida.
A combinação de irbesartana com medicamentos que contenham alisquireno é contraindicada em pacientes com diabetes mellitus ou com insuficiência renal moderada a grave (taxa de filtração glomerular < 60 mL/min/1,73 m2) e não é recomendada em outros pacientes.
Inibidores da ECA
A combinação de irbesartana com inibidores da ECA é contraindicada em pacientes com nefropatia diabética e não é recomendada para os demais pacientes.
Com base na experiência com a utilização de outros fármacos que afetam o sistema renina-angiotensina, o uso concomitante de diuréticos poupadores de potássio, suplementos de potássio ou substitutos do sal contendo potássio podem levar a aumentos do potássio sérico.
Em pacientes idosos, com depleção de volume (incluindo aqueles em tratamento com diuréticos) ou com comprometimento da função renal, a coadministração com AINEs, incluindo os inibidores seletivos da COX-2, com os antagonistas dos receptores da angiotensina II, incluindo a irbesartana, pode resultar na deterioração da função renal, incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis.
Monitorar a função renal periodicamente em pacientes recebendo irbesartana e tratamento com AINEs.
O efeito antihipertensivo dos antagonistas dos receptores da angiotensina II, incluindo a irbesartana, pode ser atenuado pelos AINEs, incluindo os inibidores seletivos da COX-2.
Ação da Substância
Resultado de eficácia
Hipertensão
Estudos para avaliação de dose em 560 pacientes demonstraram que uma dose diária de 100 a 300 mg de irbesartana produziu reduções clinicamente significativas na pressão arterial sistólica (PAS) e na pressão arterial diastólica (PAD), com variações corrigidas para o placebo da ordem de 3,1 a 6,1mmHg.
Normalização da PAD para 90mmHg ou menos foi observada em 40% daqueles com 100 a 200 mg diários e 60% daqueles tratados com 300mg diários.
Doses iniciais de 15 0mg de irbesartana com titulação para 300 mg foram consideradas como apresentando eficácia e segurança ótimas durante estudos de titulação de doses controlados com placebo envolvendo mais de 300 pacientes.
A fase de inclusão com placebo estabeleceu uma PAD sentado entre 95 e 110mmHg.
Os pacientes foram randomizados para placebo, irbesartana 75 ou 150 mg inicialmente. Após 6 semanas, pacientes com PAD sentado maior que 90mmHg tiveram as doses dobradas até o final das 12 semanas do estudo.
Foi usado um esfigmomanômetro com manguito padrão. Os resultados sumarizados abaixo

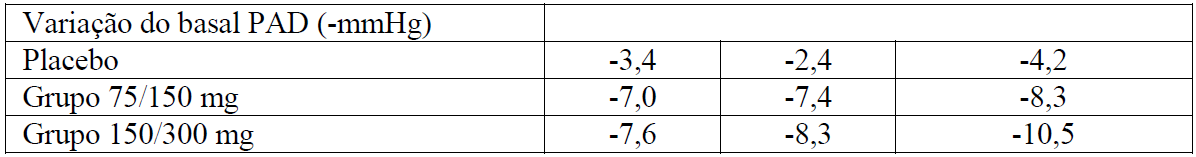
Hipertensão e Doença Renal Diabética Tipo 2
O Estudo com irbesartana na Nefropatia Diabética (IDNT) foi um estudo de morbidade e mortalidade comparando irbesartana, anlodipino e placebo, multicêntrico, randomizado, controlado e duplo-cego.
Em 1715 pacientes hipertensos com Diabetes tipo 2 (proteinúria ? 900mg/dia e creatinina sérica 1,0 – 3,0mg/dL) foram avaliados os efeitos em longo prazo (média de 2,6 anos) de irbesartana na progressão da doença renal e mortalidade por qualquer causa.
Além disso, como desfecho secundário, o efeito de irbesartana no risco de eventos cardiovasculares fatais e não fatais foi avaliado.
Os pacientes foram randomizados para receber irbesartana 75mg, anlodipino 2,5 mg ou placebo uma vez por dia. Os medicamentos foram titulados para uma dose de manutenção de 300 mg de irbesartana, 10 mg de anlodipino ou placebo, conforme tolerado pelo paciente.
A irbesartana demonstrou uma redução no risco relativo de 20% no desfecho primário composto (primeira ocorrência de qualquer uma das seguintes: duplicação da creatinina sérica, doença renal em estágio final de mortalidade por qualquer causa) comparado ao placebo (p=0,024) e uma redução no risco relativo de 23% comparado ao anlodipino (p=0,006).
Pressões arteriais semelhantes foram alcançadas nos grupos irbesartana e anlodipino.
Não houve diferença significativa na avaliação dos eventos cardiovasculares fatais e não fatais (morte cardiovascular, infarto do miocárdio não fatal, hospitalização por insuficiência cardíaca, sequela neurológica permanente atribuída a AVE ou amputação acima do tornozelo) entre os três grupos de tratamento.
Os efeitos de irbesartana sobre eventos renais não foram uniformes em todos os subgrupos: eles pareceram menos favoráveis em mulheres e indivíduos de raças não brancas.
As análises de subgrupos são difíceis de interpretar e não se sabe se estas informações representam diferenças verdadeiras ou se são apenas efeitos do acaso.
O Estudo dos Efeitos de irbesartana na Microalbuminúria em Pacientes Hipertensos com Diabetes Melitus tipo 2 (effects of Irbesartan on MicroAlbuminuria in Hypertensive Patients with Type 2 Diabetes Mellitus – IRMA 2) foi multicêntrico, randomizado, controlado por placebo, duplo-cego, avaliou morbidade e foi conduzido em 590 pacientes hipertensos com Diabetes tipo 2, microalbuminúria (20 – 200mcg/min; 30 – 300mg/dia) e função renal normal (creatinina sérica ? 1,5mg/dL em homens e ? 1,1mg/dL em mulheres).
O estudo examinou como desfecho primário os efeitos em longo prazo (2 anos) de irbesartana na progressão para proteinúria clínica aberta (taxa de excreção da albumina urinária [TEA] > 200 mcg/min [> 300 mg/dia] e um aumento na TEA de no mínimo 30% do basal).
Além disso, após um e dois anos de tratamento, o efeito de irbesartana foi avaliado na variação da TEA após uma noite e na variação do clearance de creatinina de 24 horas.
A irbesartana 300 mg demonstrou uma redução de risco relativa de 70% no desenvolvimento de proteinúria clínica (franca) comparado ao placebo (p=0,0004).
A irbesartana 150 mg demonstrou uma redução de risco relativa de 39% no desenvolvimento de proteinúria comparado ao placebo (p=0,085).
O retardo na progressão para proteinúria clínica (franca) foi evidente precocemente aos três meses de tratamento e continuou ao longo do período de 2 anos.
O declínio do clearance da creatinina de 24 horas não diferiu significativamente entre os três grupos. Regressão para normoalbuminúria (?20 mcg/min); ?30 mcg/dia) foi mais frequente no grupo irbesartana 300 mg (34%) que no grupo placebo (21%).
Características farmacológicas
A irbesartana é um antagonista não-peptídico dos receptores da angiotensina II (subtipo AT1).
Mecanismo de ação
A irbesartana é um antagonista específico irreversível dos receptores da angiotensina II (subtipo AT1). A angiotensina II é um componente importante do sistema renina-angiotensina e está envolvida na fisiopatologia da hipertensão e na homeostase do sódio.
A irbesartana não necessita ser ativada metabolicamente.
A irbesartana bloqueia os potentes efeitos da angiotensina II da vasoconstrição e secreção de aldosterona pelo antagonismo seletivo dos receptores da angiotensina II (subtipo AT1) localizados nas células da musculatura lisa vascular e no córtex adrenal.
Não possui atividade agonista no receptor AT1 e apresenta afinidade muito maior (mais de 8.500 vezes) pelo receptor AT1 do pelo receptor AT2 (um receptor que não demonstrou estar associado com a homeostase cardiovascular).
A irbesartana não inibe enzimas envolvidas no sistema renina-angiotensina (isto é, renina, enzima conversora da angiotensina [ECA] ou afeta outros receptores hormonais ou canais iônicos envolvidos na regulação cardiovascular da pressão arterial e homeostase do sódio.
O bloqueio da irbesartana nos receptores AT1 interrompe a retroalimentação do sistema renina-angiotensina, resultando na elevação dos níveis da renina plasmática e da angiotensina II.
A concentração plasmática da aldosterona decresce com a administração da irbesartana; no entanto, os níveis de potássio sérico não são significativamente afetados (aumento médio ? 0,1mEq/L) nas doses recomendadas.
A irbesartana não tem nenhum efeito relevante sobre triglicérides séricos, colesterol ou glicemia.
Também não possui efeito sobre o ácido úrico sérico ou a excreção do ácido urinário.
Tempo médio de início de ação
O efeito anti-hipertensivo da irbesartana é perceptível após a primeira dose, evidenciando-se substancialmente em 1-2 semanas, e o efeito máximo ocorre após 4-6 semanas.
Propriedades farmacodinâmicas
O efeito anti-hipertensivo da irbesartana é perceptível após a primeira dose, evidenciando-se substancialmente em 1-2 semanas, e o efeito máximo ocorre após 4-6 semanas.
Em estudos de longa duração, o efeito da irbesartana foi mantido durante até um ano.
Doses únicas diárias de até 900mg proporcionam decréscimos da pressão arterial relacionados à dose.
Doses únicas diárias de 150-300 mg reduziram a pressão arterial nas posições supina e sentada (24 horas após a administração) em uma média de 8-13/5-8mmHg (sistólica/diastólica) acima daquela associada ao placebo.
Os efeitos no vale são 60%-70% das respostas nos picos diastólico e sistólico correspondentes.
O efeito ótimo sobre a pressão arterial em 24 horas é alcançado com dose única diária.
A extensão da redução da pressão arterial é a mesma tanto na posição supina como em pé.
Não são frequentes os efeitos ortostáticos, mas, assim como os inibidores da ECA, estes efeitos podem ocorrer em pacientes com sódio e/ou volume depletados.
Os efeitos anti-hipertensivos da irbesartana e dos diuréticos tiazídicos são aditivos.
Em pacientes que não forem adequadamente controlados somente com a irbesartana, a adição de baixa dose de hidroclorotiazida (12,5 mg) à irbesartana em dose única diária resulta em redução adicional da pressão arterial ajustada pelo placebo de 7-10/3-6mmHg (sistólica/diastólica).
A eficácia da irbesartana não é influenciada pela idade ou sexo.
Assim como com outros fármacos que afetam o sistema renina-angiotensina, pacientes de raça negra têm resposta notavelmente menor à monoterapia com a irbesartana.
Quando a irbesartana for administrada concomitantemente com baixa dose de hidroclorotiazida (12,5 mg diários), a resposta anti-hipertensiva dos pacientes de raça negra se aproximará da dos pacientes de raça branca.
Após a retirada da irbesartana, a pressão arterial retorna gradualmente ao valor basal. Não se observou hipertensão rebote.
Propriedades farmacocinéticas
Absorção
A irbesartana é um agente ativo de administração oral e não requer biotransformação para a sua forma ativa.
Após a administração oral, a irbesartana é rápida e completamente absorvida. A biodisponibilidade oral da irbesartana é de 60%-80%. A alimentação não afeta a biodisponibilidade.
A concentração plasmática máxima ocorre 1,5 horas a 2 horas após a administração oral.
Distribuição
A irbesartana liga-se às proteínas plasmáticas a uma taxa de aproximadamente 96% e não se liga consideravelmente aos componentes celulares do sangue.
O volume de distribuição é de 53-93 litros.
Metabolismo
Após a administração oral ou intravenosa da irbesartana marcada com 14C, 80%-85% da radioatividade circulante no plasma corresponde ao composto inalterado.
A irbesartana é metabolizada pelo fígado via conjugação glicurônica e oxidação.
O principal metabólito circulante é o conjugado irbesartana – glucuronida (aproximadamente 6%).
A irbesartana é oxidada principalmente pelo citocromo P450, isoenzima CYP2C9; a isoenzima CYP3A4 tem efeito desprezível.
A irbesartana não é metabolizada pela maior parte das isoenzimas comumente associadas com o metabolismo de fármacos (isto é, CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2D6 ou CYP2E1), nem induziu ou inibiu substancialmente estas enzimas. A irbesartana também não induz, nem inibe a isoenzima CYP3A4.
Eliminação
A irbesartana e seus metabólitos são excretados tanto pela via biliar como renal.
Cerca de 20% da radioatividade administrada após uma dose oral ou intravenosa de irbesartana marcada com 14C é recuperada na urina e o restante é recuperado nas fezes. Menos de 2% da dose é excretada na urina como irbesartana inalterada.
A meia-vida de eliminação final (t1/2) da irbesartana é de 11-15 horas.
O clearance corpóreo total da irbesartana administrada por via intravenosa é de 157-176mL/min, dos quais 3,0-3,5mL/min é clearance renal.
A irbesartana possui farmacocinética linear dentro da faixa terapêutica. As concentrações plasmáticas de equilíbrio são obtidas dentro de 3 dias após o início do regime de dose única diária.
Observou-se um acúmulo limitado (?20%) no plasma após a repetição de doses únicas diárias.
Propriedades Farmacocinéticas em populações especiais
Insuficiência Renal
A farmacocinética da irbesartana não se altera significativamente nos pacientes com insuficiência renal (independente do grau) ou sob hemodiálise.
A irbesartana não é removida por hemodiálise.
Insuficiência Hepática
a farmacocinética da irbesartana não foi significativamente afetada em pacientes com insuficiência hepática devido à cirrose leve a moderada.
Pacientes Idosos
Em idosos (homens e mulheres) de 65 a 80 anos, normotensos e com funções renal e hepática clinicamente normais, a ASC (área sob a curva) e o pico das concentrações plasmáticas (Cmáx) da irbesartana foram aproximadamente 20% a 50% maiores que as observadas nos indivíduos jovens (18 a 40 anos). Independentemente da idade, a meia-vida de eliminação é comparável.
Não se observaram diferenças significativas nos efeitos clínicos relacionados à idade.
Sexo
Em homens e mulheres com hipertensa observaram-se concentrações plasmáticas mais altas (11%- 44%) de irbesartana em mulheres do que em homens, ainda que, após dosagens múltiplas, homens e mulheres não demonstrassem diferenças, tanto em relação à meia-vida como ao acúmulo de fármaco.
Não se observaram diferenças clínicas relacionadas ao sexo.
Raça
Em indivíduos normotensos de raça negra e branca, os valores da ASC e da meia-vida de eliminação final da irbesartana foram aproximadamente 20%-25% maiores nos indivíduos de raça negra do que nos de raça branca; o pico das concentrações plasmáticas (Cmáx) da irbesartana são essencialmente equivalentes.
Carcinogênese, Mutagênese, Comprometimento da Fertilidade
Não se observou evidência de carcinogenicidade quando a irbesartana foi administrada em ratos tratados com doses de até 500/1.000 mg/Kg/dia (machos/fêmeas, respectivamente) e em camundongos que receberam 1.000 mg/Kg/dia durante 2 anos.
Estas doses forneceram uma exposição sistêmica de até 4-25 vezes (ratos) e 4-6 vezes (camundongos) em relação à exposição em humanos recebendo 300 mg/dia.
A irbesartana não foi mutagênica em uma série de testes in vitro (teste microbiano AMES, teste de reparo de DNA em hepatócito de rato, ensaio de mutação do gene em células de mamíferos V79).
Vários testes de indução de aberrrações cromossômicas (in vitro – ensaio de linfócitos humanos; in vivo – estudo de micronúcleo de camundongo) tiveram resultados negativos com a irbesartana.
A fertilidade e o desempenho reprodutivo não foram afetados em estudos com ratos machos e fêmeas mesmo em doses orais de irbesartana que causam alguma toxicidade parenteral (até 650 mg/Kg/dia).
Não se observaram efeitos significativos no número de corpos lúteos, implantes ou fetos sobreviventes.
A irbesartana não afeta a sobrevivência, desenvolvimento ou reprodução da prole.
Com doses de 50 mg/Kg/dia ou maiores, observaram-se efeitos transitórios em fetos de ratos (aumento da cavitação pélvia renal, hidroureter ou edema subcutâneo) que se resolveram após o nascimento.
Com doses de 30mg/Kg/dia observaram-se mortalidade materna, aborto e reabsorção fetal prematura em coelhos.
Não se observaram efeitos teratogênicos em ratos e coelhos.
Cuidados de Armazenamento
Aprovel deve ser mantido em sua embalagem original, em temperatura ambiente (15 a 30°C).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Apresentação
Comprimido revestido oval, biconvexo, de coloração branca ou quase branca.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Mensagens de Alerta
Informe ao seu médico se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para sua saúde.
Todo medicamento deve ser mantido fora do alcance das crianças.
Venda sob prescrição médica.
Dizeres Legais
M.S.: 1.1300.0993
Farm. Resp.:
Silvia Regina Brollo
CRF-SP 9.815
Registrado por:
Sanofi-Aventis Farmacêutica Ltda.
Av. Mj. Sylvio de M. Padilha, 5200 – São Paulo – SP
CNPJ 02.685.377/0001-57
Indústria Brasileira
Fabricado por:
Sanofi Winthrop Industrie
1, rue de la Vierge - Ambarès et Lagrave
33565 Carbon Blanc Cedex
França
Importado e embalado por:
Sanofi-Aventis Farmacêutica Ltda.
Rua Conde Domingos Papaiz, 413 – Suzano – SP
CNPJ 02.685.377/0008-23