para o que é indicado e para que serve?
Para que serve Anoro Ellipta é indicado para o tratamento de manutenção da broncodilatação de longo prazo, para aliviar os sintomas em pacientes com doença pulmonar obstrutiva crônica (DPOC), incluindo bronquite crônica e enfisema.Continue lendo...
ofertas de
Anoro Ellipta 62,5 25Mcg ...
ofertas de Anoro Ellipta 62,5 25Mcg ...
R$ 341,19
R$ 349,90
R$ 370,99
R$ 379,19
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Anoro Ellipta é indicado para o tratamento de manutenção da broncodilatação de longo prazo, para aliviar os sintomas em pacientes com doença pulmonar obstrutiva crônica (DPOC), incluindo bronquite crônica e enfisema.
Anoro Ellipta não deve ser usado para aliviar um ataque súbito de falta de ar ou chiado.
Como o Anoro funciona?
O brometo de umeclidínio e o trifenatato de vilanterol, substâncias ativas de Anoro Ellipta, ajudam a dilatar as vias aéreas, tornando mais fácil a entrada e a saída de ar dos pulmões. Isso alivia os sintomas da DPOC caracterizada por dificuldades respiratórias. Quando Anoro Ellipta é usado regularmente, pode auxiliar no controle dos problemas respiratórios relacionados com a sua doença, minimizando o efeito desses problemas em sua vida cotidiana.
Contraindicação
O uso de Anoro Ellipta é contraindicado a pacientes com alergia grave à proteína do leite, bem como a pacientes que tenham demonstrado hipersensibilidade (alergia) ao brometo de umeclidínio, ao trifenatato de vilanterol ou a qualquer componente da fórmula.
Se você acha que qualquer uma dessas condições se aplica a você, não use Anoro Ellipta antes de consultar seu médico.
Como usar
Quando você usar o inalador Ellipta pela primeira vez, não é necessário verificar se ele está funcionando adequadamente. Você também não precisa prepará-lo para uso de um modo especial.
Apenas siga as instruções abaixo.
O cartucho de Anoro Ellipta contém:
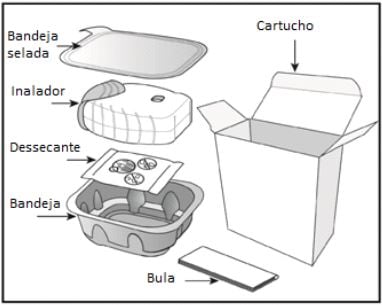
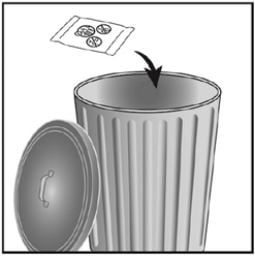
O inalador é fornecido em uma bandeja selada. Não abra a bandeja até que esteja pronto para inalar uma dose do medicamento. Quando estiver pronto para usar o inalador, remova a tampa da bandeja. A bandeja contém um sachê dessecante, cuja função é reduzir a umidade. Deve-se descartar esse dessecante. Não se deve ingerir nem inalar esse material.
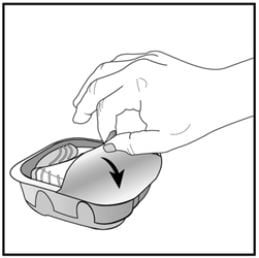
Anote a data em que o inalador deve ser descartado (6 semanas após a abertura da bandeja) no rótulo do inalador. Quando o inalador é retirado da bandeja selada, estará na posição “fechado”.
Quando o inalador é retirado da bandeja selada, estará na posição “fechado”. Não abra o inalador até que esteja pronto para inalar uma dose do medicamento. Anote a “data de descarte” no rótulo do inalador. A data de descarte é seis semanas após a data de abertura da bandeja. Após essa data, o inalador não deverá ser utilizado.
As instruções abaixo para o inalador Ellipta com 30 doses também se aplicam ao dispositivo com 7 doses.
- Leia as instruções a seguir antes de iniciar a inalação:
Se abrir e fechar a tampa sem inalar o medicamento, você perderá a dose.
A dose perdida será mantida com segurança dentro do inalador, porém não estará mais disponível para uso.
Não é possível em uma mesma inalação ocorrer o uso de dose dupla ou dose extra.
- Como preparar a dose
A tampa só deve ser aberta quando você estiver pronto para inalar a dose. Não agite o inalador.
Deslize a tampa completamente para baixo até você ouvir um clique.
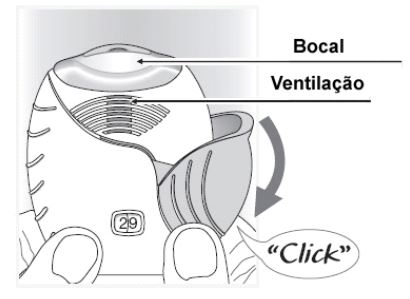
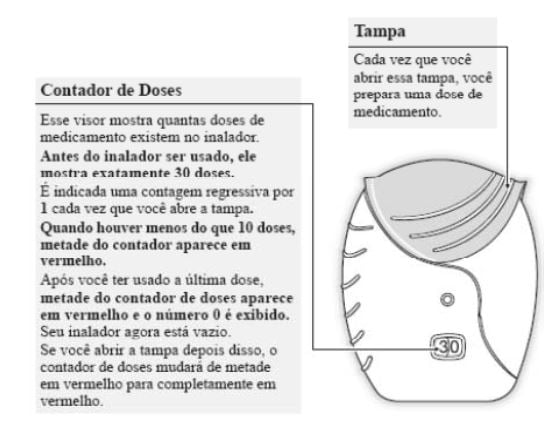
O medicamento está pronto para ser inalado. Para confirmar isso, o contador de doses mostrará que há uma dose a menos.
Se o contador de doses não realizar a contagem regressiva quando você ouvir o clique, o inalador não fornecerá o medicamento. Leve o inalador para o farmacêutico para aconselhamento.
Não agite o inalador em momento nenhum.
- Como inalar o medicamento
Segurando o inalador longe da boca, expire confortavelmente o máximo que puder. Não expire dentro do inalador.
Coloque o bocal entre os lábios e feche-os firmemente ao redor do bocal. Não bloqueie a ventilação com os dedos.
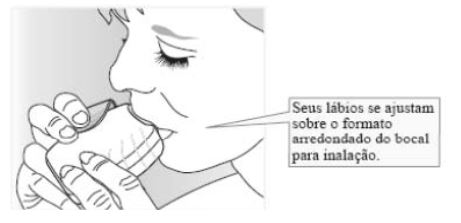
Faça uma inspiração longa, constante e profunda pela boca. Segure essa inspiração por pelo menos 3 ou 4 segundos.
Remova o inalador Ellipta da boca.
Expire lenta e suavemente.
Mesmo quando usar o inalador Ellipta corretamente, poderá não sentir o gosto ou perceber o uso do medicamento.
Caso deseje limpar o bocal, use um pano seco antes de fechar a tampa.
- Feche o inalador:
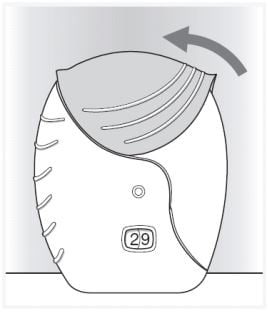
Deslize a tampa para cima até fechar o bocal.
Posologia
Adulto
Uma inalação de Anoro Ellipta 62,5/25 microgramas uma vez ao dia, sempre no mesmo horário.
A dose diária não deve exceder uma inalação de 62,5/25 microgramas.
Crianças
O uso em pacientes com idade inferior a 18 anos não é relevante, considerando-se a indicação deste medicamento.
Idosos
Não é necessário ajuste de dose em pacientes com mais de 65 anos de idade.
Insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal.
Insuficiência hepática
Não é necessário ajuste de dose em pacientes com insuficiência hepática de leve a moderada. Anoro Ellipta não foi estudado em pacientes com insuficiência hepática grave.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Anoro?
Não use uma dose extra para compensar uma dose perdida. Apenas use sua próxima dose no horário habitual.
Se você ficar sem ar ou com chiado, use o seu medicamento de ação rápida e procure ajuda médica.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Converse com o seu médico antes de usar Anoro Ellipta:
- Se você tem asma;
- Se você tem problemas cardíacos ou pressão arterial alta;
- Se você tem um problema ocular chamado glaucoma;
- Se você tem a próstata aumentada, dificuldade de urinar ou um bloqueio em sua bexiga;
- Se você tem diabetes;
- Se você sofre de epilepsia;
- Se você tem problemas na glândula tireoide;
- Se você tem problemas graves no fígado.
Anoro Ellipta ajuda a controlar os sintomas de DPOC, se usado regularmente. Se seus sintomas de DPOC (falta de ar, chiado e tosse) não melhorarem, piorarem ou Se você estiver usando seu medicamento de ação rápida com maior frequência, informe seu médico o mais rápido possível.
Em caso de reações alérgicas respiratórias imediatas: procure assistência médica.
Se você sentir dor no peito, tosse, chiado ou falta de ar logo após o uso de Anoro Ellipta, suspenda o uso imediatamente e informe seu médico o mais rápido possível.
É muito importante que você use Anoro Ellipta todos os dias, como indicado pelo seu médico. Isso vai ajudar você a manter-se livre de sintomas durante todo o dia e toda a noite.
Este medicamento contém lactose.
Este medicamento pode causar doping.
Reações Adversas
Reações alérgicas imediatas:
Se você tiver aperto no peito, tosse, chiado ou falta de ar logo após o uso de Anoro Ellipta, pare de usá-lo imediatamente e avise seu médico o mais rápido possível.
Reações comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento):
- Dor ao urinar e aumento da frequência urinária (podem ser sinais de uma infecção urinária);
- Dor de garganta com ou sem coriza (nariz congestionado);
- Sentimento de pressão ou dor nas bochechas e testa (podem ser sinais de inflamação dos seios nasais, conhecido por sinusite);
- Tosse;
- Dor e irritação na parte de trás da boca e da garganta;
- Prisão de ventre;
- Boca seca;
- Infecção das vias aéreas superiores;
- Dor no peito.
Reações incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Batimento cardíaco irregular;
- Batimento cardíaco acelerado;
- Palpitações;
- Ansiedade;
- Tremor;
- Alterações no paladar;
- Espasmos musculares (movimentos involuntários da musculatura);
- Rash (reação alérgica em que ocorre aparecimento de manchas na pele).
Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Reações alérgicas, incluindo: anafilaxia (respiração ofegante, tosse ou dificuldade em respirar, fraqueza repentina e tontura, podendo levar a colapso ou perda de consciência), angioedema (inchaço, às vezes da boca e do rosto), urticária (erupções na pele ou vermelhidão);
- Visão embaçada, pressão intraocular aumentada;
- Falta de ar acompanhada de tosse incessante e dor no peito (broncoespasmo paradoxal);
- Incapacidade de urinar (retenção urinária) e sensação de dor ou ardor ao urinar (disúria);
- Rouquidão (disfonia).
Reações alérgicas são incomuns:
Se você tiver qualquer sintoma descrito acima, pare de usar Anoro Ellipta imediatamente e avise seu médico o mais rápido possível.
Se qualquer evento adverso se tornar grave, ou se você perceber qualquer outro evento adverso, informe seu médico ou farmacêutico.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que seja indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
População Especial
Gravidez e lactação
Anoro Ellipta geralmente não é recomendado para uso durante a gravidez.
Se você está grávida, pensa que pode estar grávida ou planeja engravidar, não use Anoro Ellipta sem consultar o seu médico. Ele irá considerar o benefício para você e o risco para seu bebê de usar Anoro Ellipta durante a gravidez.
Não se sabe se os ingredientes de Anoro Ellipta podem passar para o leite materno. Se você estiver amamentando, fale com seu médico antes de usar Anoro Ellipta.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação do médico ou do cirurgião-dentista.
Composição
Cada dose contém:
| Brometo de umeclidínio (equivalente a 62,5mcg de umeclidínio) | 74,2mcg |
| Trifenatato de vilanterol (equivalente a 25mcg de vilanterol) | 40mcg |
| Excipientes: lactose monoidratada, estearato de magnésio q.s.p. | 1 dose |
Superdosagem
Se você inalar acidentalmente uma dose de Anoro Ellipta maior do que a recomendada pelo seu médico, informe o ocorrido o mais rápido que puder. Se possível, mostre ao médico o inalador Anoro Ellipta que você utilizou.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
A coadministração de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) com outros antagonistas muscarínicos de longa duração, agonistas beta2-adrenérgicos de ação prolongada ou medicamentos que contenham qualquer um destes agentes não foi estudada e não é recomendada, pois pode potencializar reações adversas conhecidas do antagonista muscarínico ou do agonista beta2-adrenérgico inalado.
Não use este medicamento em associação com outros agonistas beta2-adrenérgicos de ação prolongada devido ao risco de superdosagem.
O tratamento concomitante com derivados da metilxantina, corticosteroides ou diuréticos não poupadores de potássio pode potenciar possíveis efeitos de hipocalemia de agonista beta2-adrenérgico, portanto, deve ser usado com cautela.
Inibidores da monoamina oxidase e antidepressivos tricíclicos: utilize com extrema precaução. Podem potencializar os eventos adversos cardiovasculares.
Interação com betabloqueadores
Os bloqueadores beta-adrenérgicos podem enfraquecer ou antagonizar o efeito dos beta2-agonistas, tais como o vilanterol. Deve-se evitar o uso simultâneo de outros bloqueadores beta-adrenérgicos, seletivos ou não, a menos que exista real necessidade para seu uso. Interação com inibidores de CYP3A4.
O vilanterol, um componente de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa), é eliminado pelo CYP3A4, uma enzima que pertence à família das enzimas dos citocromo P450, mediado pelo metabolismo extenso de primeira passagem no trato gastrointestinal e no fígado.
Recomenda-se cautela ao administrar concomitantemente Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) com inibidores fortes de CYP3A4 (por exemplo, cetoconazol, ritonavir, claritromicina, conivaptana, indinavir, itraconazol, lopinavir, nefazodona, nelfinavir, saquinavir, telitromicina, troleandomicina, voriconazol), devido à possibilidade de aumento da exposição sistêmica ao vilanterol, que pode levar a um aumento potencial de reações adversas.
Ação da Substância
Resultados de eficácia
A segurança e a eficácia de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) administrado uma vez ao dia foram avaliadas em oito estudos clínicos de fase III de pacientes adultos com diagnóstico clínico de DPOC. Cinco desses estudos foram de eficácia e tiveram 6 meses de duração (DB2113361, DB2113373, DB2113360, DB2113374 e ZEP117115); dois foram de resistência a exercícios durante 12 semanas (DB2114417 e DB2114418); e um (DB2113359) avaliou a segurança de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) administrado durante um período de tratamento de 12 meses.
Na análise combinada dos estudos de eficácia primários (DB2113361, DB2113373, DB2113360, DB2113374), 46% dos indivíduos estavam em estágio GOLD II, 43% estavam em estágio GOLD III, e 11% estavam em estágio GOLD IV. Nenhum paciente em estágio GOLD I foi incluído. Os pacientes foram distribuídos de forma semelhante entre os grupos de tratamento. Com base em sintomas (pontuação mMRC) e histórico de exacerbação, 88% dos indivíduos se enquadraram na categoria GOLD B e 12% na categoria GOLD D. 31% dos indivíduos apresentaram reversibilidade ao salbutamol, tal como definido por VEF1 ?12% e ?200 mL acima do baseline pós-broncodilatação. Isso representa 35% dos pacientes com DPOC em estágio GOLD II e 28% dos pacientes em estágio GOLD III/IV.
Características de reversibilidade foram semelhantes entre os grupos de tratamento.
O estudo de segurança a longo prazo (DB2113359) foi em geral semelhante em dados demográficos e características de base aos estudos de eficácia primário, embora nenhum paciente em estágio GOLD IV tenha sido inscrito, uma vez havia preocupação quanto à segurança dos pacientes com DPOC muito grave, que possivelmente receberiam tratamento com placebo durante 52 semanas. 60% dos indivíduos estavam em estágio GOLD II e 39% estavam em estágio GOLD III.
Os dois estudos de comparação com TIO de 24 semanas de duração (DB2113360 e DB2113374) utilizaram o Teste de Avaliação de DPOC (CAT), que pode ser usado como alternativa ao mMRC para a categorização de grupos GOLD. Avaliação dos grupos GOLD com base na pontuação do CAT mostrou que a população resultante nestes dois estudos era composta de 9% GOLD A, 32% GOLD B, 7% GOLD C, e 53% dos indivíduos GOLD D, respectivamente. A definição de grupos GOLD A-D não estava disponível no momento que a análise dos outros estudos de eficácia primários individuais foi planejada, portanto, as análises de subgrupo foram baseadas em grau GOLD (I-IV).
Foram realizadas análises adicionais, em subgrupos pré-definidos com base na limitação ao fluxo aéreo (GOLD I-II e GOLD III e IV), para os resultados de função pulmonar (VEF1 pré-dose) dos estudos de eficácia primários individuais de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa). No momento da análise, a classificação em GOLD A-D não estava disponível, portanto, as análises de subgrupo foram baseadas em estágios GOLD (I- IV).
Sendo assim, a população de pacientes estudada nos estudos de eficácia primária e de segurança de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) inclui pacientes com um amplo espectro de gravidade de DPOC (leve a muito grave) e os resultados são aplicáveis à pacientes dos diferentes graus de DPOC (GOLD A-D), em tratamento na atenção primária. Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) demonstrou ser eficaz em ampla população de pacientes com DPOC com doença clinicamente relevante.
Os estudos incluíram Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) 62,5/25 mcg e/ou 125/25 mcg, ambos uma vez ao dia. Os resultados de eficácia para Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) 62,5/25 mcg são apresentados abaixo.
Estudos controlados com placebo
Em um estudo de 6 meses, DB2113373, Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) 62,5/25 microgramas demonstrou uma melhora estatisticamente significativa da função pulmonar definida pela variação do VEF1 pré dose na 24ª semana, em relação ao início do estudo, em comparação a placebo. Os efeitos broncodilatadores do uso de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa), em comparação a placebo, ficaram evidentes após o primeiro dia de tratamento e se mantiveram durante todo o período de tratamento.
Tabela 1. Parâmetros de eficácia primária na 24ª semana (estudo DB2113373):
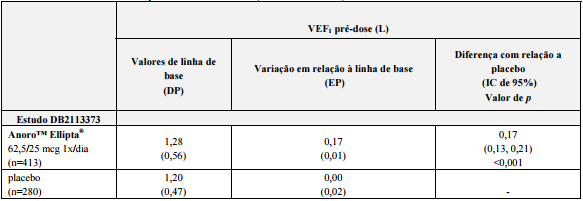 Abreviações: IC = intervalo de confiança; VEF1 = volume expiratório forçado em 1 segundo; L = litros; n = número recebendo tratamento; 1x/dia = uma vez ao dia; EP = erro padrão; DP = desvio padrão.
Abreviações: IC = intervalo de confiança; VEF1 = volume expiratório forçado em 1 segundo; L = litros; n = número recebendo tratamento; 1x/dia = uma vez ao dia; EP = erro padrão; DP = desvio padrão.
Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) demonstrou melhora acentuada, estatisticamente significativa, da média ponderada de VEF1 no início do estudo durante o período de 0-6 horas após a dose, na 24ª semana em comparação com o placebo (0,24 L, p<0,001).
Demonstrou-se melhora estatisticamente significativa em relação a placebo na pontuação focal do Transitional Dyspnoea Index (TDI) na semana 24 com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) (1,2 unidades, p<0,001). A porcentagem de pacientes no grupo de Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) que respondeu com a diferença mínima clinicamente importante (MCID) de ? 1,0 unidade na pontuação focal de TDI na 24ª semana foi de 58% (226 de 389) comparado a 41% (106 de 260) com placebo.
Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) melhorou significativamente a saúde relacionada à qualidade de vida (medida pelo Questionário Respiratório de St. George - SGRQ: St. George’s Respiratory Questionnaire) em comparação ao placebo na semana 24 (-5,51 unidades, p ? 0,001). A porcentagem de pacientes recebendo Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) que respondeu com uma redução ? 4 unidades a partir da linha de base (diferença mínima clinicamente importante - MCID) da pontuação total do SGRQ foi de 49% (188 de 381) em comparação a 34% (86 de 254) com placebo.
Além, disso, os pacientes tratados com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) necessitaram de um menor número de administrações de salbutamol como medicação de resgate comparados com placebo (redução média estatisticamente significativa de 0,8 dose diária de medicação de resgate; p=0,001). Em todo o estudo de 24 semanas, os pacientes tratados com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) apresentaram maior número de dias sem necessitar da medicação de resgate (em média 36,1%) em comparação com o placebo (em média 21,7%; não se realizou nenhuma análise estatística formal com esse parâmetro).
O tratamento com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) na dose de 62,5/25 microgramas resultou em um menor risco de exacerbação da DPOC comparado ao placebo (análise do tempo até a primeira exacerbação: Razão de Riscos 0,5; IC 95% 0,3 a 0,8, redução de risco 50%, p=0,004).
Estudos Comparativos com tiotrópio
Nos estudos ZEP117115 e DB2113360, o tratamento com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) na dose de 62,5/25 proporcionou melhora estatisticamente e clinicamente significativa do VEF1 pré-dose, em comparação ao tiotrópio, na 24ª semana. No estudo DB2113374, Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) 62,5/25 mcg demonstrou uma melhora clinicamente significativa da linha de base do VEF1 pré-dose em comparação com tiotrópio na semana 24.
Tabela 2. Parâmetros de eficácia primária na 24ª semana (estudos ZEP117115, DB2113360 e DB2113374):
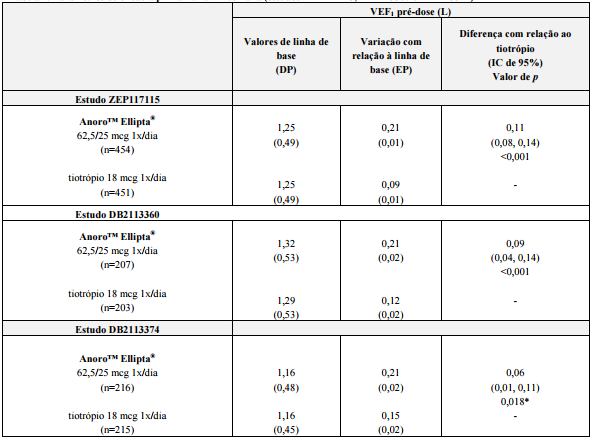 Abreviações: IC = intervalo de confiança; VEF1 = volume expiratório forçado em 1 segundo; L = litro; mcg = micrograma; n = número randomizado para tratamento; 1x/dia = uma vez ao dia; EP = erro padrão; DP = desvio padrão.
Abreviações: IC = intervalo de confiança; VEF1 = volume expiratório forçado em 1 segundo; L = litro; mcg = micrograma; n = número randomizado para tratamento; 1x/dia = uma vez ao dia; EP = erro padrão; DP = desvio padrão.
*Um procedimento de análise hierárquica foi utilizado neste estudo, portanto, a significância estatística sobre esta comparação não pode ser inferida.
Nos estudos ZEP117115 e DB2113360 Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) demonstrou melhora acentuada e estatisticamente significativa de 0,11 e 0,07 L, respectivamente da variação da média ponderada de VEF1 durante período de 0-6 horas, na 24ª semana, em relação ao início do estudo, em comparação ao tiotrópio (em ambos os casos, p=0,005). No estudo DB2113374 Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa)demonstrou melhora clinicamente significativa de 0,10 L da variação da média ponderada de VEF1, durante o período de 0-6 horas, na 24ª semana em relação ao início do estudo, em comparação ao tiotrópio.
Nos estudos DB2113360 e DB2113374, tanto Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) quanto o tiotrópio melhoraram a pontuação do TDI e SGRQ em comparação ao observado no início do estudo. No terceiro estudo ativo-comparador (ZEP117115), uma melhora estatisticamente significativa comparada ao tiotrópio na mudança da linha de base na pontuação total do SGRQ na semana 24 foi demonstrada para Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) (-2,10 unidades, p=0,006). A porcentagem de pacientes recebendo Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) que respondeu com uma redução da linha de base de ? 4 unidades (MCID) na pontuação total do SGRQ deste estudo foi de 53% (237/445), em comparação com 46% (196/430) para o tiotrópio.
Foram observadas melhoras estatisticamente significativas quanto ao uso de salbutamol como medicação de resgate nas semanas 1-24 com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) em relação ao tiotrópio nos estudos ZEP117115 (-0.5 dose por dia; p<0.001) e DB2113360 (-0,7 dose por dia, p=0,022).
Ao longo dos estudos ZEP117115, DB2113360 e DB2113374, os pacientes tratados com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) tinham, em média, uma redução maior da linha de base na proporção de dias em que nenhuma medicação de resgate era necessária (21,5%, 18,6% e 17,6%, respectivamente), em comparação com tiotrópio (13,3%, 11,7% e 13,4%, respectivamente; nenhuma análise estatística formal foi realizada neste parâmetro).
No estudo ZEP117115, o tratamento com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) 62,5/25 microgramas resultou em um baixo risco de exacerbação de DPOC comparado com tiotrópio (análise do tempo até a primeira exacerbação: razão de risco (RR) 0,5; IC 95% 0,3 a 1,0, redução de risco de 50%, p=0,044).
Tabela 3: Desfechos de função pulmonar, sintomáticos e de qualidade de vida relacionada à saúde na Semana 24:
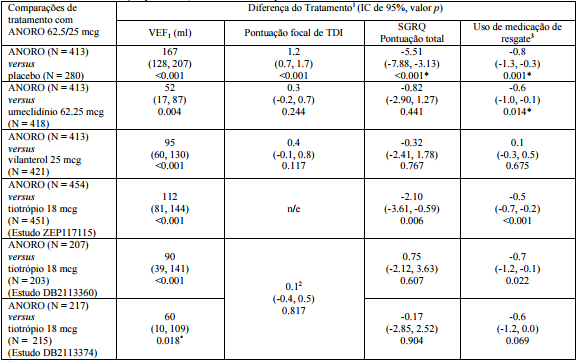 ?Um procedimento de análise hierárquica foi utilizado neste estudo, portanto, a significância estatística sobre esta comparação não pode ser inferida.
?Um procedimento de análise hierárquica foi utilizado neste estudo, portanto, a significância estatística sobre esta comparação não pode ser inferida.
N=número na população intenção de tratar.
mcg = microgramas.
n/e = não avaliado.
1.Média dos mínimos quadrados.
2.Dados agrupados do Estudo DB2113360 e Estudo DB2113374.
3.Diferença no número médio de puffs por dia além das Semanas 1-24.
Estudos de suporte de 3 meses para avaliação da resistência a exercícios físicos
A resistência a exercícios físicos foi avaliada em dois estudos clínicos replicados, de 12 semanas, com a realização do teste ESWT (Endurance Shuttle Walk Test), em pacientes adultos portadores de DPOC e hiperinsuflação (capacidade residual funcional [CRF] >120%).
No primeiro estudo (DB2114418), o tratamento com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) 62,5/25 demonstrou uma melhora estatisticamente significativa, em comparação a placebo, do tempo de resistência a exercícios (TRE), obtido 3 horas após a administração do produto na Semana 12 de 69,4 segundos (p=0,003). A melhora do TRE em comparação a placebo foi observada no Dia 2 e mantida nas semanas 6 e 12. No segundo estudo (DB2114417), o tratamento com Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) 62,5/25 não demonstrou uma melhora estatisticamente significativa do TRE em comparação ao placebo, (21,9 segundos; p>0,05).
No estudo DB2114418, Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) evidenciou uma melhora estatisticamente significativa, comparado ao placebo, da variação do VEF1 pré-dose na Semana 12 de 0,24 L( p<0,001), em relação ao início do estudo. Nesse estudo também houve melhora estatisticamente significativa em comparação ao placebo da variação das medidas de volume pulmonar pré-dose e em 3 horas após a dose na Semana 12 (capacidade inspiratória de 0,24L e 0,32 L, respectivamente, volume residual de -0,47 e -0,64 L respectivamente, e capacidade residual funcional de -0,35L e 0,52 L respectivamente; em todos os casos, p<0,001).
No estudo DB2114417, Brometo de Umeclidinio + Trifenanato de Vilanterol (substância ativa) demonstrou uma melhora clinicamente significativa em comparação ao placebo da variação do VEF1 pré-dose na Semana 12 de 0,21 L, em relação ao início do estudo. Nesse estudo também houve melhora em comparação ao placebo da variação das medidas de volume pulmonar pré-dose e em 3 horas após a dose na Semana 12 (capacidade inspiratória 0,20 e 0,24 L, volume residual -0,29 L e - 0,35 L respectivamente e capacidade residual funcional de -0,24L e -0,30 L respectivamente).
Características Farmacológicas
Propriedades farmacodinâmicas
Propriedades farmacocinéticas
Quando o umeclidínio e o vilanterol foram administrados em combinação por via inalatória, a farmacocinética de cada componente foi similar à observada quando essas substâncias ativas foram administradas separadamente. Para fins farmacocinéticos, cada componente pode, portanto, ser considerado em separado.
Cuidados de Armazenamento
O produto deve ser mantido em sua embalagem original e em temperatura ambiente (entre 15ºC e 30ºC).
Após aberto, válido por 6 semanas.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspectos físicos/características organolépticas
O inalador plástico Ellipta é um dispositivo cinza claro, um bocal com tampa protetora vermelha e um contador de doses, acondicionado em uma bandeja de alumínio que contém um dessecante. A bandeja é vedada com tampa metálica destacável.
Esse inalador contém dois strips (tiras) de 7 ou 30 doses distribuídos de maneira regular, cada uma contendo um pó branco.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Reg. MS: 1.0107.0318
Farm. Resp.:
Edinilson da Silva Oliveira
CRF-RJ Nº 18875
Fabricado por:
Glaxo Operations UK Limited.
Priory Street, Ware, Hertfordshire, SG12 0DJ – Inglaterra
Registrado e Importado por:
GlaxoSmithKline Brasil Ltda.
Estrada dos Bandeirantes, 8464 - Rio de Janeiro - RJ
CNPJ: 33.247.743/0001-10
Venda sob prescrição médica.
informações complementares
| Fabricante |
| GSK GLAXO |
| Princípio ativo |
| Trifenatato de vilanterol |
| Categoria do medicamento |
| Medicamentos de A-Z |
