para o que é indicado e para que serve?
Para que serve É indicado para a reposição crônica e terapia de manutenção em indivíduos com deficiência de alfa1antitripsina e evidência clínica de enfisema.Continue lendo...
sem ofertas para Zemaira - 1000 Mg Pó Liofilizado Injetável Frasco-Ampola + Frasco-Ampola Diluente 20 Ml + Dispositivo Transf

Parece que não há ofertas disponíveis para o produto no momento.
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
É indicado para a reposição crônica e terapia de manutenção em indivíduos com deficiência de alfa1antitripsina e evidência clínica de enfisema. Zemaira aumenta os níveis de alfa1antitripsina funcionais e antigênicos no soro e no fluido de revestimento epitelial do pulmão. Não há dados clínicos que demonstrem os efeitos a longo prazo da terapia de reposição crônica em indivíduos tratados com Zemaira. O efeito da terapia de reposição com Zemaira ou qualquer outro produto com alfa1antitripsina em agravações pulmonares e na progressão do enfisema na deficiência de alfa1antitripsina não foi demonstrado em estudos clínicos controlados, randomizados.
Contraindicação
Zemaira não deve ser usado por pacientes com hipersensibilidade (alergia) conhecida a qualquer um dos seus componentes. Zemaira também não deve ser usado por pacientes com histórico de anafilaxia (alergia grave) ou resposta sistêmica grave aos produtos contendo alfa1antitripsina. Zemaira não deve ser usado por pacientes com deficiência de IgA com anticorpos contra IgA, devido ao risco de hipersensibilidade grave. Zemaira não é indicado como terapêutica para pacientes com doença pulmonar, nos quais a deficiência grave de alfa1antitripsina não foi estabelecida.
Como usar
Cada frasco de Zemaira contém a quantidade de alfa1antitripsina indicada no rótulo do produto. A dose recomendada de Zemaira é de 60 mg/kg de peso corporal, administrada uma vez por semana. Estudos de variação da dose utilizando parâmetros de eficácia não foram realizados com qualquer produto contendo alfa1antitripsina.
Após a reconstituição conforme indicado, Zemaira pode ser administrado por via intravenosa (na veia) a uma velocidade de aproximadamente 0,08 mL/kg/min., de acordo com a resposta e o conforto do paciente. A infusão da dose recomendada (60 mg/kg de peso corporal) leva aproximadamente 15 minutos.
Precauções
Zemaira pode conter traços de IgA. Os pacientes que conhecidamente apresentam anticorpos contra IgA têm um maior risco de desenvolvimento de hipersensibilidade potencialmente grave e reações anafiláticas. Anticorpos contra IgA podem estar presentes em pacientes com deficiência seletiva ou grave de IgA. Zemaira não deve ser usado por pacientes com anticorpos contra a IgA devido ao risco de hipersensibilidade grave. A velocidade de infusão e o estado clínico do paciente devem ser cuidadosamente monitorizados durante a infusão. O paciente deve ser observado quanto aos sinais de reações relacionadas à infusão. Assim como ocorre com qualquer solução coloidal, pode haver um aumento do volume do sangue após administração intravenosa de Zemaira. Deve-se ter cuidado em pacientes sob risco de sobrecarga circulatória.
Reações Adversas
Aumento da tosse, dor abdominal, diarreia, dor de garganta, enxaqueca, náusea e parestesia (formigamento).
População Especial
Uso por crianças:
A segurança e a eficácia na população pediátrica não foram estabelecidas.
Uso por idosos:
Os estudos clínicos de Zemaira não incluíram número suficiente de pessoas com 65 anos de idade ou mais, para determinar se os pacientes idosos respondem diferentemente dos pacientes mais jovens. Assim como ocorre para todos os pacientes, a dose para os pacientes geriátricos deve ser adequada ao seu estado geral.
Riscos
Astenia (fraqueza), dor no local da injeção, tonturas, dores de cabeça, parestesia (formigamento) e prurido (coceira).
Cada um desses eventos adversos foi observado em 1 paciente (1%), em um grupo de 89 pacientes. As reações adversas foram moderadas. Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): dor de cabeça,
sinusite e infecção do trato respiratório superior. Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): hemorragia no local da injeção, bronquite, astenia, febre, dor, rinite, broncoespasmo, dor no peito, erupção cutânea, infecção, tonturas, equimose (manchas na pele), mialgia (dor muscular), prurido (coceira), vasodilatação, lesões acidentais, dor nas costas, dispepsia (indigestão), dispneia (dificuldade respiratória), hemorragia, reação no local da injeção, doença pulmonar.
Composição
COMPOSIÇÃO A atividade específica de Zemaira® é ? 0,7 mg de alfa1antitripsina funcional por miligrama de proteína total A pureza (alfa1antitripsina total/ proteína total) é ? 90% Após a reconstituição com 20 mL de água para injetáveis, cada frasco-ampola contém aproximadamente 1000 mg de alfa1antitripsina funcionalmente ativa, 81 mM de sódio, 38 mM de cloreto, 17 mM de fosfato e 144 mM de manitol Ácido clorídrico e/ou hidróxido de sódio pode ser adicionado para ajustar o pH Zemaira® não contém conservantes INFORMAÇÕES AO PACIENTE 1
Superdosagem
Não foram relatados casos de superdose. Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Interação Medicamentosa
Os pacientes com doença pulmonar obstrutiva crônica (DPOC) tomam regularmente uma variedade de medicamentos para aliviar os sintomas da doença pulmonar. Estes incluem frequentemente broncodilatadores, corticoides e anti-infecciosos. Não foram observadas interações medicamentosas com estas medicações concomitantes utilizadas durante os estudos clínicos.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados da eficácia
Estudos clínicos foram realizados com Alfa1Antitripsina (substância ativa) em 89 pacientes (59 homens e 30 mulheres). A idade dos pacientes variou de 29 a 68 anos (idade mediana 49 anos). Noventa e sete por cento dos pacientes tratados tinham o fenótipo PiZZ de deficiência de Alfa1Antitripsina (substância ativa) (A1AT) e 3% apresentavam o fenótipo MMALTON. Na triagem, os níveis de Alfa1Antitripsina (substância ativa) no soro ficaram entre 3,2 e 10,1 ?M (média de 5,6 ?M).
O objetivo dos estudos clínicos foi demonstrar que Alfa1Antitripsina (substância ativa) aumenta e mantém os níveis de Alfa1Antitripsina (substância ativa) acima de 11 ?M no soro e aumenta os níveis de A1T1 no fluido de revestimento epitelial do pulmão.
Em um estudo clínico controlado, duplo-cego, para avaliar a segurança e eficácia de Alfa1Antitripsina (substância ativa) , 44 pacientes foram randomizados para receber 60 mg/kg de Alfa1Antitripsina (substância ativa) ou de Prolastin (produto contendo Alfa1Antitripsina (substância ativa) disponível comercialmente), uma vez por semana durante 10 semanas.
Após 10 semanas, todos os pacientes receberam Alfa1Antitripsina (substância ativa), por um período adicional de 14 semanas. Todos os pacientes foram acompanhados durante um total de 24 semanas para completar a avaliação da segurança. A média dos níveis séricos mínimos de Alfa1Antitripsina (substância ativa) no estado estacionário (7-11 semanas), nos pacientes tratados com Alfa1Antitripsina (substância ativa), foi estatisticamente equivalente a dos pacientes tratados com Prolastin. Ambos os grupos foram mantidos acima de 11 ?M (80 mg/dL).
A média (variação e desvio padrão) dos níveis séricos mínimos de Alfa1Antitripsina (substância ativa) antigênica no estado estacionário, para os pacientes tratados com Alfa1Antitripsina (substância ativa), foi de 17,7 ?M (variação de 13,9 a 23,2, desvio padrão de 2,5) e, para os pacientes tratados com Prolastin, foi de 19,1 ?M (variação de 14,7 a 23,1, desvio padrão de 2,2). A diferença entre os grupos tratados com Alfa1Antitripsina (substância ativa) e com Prolastin não foi considerada clinicamente significativa e pode estar relacionada à maior atividade específica de Alfa1Antitripsina (substância ativa).
Em um subgrupo de pacientes incluídos no estudo (10 pacientes tratados com Alfa1Antitripsina (substância ativa) e 5 pacientes tratados com Prolastin) foi realizada lavagem broncoalveolar no início e na 11a semana. Quatro analitos relacionados à Alfa1Antitripsina (substância ativa) no fluido de revestimento epitelial do pulmão foram medidos: A1AT antigênica, complexos A1AT:elastase neutrofílica, elastase neutrofílica livre e A1AT funcional (capacidade antielastase neutrofílica, CAEN). Uma análise retrospectiva cega, que revisou os critérios de aceitação estabelecidos prospectivamente, demonstrou, que dentro de cada grupo de tratamento, os níveis de A1AT antigênica e complexos A1AT:elastase neutrofílica, do fluido de revestimento epitelial do pulmão, aumentou desde o início até a 11a semana. A elastase livre foi extremamente baixa em todas as amostras.
Os valores da capacidade antielastase neutrofílica pós-tratamento no fluido de revestimento epitelial do pulmão não foram significativamente diferentes entre os pacientes tratados com Alfa1Antitripsina (substância ativa) e com Prolastin (média de 1.725 nM contra 1.418 nM). Não foi possível tirar conclusões sobre as mudanças de valores da capacidade antielastase neutrofílica no fluido de revestimento epitelial do pulmão durante o período de estudo, visto que os valores basais nos pacientes tratados com Alfa1Antitripsina (substância ativa) foram inesperadamente elevados. Nenhum dos analitos da A1AT mostrou qualquer diferença clinicamente significativa entre os grupos tratados com Alfa1Antitripsina (substância ativa) e Prolastin.
Analitos do fluido de revestimento epitelial do pulmão – Alteração do valor basal
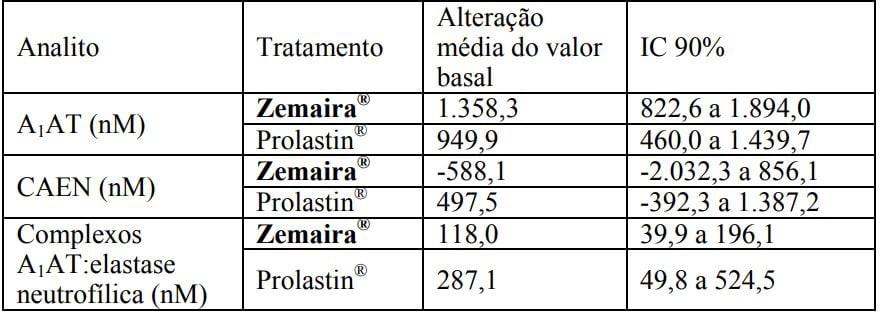
Os pacientes também foram monitorados quanto à presença de anticorpos contra o HIV e marcadores para hepatite viral (HAV, HBV e HCV). Os pacientes que apresentaram resultados negativos para o antígeno de superfície da hepatite B (HBsAg) na triagem foram vacinados contra a Hepatite B. Seis meses após o término do tratamento com Alfa1Antitripsina (substância ativa), foram feitos exames para o HAV, HBV, HCV, HIV e parvovírus B19 nos pacientes tratados e nenhuma evidência de transmissão viral foi observada. Nenhum paciente desenvolveu anticorpos detectáveis contra Alfa1Antitripsina (substância ativa).A eficácia clínica de Alfa1Antitripsina (substância ativa) ou de qualquer outro produto contendo A1AT sobre o curso do enfisema pulmonar ou agravações pulmonares não foi demonstrada em estudos clínicos devidamente controlados e randomizados com grande quantidade de pacientes.
Características Farmacológicas
A deficiência de Alfa1Antitripsina (substância ativa) (A1AT) é uma doença crônica, hereditária, autossômica, codominante, que é geralmente fatal em sua forma grave. Baixos níveis sanguíneos de A1AT (ou seja, abaixo de 11 ?M) são mais comumente associados com enfisema progressivo grave, que se torna clinicamente aparente da terceira até a quarta década de vida.
Além disso, os indivíduos com fenótipo PiSZ, cujos níveis séricos de A1AT variam de, aproximadamente, 9 a 23 ?M, são considerados como tendo risco moderadamente aumentado de desenvolver enfisema, independentemente de seus níveis séricos de A1AT estarem acima ou abaixo de 11 ?M.
Nem todos os indivíduos com variações genéticas graves da deficiência de A1AT apresentam enfisema. A terapia de reposição com Alfa1Antitripsina (substância ativa) (humana) é indicada apenas em pacientes com deficiência congênita de A1AT que apresentam enfisema clinicamente evidente.
Um estudo recente mostrou que 54% dos indivíduos com deficiência de A1AT tinham enfisema. Outro estudo mostrou que 72% dos indivíduos com deficiência de A1AT tinham sintomas pulmonares. O tabagismo é um fator de risco importante para o desenvolvimento de enfisema em pacientes com deficiência de A1AT.
Cerca de 100 variações genéticas da deficiência de A1AT podem ser identificadas através de eletroforese, estando apenas algumas destas variações associadas com a doença clínica. Noventa e cinco por cento dos indivíduos com deficiência de A1AT são do fenótipo PiZZ grave.
Até 39% dos pacientes com deficiência de A1AT podem ter um componente asmático na sua doença pulmonar, evidenciado por sintomas e / ou hiper-reatividade brônquica.
Infecções pulmonares, incluindo pneumonia e bronquite aguda são comuns em pacientes com deficiência de A1AT e contribuem significativamente para a morbidade da doença.
A reposição dos níveis de Alfa1Antitripsina (substância ativa) funcional por infusão intravenosa é uma abordagem terapêutica para os pacientes com deficiência de A1AT. Entretanto, a eficácia da terapia de reposição sobre a progressão do enfisema não foi demonstrada em estudos clínicos randomizados, controlados. O objetivo teórico pretendido é fornecer proteção ao trato respiratório inferior, corrigindo o desequilíbrio entre a elastase neutrofílica e os inibidores de protease.
Não foi avaliado se a terapia de reposição com Alfa1Antitripsina (substância ativa) ou qualquer outro produto contendo A1AT realmente protege o trato respiratório inferior de progressivas alterações enfisematosas.
Os indivíduos com níveis endógenos de A1AT inferiores a 11 ?M, em geral, manifestam um aumento significativo do risco de desenvolvimento de enfisema, acima do risco da população em geral. Embora a manutenção dos níveis séricos de A1AT acima de 11 ?M (medido antigenicamente) tenha sido historicamente postulada para fornecer proteção antielastase neutrofílica terapeuticamente relevante, isso não foi comprovado.
Foi demonstrado que indivíduos com deficiência grave de A1AT apresentam aumento das concentrações de elastase neutrofílica e neutrófilos no fluido de revestimento epitelial do pulmão em comparação com indivíduos normais PiMM, e alguns indivíduos PiSZ com A1AT acima de 11 ?M apresentam enfisema relacionado à deficiência de A1AT. Estas observações reforçam a incerteza quanto ao nível sérico terapêutico adequado de A1AT durante a terapia de reposição.
Propriedades Farmacodinâmicas
A doença pulmonar, particularmente o enfisema, é a manifestação mais frequente da deficiência de Alfa1Antitripsina (substância ativa) (A1AT). Acredita-se que a patogênese do enfisema evolui conforme descrito no modelo de "desequilíbrio entre protease e antiprotease". A Alfa1Antitripsina (substância ativa) é considerada atualmente a principal antiprotease no trato respiratório inferior, onde inibe a elastase neutrofílica (EN). Indivíduos normais saudáveis produzem quantidade de A1AT suficiente para controlar a EN produzida por neutrófilos ativados e são, portanto, capazes de impedir a proteólise inadequada do tecido pulmonar pela EN.
Condições que aumentam o acúmulo de neutrófilos e a ativação no pulmão, tais como infecções respiratórias e tabagismo aumentarão sucessivamente os níveis de EN. No entanto, os indivíduos com deficiência endógena grave de A1AT são incapazes de manter uma defesa antiprotease adequada e, por isso, ficam sujeitos à proteólise mais rápida das paredes dos alvéolos, levando à doença pulmonar crônica. Alfa1Antitripsina (substância ativa) funciona como terapia de reposição da A1AT nesta população de pacientes, agindo para aumentar e manter os níveis de A1AT no soro e no fluido de revestimento epitelial do pulmão.
Propriedades Farmacocinéticas
Em 18 indivíduos tratados com uma dose única de Alfa1Antitripsina (substância ativa) (60 mg/kg), a área média sob a curva (ASC) e o desvio padrão (DP) foram 144 ?M × dia (DP 27), a concentração sérica máxima foi de 44,1 ?M (DP 10,8), a depuração foi de 603 mL por dia (DP 129) e a meia-vida terminal foi de 5,1 dias (DP 2,4).
Infusões semanais repetidas de A1AT, na dose de 60 mg/kg, resultaram em níveis séricos de A1AT acima do valor histórico pretendido mínimo de 11 ?M.
O benefício clínico do aumento nos níveis sanguíneos de A1AT na dose recomendada, para qualquer produto contendo A1AT, não foi estabelecido.
Cuidados de Armazenamento
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO Conservar sob refrigeração (temperatura entre 2 e 8°C) Evitar o congelamento, pois poderá danificar o recipiente para o diluente O prazo de validade é de 36 meses a partir da data de fabricação, quando armazenado conforme recomendado Número de lote e datas de fabricação e validade: vide embalagem Não use medicamento com prazo de validade vencido Guarde-o em sua embalagem original O produto reconstituído deve ser utilizado dentro de 3 horas Zemaira® apresenta-se como um pó liofilizado branco a quase branco Após reconstituição com água para injetáveis, o produto apresenta-se como uma solução transparente, incolor a levemente amarelada Antes de usar, observe o aspecto do medicamento Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo Todo medicamento deve ser mantido fora do alcance das crianças 6
Mensagens de Alerta
Não foram realizados estudos de reprodução animal com Zemaira. Também não se sabe se Zemaira pode causar danos ao feto quando administrado a mulheres grávidas ou se pode afetar a capacidade reprodutiva. Zemaira deve ser administrado a mulheres grávidas somente se claramente necessário. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Dizeres Legais
Ulisses Soares de Jesus - CRF – SP 67.021
informações complementares
| Fabricante |
| CSL BEHRING |
| Princípio ativo |
| Alfa1antitripsina |
| Categoria do medicamento |
| Medicamentos de A-Z |
