Comparamos o preço de Xeljanz 5Mg C 60 Comprimidos, veja o menor preço

R$ 5.798,60
RReferência
15
ofertasMelhores preços a partir de R$ 5.798,60 até R$ 8.115,10
Menor preço
vendido por Farma Visa
economize
28.55%
R$ 5.798,60
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Menor preço
vendido por Life Medicamentos
economize
28.55%
R$ 5.798,60
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Imune Farma Medicamentos Especiais
economize
28.54%
R$ 5.798,70
vendido por Farma Ame
economize
28.54%
R$ 5.798,75
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farma Silva
economize
28.53%
R$ 5.799,90
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
vendido por OncoExpresso Medicamentos
economize
28.53%
R$ 5.800,00
vendido por Facilita Medicamentos
economize
21.75%
R$ 6.350,00
vendido por Fast Medicamentos
economize
20.34%
R$ 6.464,76
vendido por Drogaria Dinâmica
economize
17.73%
R$ 6.676,56
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Agille Speciality
economize
17.39%
R$ 6.703,91
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Agille Medicamentos
economize
17.39%
R$ 6.703,91
Preço Válido para compra em Boleto
vendido por Onco Express Medicamentos Especiais e Oncológicos
economize
15.22%
R$ 6.880,00
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
vendido por Saúde Farma Medicamentos
economize
14.97%
R$ 6.900,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria!
vendido por Oncomg Medicamentos Especiais
economize
6.59%
R$ 7.580,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Oncolog Medicamentos Especiais
R$ 8.115,10
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Xeljanz é indicado para o tratamento de pacientes adultos com artrite reumatoide ativa moderada a grave que apresentaram uma resposta inadequada a um ou mais medicamentos modificadores do curso da doença (DMARDs).
Como Xeljanz funciona?
A artrite reumatoide é uma doença autoimune em que o sistema imunológico produz substâncias inflamatórias chamadas de citocinas. O excesso destas substâncias ataca o tecido saudável resultando em inflamação nas articulações. Xeljanz é um medicamento que age dentro das células inibindo a atividade de enzimas chamadas de JAK quinases. Este mecanismo de ação impede a produção de citocinas específicas resultando em diminuição da resposta inflamatória.
O início da resposta ao medicamento pode ser observado a partir da segunda semana de tratamento.
Contraindicação
Este medicamento é contraindicado a pacientes com hipersensibilidade (alergia) ao Xeljanz ou a qualquer componente da formulação do produto.
Como usar
Xeljanz pode ser usado como monoterapia ou em combinação com metotrexato ou outros DMARDs não biológicos. A dose recomendada é 5 mg administrada duas vezes ao dia.
Procure seu médico imediatamente se desenvolver uma nova infecção antes ou durante o tratamento com Xeljanz. Se você desenvolver uma infecção grave durante o tratamento, este deverá ser descontinuado, sob a orientação do seu médico.
Posologia para Populações Especiais
Ajuste de dose em pacientes com comprometimento renal ou hepático
A dose de Xeljanz deve ser reduzida para 5 mg uma vez ao dia em pacientes:
- Com comprometimento renal moderado ou grave;
- Com comprometimento hepático moderado.
O uso de Xeljanz em pacientes com comprometimento hepático grave não é recomendado.
Idosos
Nenhum ajuste de dose é necessário em pacientes ? 65 anos de idade.
População Pediátrica
A segurança e eficácia de Xeljanz em crianças desde neonatos até <18 anos de idade não foram estabelecidas.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Xeljanz?
Caso você esqueça de tomar Xeljanz no horário estabelecido pelo seu médico, tome-o assim que lembrar.
Entretanto, se já estiver perto do horário de tomar a próxima dose, pule a dose esquecida e tome a próxima, continuando normalmente o esquema de doses recomendado pelo seu médico. Neste caso, não tome o medicamento em dobro para compensar doses esquecidas.
O esquecimento de dose pode comprometer a eficácia do tratamento.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Este medicamento não deve ser partido, aberto ou mastigado.
Precauções
Procure seu médico imediatamente se desenvolver uma nova infecção antes ou durante o tratamento com Xeljanz. Se você desenvolver uma infecção grave durante o tratamento, este deverá ser descontinuado, sob a orientação do seu médico.
A qualquer sinal de infecção (ex.: febre persistente, dor de garganta, hematomas, sangramento, palidez) ou se apresentar histórico médico de tuberculose latente ou ativa, vírus do herpes ou de hepatite, comunique seu médico imediatamente. Ele tomará as providências necessárias.
Existe a possibilidade de que Xeljanz comprometa as defesas do paciente contra malignidades. O impacto do tratamento com Xeljanz sobre o desenvolvimento e curso de malignidades não é conhecido, mas malignidades foram observadas em estudos clínicos.
Recomenda-se ao médico uma avaliação cuidadosa da relação risco/benefício ao prescrever este medicamento a pacientes com doença neurológica degenerativa (ex.: diagnóstico conhecido de esclerose múltipla) preexistente ou de início recente.
Xeljanz deve ser administrado com cautela em pacientes que podem estar em um risco maior de perfuração gastrintestinal (ex.: pacientes com uma história de diverticulite). A qualquer sinal e/ou sintoma de dor abdominal comunique seu médico imediatamente.
Não é recomendado iniciar o tratamento com Xeljanz em pacientes com contagem baixa de linfócitos, recomenda-se ao médico uma avaliação laboratorial cuidadosa antes de iniciar o uso dessa medicação e a cada 3 meses a partir de então.
Foram relatadas quedas na contagem de células que ajudam na defesa do organismo do paciente contra infecções (ex.: neutrófilos) e também na concentração de hemoglobina no sangue. Recomenda-se ao médico uma avaliação laboratorial cuidadosa antes de iniciar o uso dessa medicação, assim como após 4 a 8 semanas e a cada 3 meses.
Foram relatados aumentos na contagem de lipídios tais como colesterol total, LDL-colesterol (lipoproteína de baixa densidade) e HDL-colesterol (lipoproteína de alta densidade). Recomenda-se ao médico uma avaliação laboratorial cuidadosa antes de iniciar o uso dessa medicação, assim como após 4 a 8 semanas.
O tratamento com Xeljanz foi associado com um aumento da incidência de elevação das enzimas do fígado comparado ao placebo. A maioria destas anormalidades ocorreu em estudos com base na terapia com DMARD (primariamente metotrexato). Recomenda-se ao médico uma avaliação laboratorial cuidadosa se houver suspeita de lesão do fígado induzida por medicamento.
O risco de herpes zoster parece ser maior em pacientes japoneses tratados com Xeljanz.
Recomenda-se que vacinas vivas atenuadas não sejam administradas junto com Xeljanz. Recomenda-se que o paciente tenha todas as vacinas atualizadas de acordo com as diretrizes atuais de vacinação antes de iniciar a terapia com Xeljanz.
A dose de Xeljanz deve ser reduzida para 5 mg uma vez ao dia em pacientes com comprometimento renal moderado ou grave (perda da função dos rins).
A dose de Xeljanz deve ser reduzida para 5 mg uma vez ao dia em pacientes com comprometimento hepático moderado (perda da função do fígado). O uso de Xeljanz em pacientes com comprometimento hepático grave não é recomendado.
Reações Adversas
As reações adversas listadas a seguir são apresentadas por categorias de frequência.
Reação Muito Comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento)
Nasofaringite (infecção do nariz e faringe).
Reação Comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento)
- Pneumonia;
- Influenza;
- Herpes zoster;
- Infecção do trato urinário (infecção urinária);
- Sinusite;
- Bronquite;
- Faringite (infecção da faringe);
- Leucopenia (redução de células de defesa no sangue);
- Anemia (diminuição da quantidade de células vermelhas do sangue: hemácias);
- Dislipidemia (alteração do colesterol);
- Hiperlipidemia (aumento da concentração de gorduras no sangue);
- Insônia;
- Cefaleia (dor de cabeça);
- Hipertensão (pressão arterial alta);
- Dispneia (falta de ar);
- Tosse;
- Dor abdominal;
- Vômitos;
- Diarreia;
- Náusea;
- Gastrite;
- Dispepsia (indigestão);
- Erupção cutânea (lesão na pele);
- Dor musculoesquelética (que afeta músculos, tendões ou ligamentos);
- Artralgia (dor nas articulações);
- Pirexia (febre);
- Edema periférico (inchaço nas extremidades do corpo);
- Fadiga (cansaço);
- Aumento de enzimas hepáticas (do fígado);
- Aumento de colesterol no sangue;
- Aumento de peso;
- Aumento de creatina fosfoquinase no sangue.
Reação Incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
- Sepse (infecção geral grave do organismo);
- Tuberculose;
- Pneumonia pneumocócica (causada por pneumococos);
- Pneumonia bacteriana;
- Diverticulite;
- Pielonefrite (infecção do trato urinário);
- Celulite (infecção do tecido gorduroso abaixo da pele);
- Artrite bacteriana;
- Herpes simples;
- Gastrenterite viral (inflamação do estômago e intestino delgado);
- Infecção viral;
- Cânceres de pele não melanoma;
- Linfopenia (redução de um tipo de célula de defesa no sangue: linfócito);
- Neutropenia (diminuição de um tipo de células de defesa no sangue: neutrófilos);
- Desidratação;
- Parestesia (dormência e formigamento);
- Congestão sinusal (congestão dos seios da face);
- Esteatose hepática (acúmulo de gordura no fígado);
- Eritema (vermelhidão);
- Prurido (coceira);
- Inchaço articular (nas articulações);
- Tendinite (inflamação dos tendões);
- Aumento de transaminases;
- Teste de função hepática (do fígado) anormal;
- Aumento de gama glutamiltransferase;
- Aumento de creatinina no sangue;
- Aumento do LDL-colesterol (lipoproteína de baixa densidade);
- Distensão (estiramento) de ligamento;
- Distensão muscular.
Reação Rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
- Tuberculose do sistema nervoso central;
- Meningite (infecção das meninges, membrana que envolve o cérebro e a medula) criptocócica;
- Urosepse (infecção geral grave do organismo a partir de um foco urinário);
- Tuberculose disseminada;
- Fasciite necrosante (infecção destrutiva das camadas profundas da pele);
- Bacteremia (infecção do sangue);
- Bacteremia estafilocócica (infecção do sangue causada por estafilococos);
- Pneumonia por Pneumocystis jiroveci;
- Encefalite (inflamação aguda do cérebro);
- Infecção micobacteriana atípica;
- Infecção pelo complexo Mycobacterium avium;
- Infecção por citomegalovírus.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
População Especial
Capacidade de dirigir veículos e operar máquinas
Não foram realizados estudos dos efeitos do uso de Xeljanz sobre a capacidade de dirigir veículos e operar máquinas.
Gravidez
Xeljanz não deve ser utilizado durante a gravidez e amamentação, exceto sob orientação médica. Informe o seu médico ou cirurgião-dentista se ocorrer gravidez ou iniciar amamentação durante o uso deste medicamento.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Intolerantes
Este medicamento contém lactose.
Composição
Cada comprimido revestido de Xeljanz contém 8,078 mg de citrato de tofacitinibe equivalente a 5 mg de tofacitinibe.
Excipientes: celulose microcristalina, lactose monoidratada, croscarmelose sódica, estearato de magnésio e Opadry II branco (hipromelose, dióxido de titânio, lactose monoidratada, macrogol, triacetina).
Superdosagem
Não há experiência com superdose de Xeljanz.
Não há um antídoto específico para superdose com Xeljanz. O tratamento deve ser sintomático e de suporte.
Em caso de uma superdose, é recomendado que o paciente seja monitorado quanto a sinais e sintomas de reações adversas. Pacientes que desenvolverem reações adversas devem receber tratamento apropriado.
Dados de farmacocinética até uma dose única de 100 mg, inclusive, em voluntários saudáveis indicam que é esperado que mais de 95% da dose administrada sejam eliminados dentro de 24 horas.
Em caso de intoxicação ligue para 08007226001, se você precisar de mais orientações.
Interação Medicamentosa
Interações que afetam o uso de Citrato do citrato de tofacitinibe (substância ativa)
Uma vez que o citrato do citrato de tofacitinibe (substância ativa) (substância ativa) é metabolizado pela CYP3A4, a interação com fármacos que inibem ou induzem a CYP3A4 é provável. A exposição ao citrato do citrato de tofacitinibe (substância ativa) (substância ativa) é aumentada quando coadministrado com inibidores potentes de citocromo P450 (CYP) 3A4 (por exemplo, cetoconazol) ou quando a administração de uma ou mais medicações concomitantes resulta tanto na inibição moderada da CYP3A4 quanto na inibição potente da CYP2C19 (por exemplo, fluconazol).
A exposição ao tofacitinibe citrato do citrato de tofacitinibe (substância ativa) (substância ativa) é diminuída quando coadministrado com potentes indutores da CYP (por exemplo, rifampicina). É improvável que inibidores da CYP2C19 isoladamente ou glicoproteína P alterem a farmacocinética do citrato de tofacitinibe (substância ativa) de forma significativa.
A administração concomitante com metotrexato (15-25 mg de MTX uma vez por semana) não teve qualquer efeito sobre a farmacocinética do citrato de tofacitinibe (substância ativa).
A coadministração de cetoconazol, um forte inibidor da CYP3A4, com uma dose única do citrato do citrato de tofacitinibe (substância ativa) (substância ativa) aumentou a AUC e a Cmáx em 103% e 16%, respectivamente.
A coadministração de fluconazol, um inibidor moderado da CYP3A4 e um forte inibidor da CYP2C19, aumentou a AUC e a Cmáx do citrato do citrato de tofacitinibe (substância ativa) (substância ativa) em 79% e 27%, respectivamente.
A coadministração de tacrolimo, um inibidor leve da CYP3A4, aumentou a AUC do citrato de tofacitinibe (substância ativa) em 21% e diminuiu a Cmáx do citrato do citrato de tofacitinibe (substância ativa) em 9%.
A coadministração de ciclosporina A, um inibidor moderado da CYP3A4, aumentou a AUC do citrato de tofacitinibe (substância ativa) em 73% e diminuiu a Cmáx do citrato de tofacitinibe (substância ativa) em 17%.
O uso combinado do citrato de tofacitinibe (substância ativa) em múltiplas doses com esses potentes imunossupressores não foi estudado em pacientes com artrite reumatoide. A coadministração de rifampicina, uma forte indutora da CYP3A4, diminuiu a AUC e a Cmáx do citrato de tofacitinibe (substância ativa) em 84% e 74%, respectivamente.
Potencial de citrato de tofacitinibe (substância ativa) para influenciar a farmacocinética de outros fármacos
Estudos in vitro indicam que o tofacitinibe não inibe ou induz significativamente a atividade das principais CYPs humanas que metabolizam fármacos (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, e CYP3A4) em concentrações que excedem 160 e 268 vezes as respectivas Cmáx em estado de equilíbrio total e livre da dose de 5 mg duas vezes ao dia em pacientes com artrite reumatoide.
Esses resultados in vitro foram confirmados por um estudo de interação medicamentosa em humanos que não mostrou quaisquer alterações na farmacocinética de midazolam, um substrato altamente sensível da CYP3A4, quando coadministrado com o tofacitinibe.
Dados in vitro indicam que o potencial do citrato de tofacitinibe (substância ativa) em inibir transportadores como a glicoproteína P, polipeptídeo transportador de ânion orgânico, transportadores de ânions ou cátions orgânicos em concentrações terapêuticas também é baixo.
A coadministração do citrato de tofacitinibe (substância ativa) não teve um efeito sobre a farmacocinética de contraceptivos orais, levonorgestrel e etinilestradiol, em voluntárias saudáveis do sexo feminino.
A coadministração do citrato de tofacitinibe (substância ativa) com 15-25 mg de metotrexato uma vez por semana diminuiu a AUC e a Cmáx do metotrexato em 10% e 13%, respectivamente. A extensão da redução na exposição ao metotrexato não justifica modificações na dosagem individualizada de metotrexato.
A coadministração de citrato do citrato de tofacitinibe (substância ativa) não teve um efeito sobre a farmacocinética de metformina, indicando que o tofacitinibe não interfere no transportador catiônico orgânico (OCT2) em voluntários saudáveis.
Em pacientes com artrite reumatoide, o clearance oral do citrato de tofacitinibe (substância ativa) não varia com o tempo, indicando que tofacitinibe não normaliza a atividade da enzima CYP em pacientes com artrite reumatoide. Portanto, não se espera que a administração concomitante com tofacitinibe resulte em aumentos clinicamente relevantes no metabolismo de substratos da CYP em pacientes com artrite reumatoide.
Ação da Substância
Resultados da eficácia
Eficácia Clínica
A eficácia e segurança do citrato de tofacitinibe (substância ativa) foram avaliadas em seis estudos randomizados, duplo-cegos, multicêntricos controlados em pacientes >18 anos com artrite reumatoide ativa diagnosticada segundo os critérios do American College of Rheumatology (Colégio Americano de Reumatologia) (ACR).
Os pacientes tinham pelo menos 6 articulações dolorosas e 6 articulações edemaciadas (4 articulações edemaciadas e dolorosas para o Estudo II).
O citrato de tofacitinibe (substância ativa), 5 ou 10 mg duas vezes ao dia, foi administrado como monoterapia (Estudo I) e em combinação com DMARDs (Estudo II) em pacientes com uma resposta inadequada a esses fármacos, e em combinação com metotrexato (MTX) em pacientes com uma resposta inadequada ao MTX (Estudo III e Estudo IV) ou eficácia inadequada ou ausência de tolerância a pelo menos um agente biológico inibidor de fator de necrose tumoral (TNF) aprovado (Estudo V).
O Estudo I foi um estudo de monoterapia de 6 meses no qual 610 pacientes com artrite reumatoide ativa moderada a grave, que apresentaram uma resposta inadequada a um DMARD (não biológico ou biológico), receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia ou placebo.
Na visita do Mês 3, todos os pacientes randomizados para o tratamento com placebo foram avançados de forma cega a um segundo tratamento pré-determinado de 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia.
Os objetivos primários no Mês 3 foram a proporção de pacientes que atingiram uma resposta ACR20, alterações no Questionário de Avaliação de Saúde - Índice de Incapacidade (HAQ-DI) e escore de Atividade da Doença DAS28-4(VHS) <2,6.
O Estudo II foi um estudo de 12 meses no qual 792 pacientes com artrite reumatoide ativa moderada a grave, que apresentaram uma resposta inadequada a um DMARD não biológico, receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia ou placebo adicionado ao tratamento com DMARD de base (excluindo tratamentos com imunossupressores potentes tais como azatioprina ou ciclosporina).
Na visita do Mês 3, todos os pacientes não responsivos randomizados para o tratamento com placebo foram avançados de forma cega a um segundo tratamento pré-determinado de 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia.
No final do Mês 6, todos os pacientes com placebo foram avançados de forma cega a seu segundo tratamento pré-determinado. Os objetivos primários foram a proporção de pacientes que atingiram uma resposta ACR20 no Mês 6, alterações no HAQ-DI no Mês 3, e DAS28-4(VHS) <2,6 no Mês 6.
O Estudo III foi um estudo de 12 meses no qual 717 pacientes com artrite reumatoide ativa moderada a grave, que apresentaram uma resposta inadequada ao MTX. Os pacientes receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia, 40 mg de adalimumabe por via subcutânea em semanas alternadas, ou placebo adicionado ao MTX de base.
Pacientes com placebo foram avançados como no Estudo II. Os objetivos primários foram a proporção de pacientes que atingiram uma resposta ACR20 no Mês 6, HAQ-DI no Mês 3, e DAS28- 4(VHS) <2,6 no Mês 6.
O Estudo IV foi um estudo de 2 anos com uma análise planejada em 1 ano no qual 797 pacientes com artrite reumatoide ativa moderada a grave, que apresentaram uma resposta inadequada ao MTX receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia ou placebo associados ao MTX de base. Pacientes com placebo foram avançados como no Estudo II.
Os objetivos primários foram a proporção de pacientes que atingiram uma resposta ACR20 no Mês 6, alteração média desde a visita basal no escore Sharp total modificado por van der Heijde (mTSS) no Mês 6, HAQ-DI no Mês 3, e DAS28-4(VHS) <2,6 no Mês 6.
O Estudo V foi um estudo de 6 meses no qual 399 pacientes com artrite reumatoide ativa moderada a grave, que apresentaram uma resposta inadequada a pelo menos um agente biológico inibidor de TNF aprovado, receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia ou placebo adicionado ao MTX de base.
Na visita do Mês 3, todos os pacientes randomizados para o tratamento com placebo foram avançados de forma cega a um segundo tratamento pré-determinado de 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia.
Os objetivos primários no Mês 3 foram a proporção de pacientes que atingiram uma resposta ACR20, HAQ-DI, e DAS28- 4(VHS) <2,6.
O Estudo VI foi um estudo de monoterapia de 2 anos com análise planejada em 1 ano, na qual 952 pacientes com artrite reumatoide ativa moderada a grave não tratados previamente com metotrexato receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia ou dose titulada de 10 mg a 20 mg semanal de metotrexato por mais de 8 semanas.
Os objetivos primários foram alteração média desde a visita basal no escore Sharp total modificado por van der Heijde (mTSS) no Mês 6 e a proporção de pacientes que atingiram uma resposta ACR70 no Mês 6.
Resposta Clínica
Resposta ACR
As porcentagens de pacientes tratados com citrato de tofacitinibe (substância ativa) que atingiram respostas ACR20, ACR50 e ACR70 nos Estudos I, II, IV, V e VI são demonstradas na Tabela 1. Em todos os estudos, pacientes tratados com 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia apresentaram taxas de resposta ACR20, ACR50 e ACR70 estatisticamente significativas no Mês 3 e no Mês 6 em relação a pacientes tratados com placebo (ou vs. MTX no Estudo VI).
No Estudo IV, as taxas de resposta ACR20/50/70 no Mês 12 foram mantidas até o Mês 24.
No Estudo VI (Tabela 4), a diferença em relação ao MTX nos dois grupos de tofacitinibe, na obtenção das taxas de resposta ACR20, ACR50 e ACR70, foi estatisticamente significativa em todos os pontos de tempo (p?0,0001).
O Cloridrato de tofacitinibe, administrado como monoterapia em pacientes não tratados previamente com MTX, aumentou significativamente os sintomas e sinais de artrite reumatoide (AR) em comparação ao MTX. A eficácia observada com o tofacitinibe foi mantida até o Mês 24.
Nos Estudos I, II e V, a melhora na taxa de resposta ACR20 em relação ao placebo foi observada dentro de 2 semanas.
Durante as fases controladas de 3 meses (estudos I e V) e de 6 meses (estudos II, III e IV) dos estudos, pacientes tratados com citrato de tofacitinibe (substância ativa) a uma dose de 10 mg duas vezes ao dia geralmente apresentaram taxas de resposta mais altas em comparação com pacientes tratados com 5 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia.
No Estudo III, os objetivos primários foram as proporções de pacientes que atingiram resposta ACR20 no Mês 6; alteração no HAQ-DI no Mês 3, e DAS28-4(VHS) <2,6 no Mês 6. Os valores para estes desfechos primários dados foram 51,5, 52,6, 47,2 e 28,3%; -0,55, -0,61, -0,49; e -0,24; e 6,2%, 12,5, 6,7% e 1,1% para os grupos de 5 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia, 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia, 40 mg de adalimumabe por via subcutânea em semanas alternadas e placebo, respectivamente.
Para um objetivo secundário pré-especificado, as taxas de resposta ACR70 no mês 6 para os grupos de 5 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia e 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia foram significativamente maiores do que para adalimumabe 19,9%, 21,9% e 9,1%, respectivamente.
O efeito do tratamento foi semelhante em pacientes independente da condição do fator reumatoide, da idade, do gênero, da etnia, ou condição da doença.
O tempo de início foi rápido (logo na Semana 2 nos Estudos I, II e V) e a magnitude da resposta continuou a melhorar com a duração do tratamento. Assim como a resposta ACR geral em pacientes tratados com 5 mg ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia, cada um dos componentes da resposta ACR melhorou consistentemente desde a visita basal, incluindo: contagens de articulações dolorosas e edemaciadas; avaliações globais do paciente e do médico; pontuações no índice de incapacidade; avaliação de dor e Proteína C Reativa (PCR) em comparação com pacientes que receberam placebo mais MTX ou outro DMARD em todos os estudos.
Resposta DAS28- 4 (VHS)
Os pacientes nos estudos fase 3 apresentaram uma média no escore de atividade da doença (DAS28-4 [VHS]) de 6,1–6,7 na visita basal. Reduções significativas no DAS28-4(VHS) a partir da visita basal (melhora média) de 1,8-2,0 e 1,9-2,2 foram observadas nos pacientes tratados com 5 mg e 10 mg de citrato de tofacitinibe (substância ativa), respectivamente, em comparação com pacientes tratados com placebo (0,7-1,1) em 3 Meses.
A proporção de pacientes que atingiu remissão clínica segundo DAS28 (DAS28-4(VHS) <2,6) nos Estudos II, III e IV foi significativamente maior em pacientes que receberam 5 mg ou 10 mg de citrato de tofacitinibe (substância ativa) (6–9% e 13-16%, respectivamente) em comparação com 1–3% de pacientes com placebo em 6 Meses. No Estudo III, as porcentagens de pacientes que atingiram DAS28-4(VHS) <2,6 observadas para citrato de tofacitinibe (substância ativa) 5 mg duas vezes ao dia, 10 mg duas vezes ao dia, e adalimumabe duas vezes ao dia no Mês 6 foram de 6,2%, 12,5% e 6,7%, respectivamente.
Em uma análise agrupada dos estudos Fase 3, a dose de 10 mg duas vezes ao dia apresentou benefício aumentado em relação à dose de 5 mg duas vezes ao dia em múltiplas avaliações de sinais e sintomas: melhora desde a visita basal (taxas de respostas ACR20, ACR50, e ACR70), e obtenção de atividade de doença desejável (DAS28-4(VHS) menor do que 2,6 ou menor ou igual a 3,2). Maiores benefícios de 10 mg versus 5 mg foram demonstrados nas medidas mais rigorosas (ou seja, taxas de resposta ACR70 e DAS28-4 (VHS) <2,6).
Tabela 1: Proporção de Pacientes com uma Resposta ACR
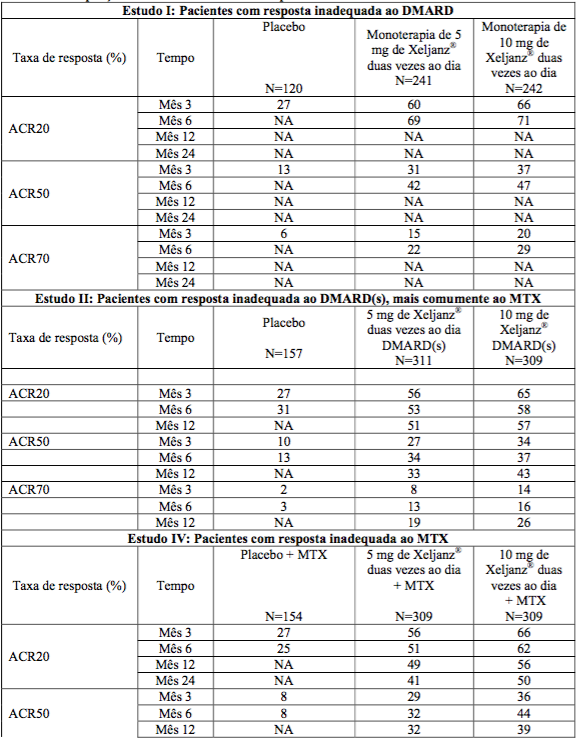
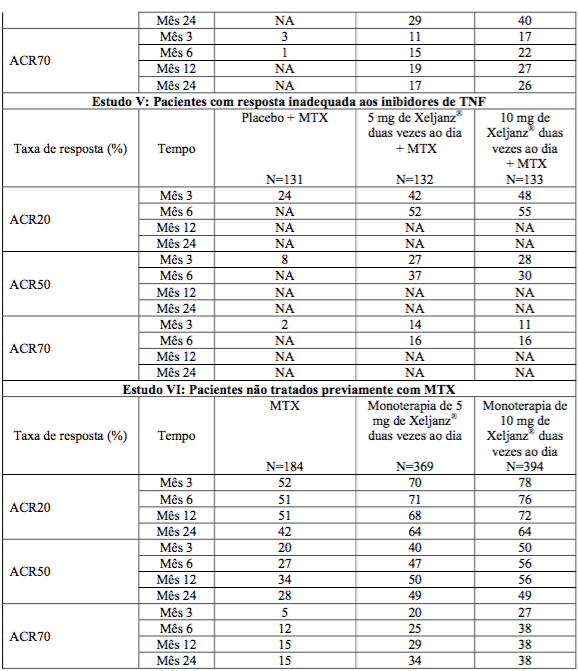
Os resultados da proporção de pacientes com uma resposta ACR para os Estudos I, II, IV, V e VI são demonstrados na Tabela 1. Resultados similares foram observados no Estudo III.
Os resultados dos componentes dos critérios de resposta ACR para os Estudos IV e V são demonstrados na Tabela 2. Resultados semelhantes foram observados nos Estudos I, II e III.
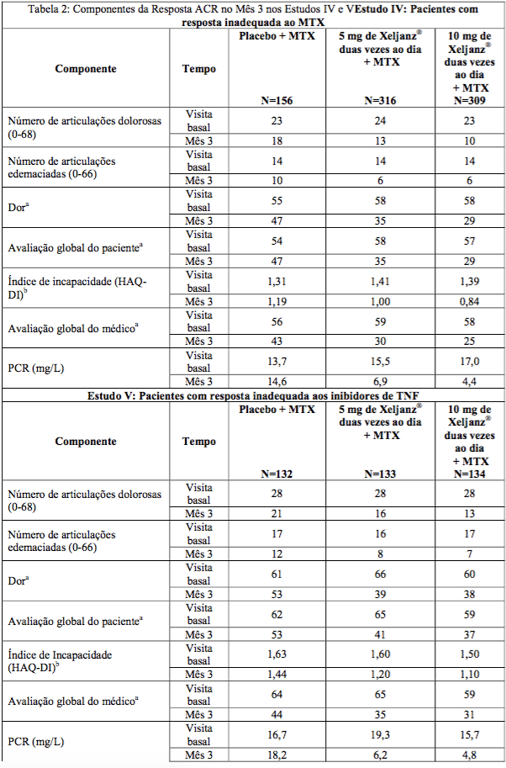
a. Escala visual analógica: 0 = melhor, 100 = pior.
b. Questionário de Avaliação de Saúde – Índice de Incapacidade: 0 = melhor, 3 = pior; 20 perguntas; categorias: vestir-se e cuidados pessoais, levantar, comer, caminhar, higiene, alcançar, agarrar e atividades.
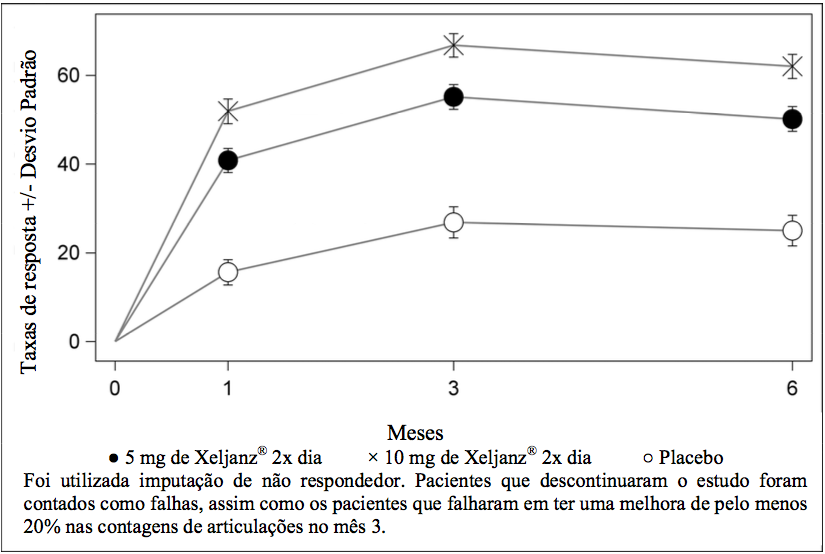
O percentual de respondedores a ACR20 por visita para o Estudo IV é mostrado na Figura 1. Respostas semelhantes foram observadas nos Estudos I, II, III e V.
Figura 1: Porcentagem de Respondedores a ACR20 por Visita para o Estudo IV
Resposta Radiográfica
Dois estudos foram conduzidos para avaliar o efeito de citrato de tofacitinibe (substância ativa) no dano estrutural articular.
No Estudo IV e no Estudo VI, a inibição da progressão do dano estrutural articular foi avaliada radiograficamente e expressa como uma alteração média desde a visita basal em mTSS e seus componentes, o escore de erosão e o escore de estreitamento do espaço articular (EEA) em 6 e 12 meses. A proporção de pacientes sem progressão radiográfica (alteração mTSS menor ou igual que 0,5) também foi avaliada.
No Estudo IV, o citrato de tofacitinibe (substância ativa) 10 mg administrado duas vezes ao dia associado ao MTX de base, resultou em inibição significativamente maior da progressão do dano estrutural em comparação ao placebo mais MTX em 6 e 12 meses. Quando administrado em uma dose de 5 mg duas vezes ao dia, o citrato de tofacitinibe (substância ativa) mais o MTX exibiu efeitos semelhantes sobre a progressão média do dano estrutural (não estatisticamente significativo). As análises do escore de erosão e do escore de EEA foram consistentes com os resultados totais. Estes resultados estão apresentados na Tabela 3.
No grupo placebo mais MTX, 78% dos pacientes não experimentaram progressão radiográfica no Mês 6 comparado a 89% e 87% dos pacientes tratados com 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia, respectivamente, além de MTX, ambos significativos vs. placebo mais MTX.
Tabela 3: Alterações Radiográficas nos Meses 6 e 12
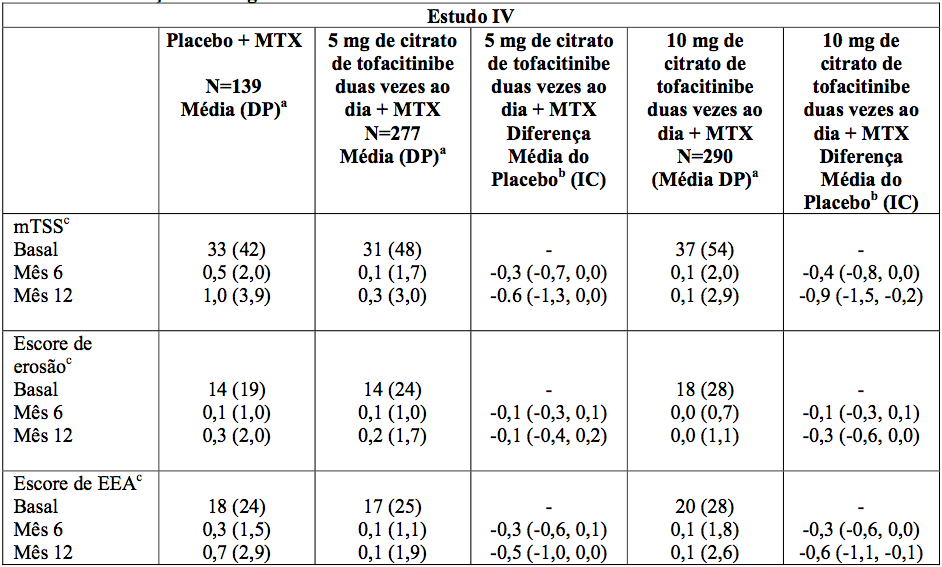
aDP = Desvio Padrão.
bDiferença entre as médias dos quadrados mínimos de citrato de tofacitinibe (substância ativa) menos placebo (IC de 95% = intervalo de confiança de 95%).
cDados do Mês 6 e Mês 12 são alterações médias de base.
No estudo VI, a monoterapia do citrato de tofacitinibe (substância ativa) resultou na inibição significativamente maior da progressão do dano estrutural comparado ao MTX nos Meses 6 e 12 como mostrado na Tabela 4, que também foi mantida até o Mês 24.
As análises do escore de erosão e do escore de EEA foram consistentes com os resultados totais.
No grupo de MTX, 70% dos pacientes não experimentaram progressão radiográfica no Mês 6 comparado a 84% e 90% dos pacientes tratados com 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia, respectivamente, ambos significativos vs. MTX.
Tabela 4: Alterações Radiográficas nos Meses 6 e 12
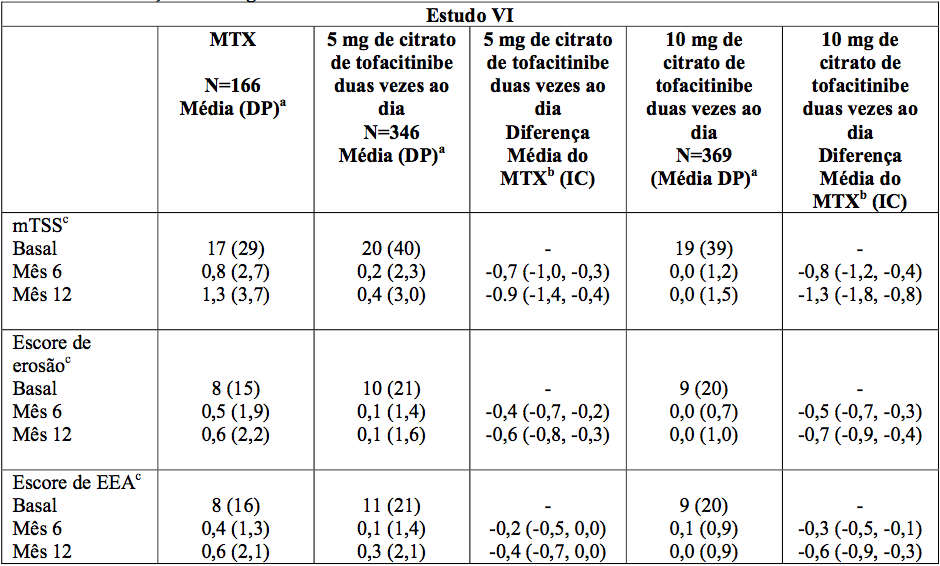
aDP = Desvio Padrão.
bDiferença entre as médias dos quadrados mínimos de citrato de tofacitinibe (substância ativa) menos MTX (IC de 95% = intervalo de confiança de 95%).
cDados do Mês 6 e Mês 12 são alterações médias de base.
Resposta da Função Física e Desfechos Relacionados à Saúde
A melhora na função física foi medida pelo HAQ-DI. Os pacientes que receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia demonstraram melhora significativamente maior desde a visita basal na função física em comparação com placebo no Mês 3 (Estudos I, II, III e V) e Mês 6 (Estudos II e III).
Pacientes tratados com 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia exibiram melhora significativamente maior na função física em comparação com placebo tão cedo quanto a Semana 2 nos Estudos I e II. No Estudo III, melhoras médias no HAQ-DI foram mantidas até 12 meses em pacientes tratados com citrato de tofacitinibe (substância ativa).
Melhoras médias no HAQ-DI foram mantidas por 36 meses nos estudos de extensão abertos em andamento. Em comparação com pacientes tratados com adalimumabe, no Mês 3, os pacientes no grupo de 5 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia apresentaram reduções semelhantes a partir da visita basal nos valores do HAQ-DI e os pacientes no grupo de 10 mg duas vezes ao dia apresentaram reduções significativamente maiores no HAQ- DI. A alteração média no HAQ-DI de base até o Mês 3 nos Estudos I a VI é demonstrada na Tabela 5.
Tabela 5: Alterações médias de base no HAQ-DI
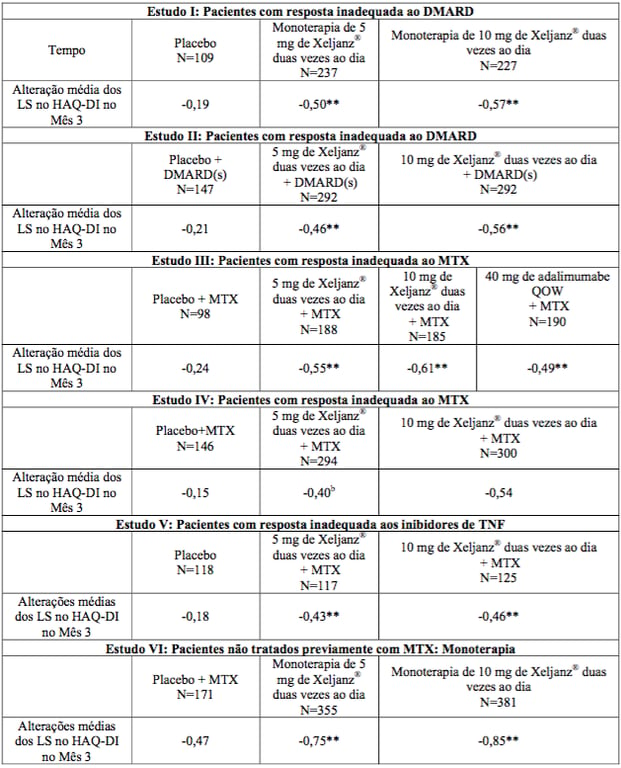
a Ponto de tempo de eficácia primária.
b A significância estatística pode não ter sido declarada no Estudo IV em razão de um processo de descendência.
** p<0,0001, citrato de tofacitinibe (substância ativa) vs. placebo + MTX/DMARD.
Os resultados são obtidos a partir de um modelo linear longitudinal com alteração a partir da base como uma variável dependente e tratamento, base, visita, região como efeitos fixos e paciente como efeito aleatório.
CI = intervalo de confiança, FAS = conjunto completo de análises, LS = mínimos quadrados, N = número de pacientes, MTX = metotrexato, QOW = a cada quinze dias, HAQ-DI = Questionário de Avaliação de Saúde - Índice de Incapacidade
A qualidade de vida relacionada à saúde foi avaliada pelo Questionário (SF-36) em todos os 5 estudos.
Nesses estudos, os pacientes que receberam 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia demonstraram melhora significativamente maior desde a visita basal em comparação com placebo em todos os 8 domínios do SF-36 assim como no Resumo dos Componentes Físico (RCF) e no Resumo do Componentes Mentais (RCM) no mês 3. Os dois grupos tratados com citrato de tofacitinibe (substância ativa) exibiram melhora significativamente maior desde a visita basal em comparação com placebo em todos os 8 domínios assim como no RCF e RCM no Mês 3 nos Estudos I, IV, e V. Nos Estudos III e IV, melhoras médias no SF-36 foram mantidas até 12 meses em pacientes tratados com citrato de tofacitinibe (substância ativa).
A melhora na fadiga foi avaliada pelo questionário FACIT-F (Functional Assessment of Chronic Illness Therapy-Fatigue) no mês 3 em todos os estudos. Pacientes que receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia demonstraram melhora significativamente maior na fadiga desde a visita basal em comparação com placebo em todos os 5 estudos. Nos Estudos III e IV, melhoras médias no FACIT-F foram mantidas até 12 meses em pacientes tratados com citrato de tofacitinibe (substância ativa).
A melhora no sono foi avaliada usando as escalas resumidas do Índice de Problemas no Sono I e II do questionário MOS-Sleep (Medical Outcomes Study Sleep) no Mês 3 em todos os estudos.
Pacientes que receberam 5 ou 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia demonstraram melhora significativamente maior desde a visita basal nas duas escalas em comparação com placebo nos Estudos II, III e IV. Nos Estudos III e IV, melhoras médias nas duas escalas foram mantidas até 12 meses em pacientes tratados com citrato de tofacitinibe (substância ativa).
A melhora na produtividade foi avaliada usando o Questionário de Limitações no Trabalho (WQL – Work Limitations Questionnaire) no Mês 3 em todos os estudos.
Os pacientes que receberam 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia demonstraram melhora significativamente maior desde a visita basal na Escala Resumida de Produtividade Geral em comparação com placebo nos estudos III, IV e V.
Nos estudos III e IV, melhoras médias na Produtividade Geral foram mantidas até 12 meses em pacientes tratados com 10 mg de citrato de tofacitinibe (substância ativa) duas vezes ao dia.
Durabilidade das respostas clínicas
A durabilidade do efeito foi avaliada pelas taxas de respostas ACR20, ACR50, ACR70, média HAQ-DI médio e DAS28-4 (VHS) médio nos três estudos de Fase 3 DMARD IR com a duração de pelo menos um ano. A eficácia foi mantida em todos os grupos de tratamento com tofacitinibe até o final dos estudos. A evidência da persistência da eficácia com o tratamento de tofacitinibe por até 7 anos também é fornecida a partir dos dados de um estudo em andamento e outro concluído de acompanhamento em longo prazo e aberto.
Características Farmacológicas
Propriedades Farmacodinâmicas
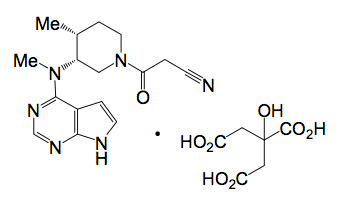
O citrato de tofacitinibe (substância ativa) (CP-690,550-10) possui um peso molecular de 504,5 Daltons ou 312,4 Daltons para base livre de tofacitinibe CP 690,550. A fórmula molecular do citrato de tofacitinibe (substância ativa) é C16H20N6O•C6H8O7 e sua estrutura química é fornecida abaixo.
Mecanismo de Ação
O tofacitinibe é um potente inibidor seletivo da família das JAK quinases com um alto grau de seletividade contra outras quinases no genoma humano. Em ensaios com quinases, tofacitinibe inibe JAK1, JAK2, JAK3, e em um grau menor, TyK2.
Em contextos celulares nos quais as quinases JAK sinalizam em pares, o tofacitinibe inibe, preferencialmente, sinalizando por receptores heterodiméricos associados a JAK3 e/ou JAK1 com seletividade funcional em relação a receptores que sinalizam por meio de pares de JAK2.
A inibição de JAK1 e JAK3 por tofacitinibe bloqueia a sinalização por meio dos receptores que contêm cadeia gama comum para diversas citocinas, incluindo a IL-2, -4,-7,-9, -15, e -21. Essas citocinas são essenciais para a ativação, proliferação e função de linfócitos e a inibição de sua sinalização pode, dessa forma, resultar na modulação de múltiplos aspectos da resposta imunológica.
Além disso, a inibição de JAK1 resultará na atenuação da sinalização por citocinas pró-inflamatórias adicionais, tais como IL-6 e interferons Tipo I.
Em exposições maiores, a inibição da sinalização de eritropoietina poderia ocorrer por meio da inibição da sinalização da JAK2.
Efeito Farmacodinâmico
Em pacientes com artrite reumatoide, o tratamento de até 6 meses com citrato de tofacitinibe (substância ativa) foi associado a reduções dose-dependentes de células natural killer (NK) circulantes CD16/56+, com reduções máximas estimadas ocorrendo aproximadamente 8-10 semanas após o início da terapia. Essas alterações geralmente se resolveram dentro de 2-6 semanas após a descontinuação do tratamento.
O tratamento com citrato de tofacitinibe (substância ativa) foi associado a aumentos dose-dependentes nas contagens de células B. Alterações nas contagens de linfócitos T circulantes e subtipos de linfócitos T (CD3+, CD4+ e CD8+) foram pequenas e inconsistentes.
Seguindo o tratamento em longo prazo (duração mediana do tratamento de citrato de tofacitinibe (substância ativa) de aproximadamente 5 anos), as contagens do CD4+ e do CD8+ demostraram reduções medianas de 28% e 27%, respectivamente, a partir da linha de base. Em contraste com a diminuição observada após a dosagem de curto prazo, as contagens de células natural killer CD16/56+ mostraram um aumento médio de 73% a partir da base. As contagens das células CD19+ B não mostraram aumentos adicionais após o tratamento com o citrato de tofacitinibe (substância ativa) em longo prazo.
Essas alterações voltaram para a linha de base após a descontinuação temporária do tratamento. Não houve evidência de um risco aumentado de infecções sérias ou oportunistas ou herpes zoster em valores baixos de contagens de CD4+, CD8+ ou células NK ou contagens de células B altas.
As alterações nos níveis séricos totais de IgG, IgM e IgA ao longo de 6 meses de administração de citrato de tofacitinibe (substância ativa) em pacientes com artrite reumatoide foram pequenas, não dependentes de dose e semelhantes àquelas observadas com placebo.
Após o tratamento com citrato de tofacitinibe (substância ativa) em pacientes com artrite reumatoide, reduções rápidas na proteína C reativa (PCR) sérica foram observadas e mantidas durante a administração. As alterações na PCR observadas com o tratamento com citrato de tofacitinibe (substância ativa) não se reverteram completamente dentro de 2 semanas após a descontinuação, indicando uma duração da atividade farmacodinâmica mais longa em comparação com a meia-vida.
Propriedades farmacocinéticas
O perfil farmacocinético de citrato de tofacitinibe (substância ativa) é caracterizado pela rápida absorção (as concentrações plasmáticas de pico são atingidas dentro de 0,5-1 hora), eliminação rápida (meia-vida de aproximadamente 3 horas) e aumentos proporcionais à dose na exposição sistêmica.
As concentrações em estado de equilíbrio são atingidas em 24-48 horas com acúmulo desprezível após a administração duas vezes ao dia.
Absorção e Distribuição
O citrato tofacitinibe é bem absorvido, com uma biodisponibilidade oral de 74%. A coadministração de citrato de tofacitinibe (substância ativa) com uma refeição com alto teor de gordura não resultou em quaisquer alterações na AUC enquanto a Cmáx foi reduzida em 32%.
Em estudos clínicos, o tofacitinibe foi administrado sem considerar as refeições.
Após a administração intravenosa, o volume de distribuição é de 87 L. Aproximadamente 40% do citrato de tofacitinibe (substância ativa) circulante está ligado a proteínas.
O citrato tofacitinibe liga-se predominantemente à albumina e não parece se ligar à 1-glicoproteína ácida.
O citratode tofacitinibe é distribuído igualmente entre as hemácias e o plasma.
Metabolismo e Eliminação
Os mecanismos de clearance para o tofacitinibe são aproximadamente 70% de metabolismo hepático e 30% de excreção renal do fármaco original. O metabolismo de tofacitinibe é primariamente mediado pela CYP3A4 com contribuição secundária da CYP2C19. Em um estudo de radiomarcação em humanos, mais de 65% da radioatividade circulante total correspondeu ao fármaco inalterado, com os 35% restantes atribuídos a 8 metabólitos, cada um contabilizando menos de 8% da radioatividade total.
Todos os metabólitos foram observados em espécies animais e são preditivos para ter ?10% de potência de tofacitinibe para inibição JAK1/3. Nenhuma evidência de estereoconversão foi detectada em amostras humanas. A atividade farmacológica de tofacitinibe é atribuída à molécula original.
Os dados farmacocinéticos e as recomendações de dosagem para populações especiais assim como o impacto de outras drogas na farmacocinética de tofacitinibe são demonstrados na Figura 2.
Farmacocinética em Pacientes com Artrite Reumatoide
A análise farmacocinética da população em pacientes com artrite reumatoide indicou que a exposição sistêmica (AUC) de tofacitinibe nos extremos de peso corporal (40 kg, 140 kg) foi semelhante a de um paciente de 70 kg. Foi estimado que pacientes idosos com 80 anos de idade apresentam AUC <5% mais alta em relação à idade média de 55 anos. Estima-se que as mulheres tenham uma AUC 7% mais baixa em comparação com homens. Os dados disponíveis também mostraram que não há maiores diferenças na AUC de tofacitinibe entre pacientes caucasianos, negros e asiáticos.
Uma relação linear aproximada entre peso corporal e volume de distribuição foi observada, resultando em concentrações de pico mais altas (Cmáx) e de vale mais baixas (Cmín) em pacientes mais leves. Entretanto, esta diferença não é considerada como sendo clinicamente relevante.
A variabilidade entre pacientes (coeficiente de variação de percentagem) na AUC de citrato de tofacitinibe (substância ativa) é estimada como sendo de aproximadamente 27%.
Insuficiência Renal
Pacientes com insuficiência renal leve, moderada e grave tiveram AUC 37%, 43% e 123% mais alta, respectivamente, em comparação com pacientes saudáveis. Em pacientes com doença renal terminal, a contribuição da diálise ao clearance total de tofacitinibe foi relativamente pequena.
Insuficiência Hepática
Pacientes com insuficiência hepática leve e moderada tiveram AUC 3% e 65% mais alta, respectivamente, em comparação com pacientes saudáveis. Pacientes com insuficiência hepática grave não foram estudados.
População Pediátrica
A farmacocinética, segurança e eficácia de tofacitinibe em pacientes pediátricos não foram estabelecidas.
Figura 2: Recomendação de Dosagem Com Base nos Dados de Farmacocinética
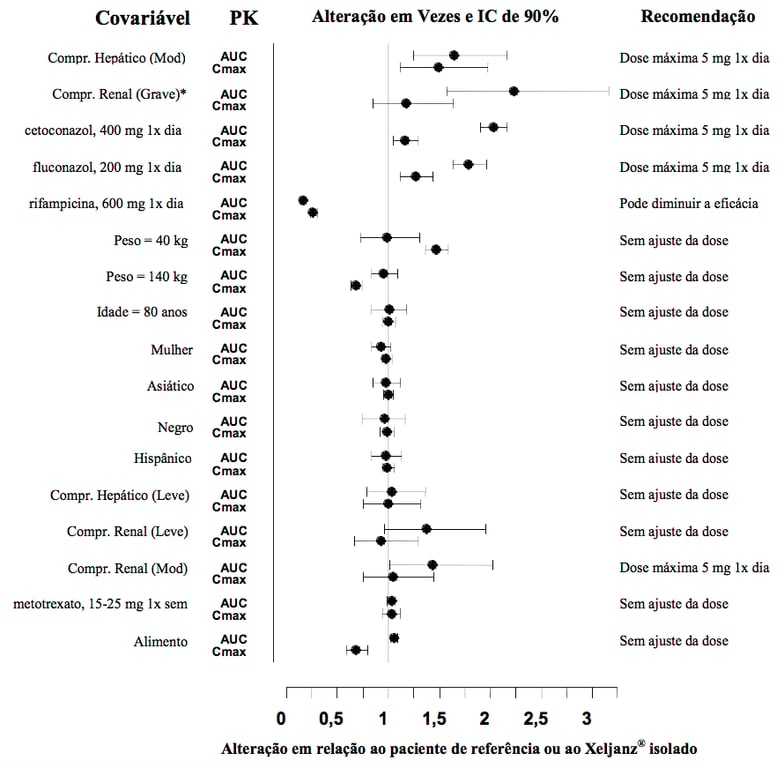
Comparações de peso, idade, sexo e etnia são baseados em pacientes com artrite reumatoide, com valores de referência de 70 kg, 55 anos, homem e caucasiano, respectivamente.
Nota: grupos de referência para dados de comprometimento renal e hepático são pacientes com função renal ou hepática normal, respectivamente; grupo de referência para estudos de interação medicamentosa e efeito do alimento é administração de tofacitinibe isolado; Mod=moderado; Compr=comprometimento.
*Ajuste de dose em populações especiais está descrito no item 8.
Dados de Segurança Pré-Clínicos
Em estudos pré-clínicos foram observados efeitos sobre os sistemas imunológicos e hematopoiéticos que foram atribuídos às propriedades farmacológicas (inibição de JAK) de tofacitinibe.
Efeitos secundários da imunossupressão, tais como infecções bacterianas e virais e linfomas foram observados em doses clinicamente relevantes.
Outros dados revelados em doses bem acima das exposições em humanos incluíram efeitos sobre o fígado, pulmão e sistema gastrintestinal.
O linfoma foi observado em 3 de 8 macacos adultos e 0 de 14 macacos jovens que receberam doses de tofacitinibe de 5 mg/kg duas vezes ao dia.
O nível sem efeitos adversos observáveis (NOAEL) para linfomas foi 1 mg/kg duas vezes ao dia. A AUC não ligada a 1 mg/kg duas vezes ao dia foi de 341 ng•h/mL, que é aproximadamente 0,7 vez da AUC não ligada a 10 mg duas vezes ao dia em humanos.
O tofacitinibe não é mutagênico ou genotóxico com base nos resultados de uma série de testes in vitro e in vivo de mutações genéticas e aberrações cromossômicas.
O potencial carcinogênico de tofacitinibe foi avaliado em um estudo de 6 meses em camundongos transgênicos rasH2 e em estudos de carcinogenicidade de 2 anos em ratos. O tofacitinibe não foi carcinogênico em camundongos até uma dose alta de 200 mg/kg/dia (AUC do fármaco não ligado aproximadamente 23 vezes a AUC em humanos na dose de 10 mg duas vezes ao dia).
Tumores benignos das células de Leydig foram observados em ratos: tumores benignos de células de Leydig em ratos não estão associados a um risco de tumores das células de Leydig em humanos.
Hibernomas (malignidade do tecido adiposo marrom) foram observados em ratas a doses ?30 mg/kg/dia (AUC do fármaco não ligado aproximadamente 51 vezes a AUC em humanos na dose de 10 mg duas vezes ao dia).
Timomas benignos foram observados em ratas que receberam administração apenas de doses de 100 reduzidas para 75 mg/kg/dia (AUC do fármaco não ligado aproximadamente 114 vezes a AUC em humanos na dose de 10 mg duas vezes ao dia).
O tofacitinibe demonstrou ser teratogênico em ratos e coelhos e possui efeitos em ratos sobre a fertilidade em fêmeas, parto e desenvolvimento peri/pós-natal. O tofacitinibe não teve efeitos sobre a fertilidade masculina, motilidade do esperma ou concentração do esperma. O tofacitinibe foi secretado no leite de ratas lactantes.
Cuidados de Armazenamento
Xeljanz deve ser conservado em temperatura ambiente (entre 15 e 30oC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características do medicamento:
Comprimido revestido redondo branco, com gravação “Pfizer” de um lado e “JKI 5” do outro.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá ser utilizado.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Venda sob prescrição médica.
Farmacêutico Responsável:
José Cláudio Bumerad – CRF-SP no 43746
Registrado por:
Laboratórios Pfizer Ltda.
Av. Presidente Tancredo de Almeida Neves, 1555 CEP 07112-070 – Guarulhos – SP
CNPJ no 46.070.868/0001-69
Fabricado e Embalado por:
Pfizer Manufacturing Deutschland GmbH - Betriebsstätte Freiburg Freiburg, Alemanha
Importado por:
Laboratórios Pfizer Ltda.
Rodovia Presidente Castelo Branco, Km 32,5 CEP 06696-000 – Itapevi – SP
CNPJ no 46.070.868/0036-99