para o que é indicado e para que serve?
Para que serve O Cabazitaxel (substância ativa) em associação com prednisona ou prednisolona é indicado para o tratamento de pacientes com câncer de próstata metastático resistente à castração, previamente tratados com um regime contendo docetaxel.Continue lendo...
ofertas de
Proazitax - 60Mg Solução ...
ofertas de Proazitax - 60Mg Solução ...
R$ 2.938,70
R$ 2.938,70
R$ 2.938,80
R$ 2.938,85
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
O Cabazitaxel (substância ativa) em associação com prednisona ou prednisolona é indicado para o tratamento de pacientes com câncer de próstata metastático resistente à castração, previamente tratados com um regime contendo docetaxel.
Contraindicação
O Cabazitaxel (substância ativa) está contraindicado em pacientes com
- Histórico de reações severas de hipersensibilidade ao Cabazitaxel (substância ativa) ou outras drogas formuladas com polissorbato 80;
- Contagem neutrofílica <1.500/mm3;
- Insuficiência hepática (bilirrubina ? 1 x LSN, ou AST/TGO e/ou ALT/TGP ? 1,5 x LSN).
Este medicamento é contraindicado para uso por pacientes com insuficiência hepática.
Como usar
Informações gerais acerca de incompatibilidades
Cabazitaxel (substância ativa) não deve ser misturado com outros medicamentos.
Sempre dilua Cabazitaxel (substância ativa) 60 mg/1,5 mL concentrado para solução para infusão com o diluente fornecido juntamente com o produto antes de adicioná-lo às soluções de infusão.
Cabazitaxel (substância ativa) contém polissorbato 80, que é conhecido por aumentar a taxa de extração de di-(2-etilhexil) ftalato (DEHP) do cloreto de polivinila (PVC).
Não use recipientes para infusão contendo PVC ou kits de infusão de poliuretano para o preparo e administração da solução para infusão.
Recomendações para o manuseio seguro
Assim como para qualquer outro agente antineoplásico, deve-se ter cautela no manuseio e preparo de soluções de Cabazitaxel (substância ativa). O uso de luvas é recomendado.
Se Cabazitaxel (substância ativa), em qualquer etapa do manuseio, entrar em contato com a pele, lave imediata e completamente com sabão e água. Caso o produto entre em contato com membranas mucosas, lave imediata e completamente com água.
Cabazitaxel (substância ativa) deve ser preparado e administrado somente por profissionais treinados no manuseio de agentes citotóxicos.
Profissionais grávidas não devem manusear o produto.
Etapas para o Preparo da solução para administração intravenosa
Leia cuidadosamente todas as etapas para preparo das soluções para a administração intravenosa de Cabazitaxel (substância ativa) antes de misturar e diluir o produto.
Cabazitaxel (substância ativa) necessita de duas diluições antes da sua administração. Siga as instruções de preparo da solução fornecidas abaixo.
Note que tanto o frasco-ampola do concentrado de Cabazitaxel (substância ativa) 60 mg/1,5 mL (volume de envase: 73,2 mg de Cabazitaxel (substância ativa)/1,83 mL) quanto do diluente (volume de envase: 5,67 mL) contêm um excesso de volume para compensar as perdas de líquido durante a preparação. Este excesso garante que, após a diluição com o conteúdo total do diluente que acompanha o produto, resulte em uma solução inicial diluída de Cabazitaxel (substância ativa), 10 mg/mL.
O seguinte processo de diluição envolvendo duas etapas deve ser realizado sob condições assépticas para a preparação da solução para infusão.
Etapa 1: Primeira Diluição
Etapa 2: segunda diluição (final) para infusão
Preparo e administração
- O Cabazitaxel (substância ativa) é administrado por uma infusão de 1 hora.
- Não use recipientes para infusão contendo PVC.
- Não use kits de infusão de poliuretano.
Utilize um filtro em linha com tamanho de poro nominal de 0,22 micrômetros (também conhecido com 0,2 micrômetros) durante a administração.
A solução para infusão de Cabazitaxel (substância ativa) deve ser utilizada imediatamente. Entretanto, o tempo de armazenamento em uso pode ser prolongado sob condições específicas.
Uma vez que a solução para infusão é supersaturada, pode ocorrer cristalização ao longo do tempo. Neste caso, a solução não deve ser utilizada e deve ser descartada.
Quaisquer materiais não-utilizados ou resíduos de produto devem ser descartados de acordo com os requerimentos locais.
O Cabazitaxel (substância ativa) não deve ser misturado com quaisquer outros medicamentos.
Posologia
O uso de Cabazitaxel (substância ativa) deve ser exclusivo a unidades especializadas na administração de produtos citotóxicos e o produto deve ser administrado sob a supervisão de um médico experiente no uso de quimioterapia contra o câncer.
Pré-medicação
Utilize como pré-medicação, antes da administração de Cabazitaxel (substância ativa), as seguintes medicações intravenosas para reduzir a incidência e severidade de reação de hipersensibilidade:
- Anti-histamínico (dexclorfeniramina 5 mg ou difenidramina 25 mg ou equivalente);
- Corticosteroide (dexametasona 8 mg ou equivalente);
- Antagonista H2 (ranitidina ou equivalente).
Profilaxia antiemética é recomendada e pode ser dada por via oral ou por via intravenosa, como necessário.
A dose recomendada de Cabazitaxel (substância ativa) é 25 mg/m2, administrada como infusão intravenosa de 1 hora a cada 3 semanas, em associação com 10 mg prednisona (ou prednisolona) oral administrada diariamente durante todo o tratamento com Cabazitaxel (substância ativa).
Ajustes de doses
Modificações na dose devem ser feitas se o paciente apresentar as seguintes reações adversas:
Tabela 2: Modificações de dose recomendadas para reações adversas em pacientes tratados com Cabazitaxel (substância ativa):
| Reações adversas | Modificações na dose |
| Neutropenia prolongada (mais de 1 semana) grau ? 3, apesar de medicação apropriada incluindo G-CSF | Retarde o tratamento até que a contagem neutrofílica seja > 1500 células/mm3, então reduza a dose de Cabazitaxel (substância ativa) de 25 mg/m2para 20 mg/m2 |
| Neutropenia febril ou infecção neutropênica | Retarde o tratamento até melhora ou resolução e até que a contagem neutrofílica seja > 1500 células/mm3, então reduza a dose de Cabazitaxel (substância ativa) de 25 mg/m2para 20 mg/m2 |
| Diarreia grau ? 3 ou diarreia persistente, apesar de medicação apropriada, reposição de fluidos e eletrólitos | Retarde o tratamento até melhora ou resolução, então reduza a dose de Cabazitaxel (substância ativa) de 25 mg/m2para 20 mg/m2 |
| Neuropatia periférica grau > 2 | Retarde o tratamento até melhora, então considere a redução da dose. |
Descontinue o tratamento com Cabazitaxel (substância ativa) se o paciente continuar apresentando quaisquer destas reações na dose de 20 mg/m2.
Não há estudos dos efeitos de Cabazitaxel (substância ativa) administrado por vias não recomendadas. Portanto, por segurança e para garantir a eficácia deste medicamento, a administração deve ser somente por via intravenosa.
Precauções
Supressão da medula óssea
Pode ocorrer supressão da medula óssea manifestada como neutropenia, anemia, trombocitopenia ou pancitopenia.
Neutropenia
Pacientes tratados com Cabazitaxel (substância ativa) podem receber G-CSF profilático, conforme diretrizes da American Society of Clinical Oncology (ASCO) e/ou diretrizes institucionais atuais, para reduzir o risco ou gerenciar complicações decorrentes de neutropenia (neutropenia febril, neutropenia prolongada ou infecção neutropênica).
A profilaxia primária com G-CSF deve ser considerada em pacientes com características clínicas de alto risco (idade > 65 anos, condição de desempenho ruim, episódios anteriores de neutropenia febril, extenso campo de radiação prévio, estado nutricional ruim ou outras co-morbidades graves) que os predispõem ao aumento das complicações da neutropenia prolongada.
O uso de G-CSF tem demonstrado limitar a incidência e severidade da neutropenia.
Neutropenia é a reação adversa mais comum de Cabazitaxel (substância ativa). Monitorização da contagem sanguínea total é essencial, com frequência semanal, durante o primeiro ciclo e antes de cada ciclo de tratamento subsequente, de modo que a dosagem possa ser ajustada, se necessário.
Reduza a dose em caso de neutropenia febril ou neutropenia prolongada, apesar de tratamento apropriado.
Reinicie o tratamento somente quando os neutrófilos recuperarem o nível ? 1.500/mm3.
Reações de hipersensibilidade
Todos os pacientes devem receber pré-medicação antes do início da infusão de Cabazitaxel (substância ativa). Os pacientes devem ser rigorosamente monitorizados para reações de hipersensibilidade, especialmente durante a primeira e segunda infusão. Reações de hipersensibilidade podem ocorrer em poucos minutos após o início da infusão de Cabazitaxel (substância ativa); portanto, recursos e equipamentos para o tratamento de hipotensão e broncoespasmo devem estar disponíveis.
Reações severas podem ocorrer e podem incluir rash/eritema generalizados, hipotensão e broncoespasmo.
Reações severas de hipersensibilidade requerem descontinuação imediata do Cabazitaxel (substância ativa) e terapia apropriada. Pacientes com histórico de reações severas de hipersensibilidade não devem receber Cabazitaxel (substância ativa).
Sintomas gastrintestinais
Pacientes que apresentarem diarreia após administração de Cabazitaxel (substância ativa) devem ser tratados com medicação antidiarreica comumente utilizada. Medidas apropriadas devem ser tomadas para reidratar os pacientes. Adiar o tratamento ou reduzir a dosagem pode ser necessário em casos de diarreia de grau ? 3.
Pacientes que apresentarem náusea ou vômito devem ser tratados com antieméticos comumente utilizados.
Casos de hemorragia e perfuração gastrintestinal, íleo paralítico, colite, incluindo desfecho fatal, foram relatados em pacientes tratados com Cabazitaxel (substância ativa). Recomenda-se cautela no tratamento de pacientes com maior risco de desenvolvimento de complicações gastrintestinais: pacientes com neutropenia, idosos, sob uso concomitante de AINE, em terapia antiplaquetária ou anticoagulante e pacientes com histórico de radioterapia pélvica, doença gastrintestinal, tais como ulceração e sangramento gastrintestinal.
Os sintomas tais como dor e sensibilidade abdominal, febre, constipação persistente, diarreia, com ou sem neutropenia, podem ser manifestações precoces de toxicidade intestinal grave e devem ser avaliadas e prontamente tratadas. Se necessário, o tratamento com Cabazitaxel (substância ativa) deve ser adiado ou descontinuado.
Anemia
Anemia foi observada em pacientes que receberam Cabazitaxel (substância ativa). Hemoglobina e hematócrito devem ser verificados antes do tratamento com Cabazitaxel (substância ativa) e se o paciente apresenta sinais ou sintomas de anemia ou perda de sangue. Recomenda-se precaução em pacientes com hemoglobina <10 g / dL e medidas apropriadas devem ser tomadas, se clinicamente indicado.
Distúrbios renais
Distúrbios renais foram relatados em associação com sepse, desidratação severa decorrente de diarreia, vômito e uropatia obstrutiva. Insuficiência renal, incluindo casos com desfecho fatal, foi observada. Medidas apropriadas devem ser tomadas para identificar a causa e os pacientes devem ser tratados intensivamente se isso ocorrer. A função renal deve ser monitorada.
Distúrbios respiratórios
Pneumonia intersticial/pneumonite, doença intersticial pulmonar e síndrome da angústia respiratória aguda foram relatadas e podem estar associadas com desfecho fatal.
Se ocorrerem novos ou agravamento de sintomas pulmonares, os pacientes devem ser cuidadosamente monitorizados, prontamente investigados e adequadamente tratados. Interrupção da terapia com Cabazitaxel (substância ativa) é recomendada até que o diagnóstico esteja disponível. O início precoce de medidas de suporte pode ajudar a melhorar a condição. O benefício de retomar o tratamento com Cabazitaxel (substância ativa) deve ser cuidadosamente avaliado.
Arritmias cardíacas
Foram relatadas arritmias cardíacas, mais frequentemente taquicardia e fibrilação atrial.
Gravidez e lactação
Devido a potencial exposição através do líquido seminal, homens com parceiras com potencial de engravidar devem utilizar contracepção confiável ao longo do tratamento e recomenda-se que tais medidas continuem sendo utilizadas por até 6 meses após a última dose de Cabazitaxel (substância ativa).
Não existem dados do uso de Cabazitaxel (substância ativa) em mulheres grávidas. Em estudos pré-clínicos em ratas e coelhas, o Cabazitaxel (substância ativa) foi embriotóxico, fetotóxico e abortivo em exposições significativamente menores do que aquelas esperadas no nível de dose recomendada para humanos. O Cabazitaxel (substância ativa) atravessa a barreira placentária.
O Cabazitaxel (substância ativa) não é recomendado durante a gravidez.
Categoria de risco na gravidez D.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Dados de farmacocinética disponíveis em animais demonstraram excreção de Cabazitaxel (substância ativa) e seus metabólitos no leite.
O Cabazitaxel (substância ativa) não deve ser utilizado durante a lactação.
O efeito de Cabazitaxel (substância ativa) na fertilidade humana é desconhecido. Estudos em animais demonstraram que Cabazitaxel (substância ativa) afetou o sistema reprodutivo em ratos e cães.
Pacientes pediátricos
A segurança e eficácia de Cabazitaxel (substância ativa) em crianças não foram estabelecidas.
Pacientes idosos
Pacientes idosos (? 65 anos de idade) podem estar mais sujeitos a apresentar certas reações adversas, incluindo neutropenia ou neutropenia febril.
Não é recomendado ajuste específico de dose de Cabazitaxel (substância ativa) em pacientes idosos.
Pacientes com insuficiência hepática
O Cabazitaxel (substância ativa) é extensivamente metabolizado no fígado e a insuficiência hepática é provável que aumente as concentrações plasmáticas de Cabazitaxel (substância ativa).
Não foram conduzidos estudos formais em pacientes com insuficiência hepática. Como medida de precaução, Cabazitaxel (substância ativa) não deve ser administrado a pacientes com insuficiência hepática [bilirrubina ? 1 x LSN, ou AST/TGO e/ou ALT/TGP ? 1,5 x LSN].
A insuficiência hepática aumenta o risco de complicações severas e potencialmente fatais em pacientes recebendo outros medicamentos pertencentes à mesma classe de Cabazitaxel (substância ativa).
Pacientes com insuficiência renal
O Cabazitaxel (substância ativa) é minimamente excretado através dos rins. Não é necessário ajuste de dose em pacientes com insuficiência renal leve (clearance de creatinina (CLCR): 50 a 80 mL/min). Dados em pacientes com insuficiência renal moderada (CLCR: 30 a 50 mL/min) e severa (CLCR < 30 mL/min) ou com doença renal em estágio final, são limitados; portanto, esses pacientes devem ser tratados com cautela e monitorizados cuidadosamente durante o tratamento.
Uso concomitante de medicamentos
Deve-se evitar o uso concomitante de medicamentos que sejam fortes indutores ou inibidores da CYP3A. No entanto, se o paciente necessitar da coadministração de um forte inibidor da CYP3A, deve-se considerar uma redução de 25% da dose de Cabazitaxel (substância ativa).
Alterações na capacidade de dirigir veículos e operar máquinas
Não foram realizados estudos sobre os efeitos na capacidade de dirigir e operar máquinas. No entanto, com base no perfil de segurança, Cabazitaxel (substância ativa) pode ter influência moderada na habilidade de dirigir e operar máquinas, uma vez que pode causar fadiga e tontura. Pacientes devem ser aconselhados a não dirigir ou operar máquinas se apresentarem essas reações adversas durante o tratamento.
Este medicamento contém álcool na quantidade de 539,8 mg (o diluente de Cabazitaxel (substância ativa) é uma solução 12,48% (v/v) de álcool etílico absoluto em água para injetáveis).
Reações Adversas
A seguinte taxa de frequência CIOMS é utilizada para as reações adversas a seguir
- Reação muito comum (?1/10);
- Comum (? 1/100 e < 1/10);
- Incomum (? 1/1.000 e < 1/100);
- Rara (? 1/10.000 e < 1.000);
- Muito rara (< 1/10.000);
- Desconhecida (não pode ser estimada a partir dos dados disponíveis).
A segurança de Cabazitaxel (substância ativa) em associação com prednisona ou prednisolona foi avaliada em 371 pacientes com câncer de próstata metastático hormônio-refratário, em um estudo randomizado, aberto, controlado de Fase III. Os pacientes receberam uma duração mediana de 6 ciclos de Cabazitaxel (substância ativa) ou 4 de mitoxantrona.
As reações adversas muito comuns (? 10%) de grau 1 – 4 foram anemia, leucopenia, neutropenia, trombocitopenia, diarreia, fadiga, náusea, vômito, constipação, astenia, dor abdominal, hematúria, dor nas costas, anorexia, neuropatia periférica (incluindo neuropatia periférica sensorial e motora), pirexia, dispneia, disgeusia, tosse, artralgia e alopecia.
As reações adversas comuns (? 5%) de grau ? 3 ocorridas em pacientes que receberam Cabazitaxel (substância ativa) foram neutropenia, leucopenia, anemia, neutropenia febril, diarreia, fadiga e astenia.
Ocorreu descontinuação do tratamento devido a reações adversas à droga em 68 pacientes (18,3%) no grupo do Cabazitaxel (substância ativa) e em 31 pacientes (8,4%) no grupo tratado com mitoxantrona. A reação adversa mais comum que levou à descontinuação do tratamento no grupo tratado com Cabazitaxel (substância ativa) foi neutropenia e insuficiência renal.
Foram relatadas mortes por outras causas que não a progressão da doença dentro de 30 dias da última dose do medicamento estudado em 18 pacientes (4,9%) tratados com Cabazitaxel (substância ativa) e em 3 pacientes (< 1%) tratados com mitoxantrona. A reação adversa fatal mais comum em pacientes tratados com Cabazitaxel (substância ativa) foi devido a infecções (n=5). A maioria (4 de 5 pacientes) das reações adversas fatais relacionada à infecção no TROPIC ocorreu após uma única dose de Cabazitaxel (substância ativa).
Incidência de reações adversas relatadas e anormalidades hematológicas em pacientes recebendo Cabazitaxel (substância ativa) em associação com prednisona e pacientes recebendo mitoxantrona em associação com prednisona (taxa de incidência pelo menos 2% mais elevada no grupo tratado com Cabazitaxel (substância ativa) em comparação ao grupo tratado com mitoxantrona):
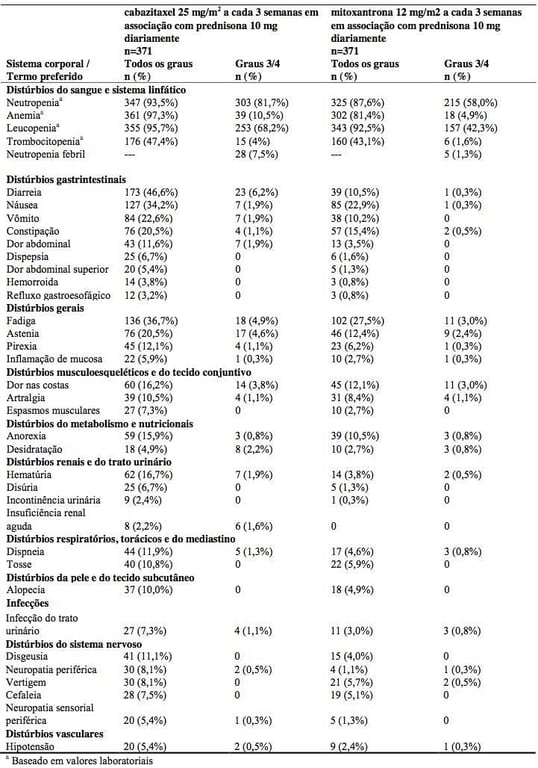
Descrição das reações adversas selecionadas
Experiência Pós-Comercialização
Interação Medicamentosa
O metabolismo de Cabazitaxel (substância ativa) é modificado pela administração concomitante de substâncias conhecidas como fortes inibidores (ex: cetoconazol, itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina, voriconazol) ou fortes indutores (ex: rifampicina, carbamazepina ou fenitoína) da CYP3A.
Portanto, a coadministração de Cabazitaxel (substância ativa) com fortes inibidores da CYP3A deve ser evitada.
No entanto, se esta coadministração não puder ser evitada, um monitoramento cuidadoso quanto à toxicidade e uma redução da dose do Cabazitaxel (substância ativa) devem ser considerados.
A coadministração com fortes indutores da CYP3A deve ser também evitada, uma vez que podem diminuir a exposição do Cabazitaxel (substância ativa).
In vitro, Cabazitaxel (substância ativa) também tem demonstrado inibir o transporte de proteínas dos polipeptídeos transportadores de ânions orgânicos OATP1B1. O risco de interação com substratos de OATP1B1 (ex: estatinas, valsartana, repaglinida) é possivelmente notado durante a infusão (1hora) ou até 20 minutos após o final da infusão, e pode conduzir a um aumento na exposição dos substratos de OATP1B1.
Prednisona/prednisolona administrada na dose de 10 mg diariamente não afetou a farmacocinética de Cabazitaxel (substância ativa).
A administração de vacinas com vírus vivo ou vivo-atenuado em pacientes imunocomprometidos por agentes quimioterápicos pode resultar em infecções graves ou fatais. A vacinação com uma vacina de vírus vivo-atenuado deve ser evitada em pacientes que receberam Cabazitaxel (substância ativa). As vacinas de vírus morto ou inativado podem ser administradas, no entanto, a resposta a tais vacinas pode estar diminuída.
Medicamento-exames laboratoriais e não-laboratoriais
Baseado nos resultados do estudo pivotal Fase III, não há evidências de quaisquer interações de Cabazitaxel (substância ativa) com exames laboratoriais e não-laboratoriais.
Interação Alimentícia
Pelo fato de Cabazitaxel (substância ativa) ser um medicamento de uso exclusivamente intravenoso, não foram realizados estudos clínicos formais de interação medicamento-alimento.
Ação da Substância
Resultados de eficácia
Pacientes adultos
A eficácia e a segurança de Cabazitaxel (substância ativa) em associação com prednisona ou prednisolona foram avaliadas em um estudo randomizado, aberto, internacional, multicêntrico de Fase III, em pacientes com câncer de próstata metastático hormônio-refratário, previamefnte tratado com um regime contendo docetaxel.
Sobrevida global (OS) foi o desfecho primário de eficácia do estudo.
Desfechos secundários incluíram Sobrevida Livre de Progressão [SLP (definida como o tempo da randomização até a progressão do tumor, progressão do Antígeno Prostático Específico (PSA), progressão da dor ou morte por qualquer causa, o que ocorrer primeiro)], Taxa de Resposta Tumoral baseada nos Critérios de Avaliação da Resposta em Tumores Sólidos (RECIST), progressão do Antígeno Prostático Específico (definida como um aumento ? 25% ou > 50% em pacientes não-responsivos ou responsivos ao PSA, respectivamente), resposta do Antígeno Prostático Específico (redução dos níveis de PSA sérico de pelo menos 50%), progressão da dor [avaliada através da escala de Intensidade da Dor Presente (PPI) do questionário McGill-Melzack e um Escore de Analgesia (AS)] e resposta à dor (definida como redução de mais de 2 pontos do basal mediano da PPI sem aumento concomitante no AS, ou redução ? 50% do uso de analgésicos do basal do AS médio sem aumento concomitante da dor).
Um total de 755 pacientes foram randomizados para receber Cabazitaxel (substância ativa) 25 mg/m2 intravenosamente a cada 3 semanas por um máximo de 10 ciclos com prednisona ou prednisolona oral 10 mg diariamente (n=378), ou para receber mitoxantrona 12 mg/m2 intravenosamente a cada 3 semanas por um máximo de 10 ciclos com prednisona ou prednisolona oral 10 mg diariamente (n=377).
Este estudo incluiu pacientes com mais de 18 anos de idade com câncer de próstata metastático hormônio-refratário mensurável pelos critérios RECIST ou doença não-mensurável com níveis de PSA em elevação ou aparecimento de novas lesões, e status de performance do Eastern Cooperative Oncology Group (ECOG) entre 0 e 2. Os pacientes deveriam ter neutrófilos > 1500/mm3, plaquetas >100.000/mm3, hemoglobina > 10g/dL, creatinina < 1,5 x LSN (Limite Superior da Normalidade), bilirrubina total < 1 x LSN, AST/TGO < 1,5 LSN, e ALT/TGP < 1,5 LSN.
Pacientes com histórico de insuficiência cardíaca congestiva ou infarto do miocárdio nos 6 meses anteriores, ou pacientes com arritmias cardíacas descontroladas, angina pectoris e/ou hipertensão não foram incluídos no estudo.
Dados demográficos, incluindo idade, raça e status de performance do ECOG (0 a 2) foram balanceados entre os braços de tratamento. No grupo tratado com Cabazitaxel (substância ativa), a idade média foi na faixa de 68 anos (46-92) e a distribuição racial foi 83,9% Caucasianos, 6,9% Asiáticos, 5,3% Negros e (4%) Outros.
O número mediano de ciclos foi 6 no grupo tratado com Cabazitaxel (substância ativa) e 4 no grupo da mitoxantrona. O número de pacientes que completaram o tratamento do estudo (10 ciclos) foi, respectivamente, 29,4% e 13,5% no grupo tratado com Cabazitaxel (substância ativa) e no grupo comparador.
A sobrevida global foi mais longa no braço do Cabazitaxel (substância ativa), com pacientes tratados com Cabazitaxel (substância ativa) tendo 30% de redução do risco de morte, em comparação à mitoxantrona [hazard ratio = 0,70, IC 95% (0,59-0,83)].
Tabela 1 - Eficácia de Cabazitaxel (substância ativa) no tratamento de pacientes com câncer de próstata metastático resistente à castração (análise de Intenção de Tratamento - ITT) - Desfecho primário:
|
Cabazitaxel (substância ativa) + prednisona n=378 |
Mitoxantrona + prednisona | |
|
Sobrevida Global | ||
|
Número de pacientes com mortes (%) |
234 (61,9 %) |
279 (74%) |
|
Sobrevida mediana (meses) |
15,1(14,1-16,3) |
12,7(11,6-13,7) |
|
Hazard ratio (HR)1 (IC95%) |
0,70 (0,59-0,83) | - |
|
Valor de p |
<0,0001 | - |
1HR estimado utilizando o modelo de Cox; um hazard ratio menor que 1 favorece o Cabazitaxel (substância ativa).
Houve uma melhora da SLP no braço do cabazitazel em comparação ao braço da mitoxantrona, 2,8 (2,4-3,0) meses versus 1,4 (1,4-1,7) respectivamente, HR (IC95%) 0,74 (0,64-0,86), p< 0,0001.
Houve uma taxa mais elevada significante de resposta tumoral de 14,4% (IC95%: 9,6-19,3) em pacientes no braço do Cabazitaxel (substância ativa) comparado a 4,4% (IC95%: 1,6-7,2) nos pacientes no braço da mitoxantrona, p=0,0005. Os desfechos secundários de PSA foram positivos no braço do Cabazitaxel (substância ativa). Houve uma progressão mediana do PSA de 6,4 meses (IC95%: 5,1-7,3) para pacientes no braço do Cabazitaxel (substância ativa), em comparação a 3,1 meses (IC95%: 2,2-4,4) no braço da mitoxantrona, HR 0,75 meses (IC95%: 0,63-0,90), p = 0,0010. A resposta do PSA foi 39,2% em pacientes do braço do Cabazitaxel (substância ativa) (IC95%: 33,9-44,5) versus 17,8% em pacientes tratados com mitoxantrona (IC95%: 13,7-22,0), p = 0,0002.
Mitoxantrona é utilizada como quimioterapia inicial para o tratamento de pacientes com dor relacionada ao câncer de próstata metastático resistente à castração. Não houve diferença estatística entre os dois braços de tratamento quanto à progressão da dor e resposta à dor.
Em um estudo fase III de não-inferioridade, randomizado, aberto, multicêntrico, multinacional, (estudo EFC11785), 1200 pacientes com câncer da próstata metastático resistente à castração, previamente tratados com um regime contendo docetaxel, foram randomizados para receber Cabazitaxel (substância ativa) 25 mg/m2 (N = 602) ou 20 mg/m2 (N = 598). A sobrevida global (OS) foi o desfecho primário de eficácia.
O estudo cumpriu o seu objetivo primário demonstrando a não inferioridade do Cabazitaxel (substância ativa) 20 mg/m2 em comparação a 25 mg/m2. Uma percentagem maior de pacientes no grupo de 25 mg/m2 (42,9%) em comparação com o grupo de 20 mg/m2 (29,5%), mostraram uma resposta de PSA estatisticamente significativa (p <0,001).
Foi observado um risco estatístico significativamente maior de progressão do PSA nos pacientes com a dose de 20 mg/m2 frente a dose de 25 mg/m2 (HR 1,195; 95% CI: 1,025-1,393). Não houve diferença estatística em relação aos outros desfechos secundários (PFS, resposta tumoral e resposta da dor, progressão do tumor e da dor e quatro subcategorias de FACT-P).
Tabela 2 - Sobrevida global no estudo EFC 11785 comparando o braço de Cabazitaxel (substância ativa) 25 mg/m2 versus o braço Cabazitaxel (substância ativa) 20 mg/m2 (análise de Intenção de Tratamento) - Desfecho primário de eficácia:
|
CBZ20+PRED |
CBZ25+PRED | |
| Sobrevida Global | ||
| Número de pacientes mortos (%) | 497 (83,1 %) | 501 (83,2%) |
| Sobrevida mediana (meses) (IC 95%)Hazard ratio(HR)1 | 13,4 (12,19 - 14,88) | 14,5 (13,47 - 15,28) |
| VersusCabazitaxel (substância ativa) 25 + prednisona | 1,024 | - |
| 1-lado 98,89% LSIC | 1,184 | - |
| 2-lado 95% LIIC | 0,922 | - |
CBZ20 = Cabazitaxel (substância ativa) 20 mg/m2, CBZ25 = Cabazitaxel (substância ativa) 25 mg/m2, PRED = prednisona/prednisolona.
IC = intervalo de confiança, LIIC = limite inferior do intervalo de confiança, LSIC = limite superior do intervalo de confiança.
1HR estimado utilizando o modelo de regressão Cox Hazard Proporcional. Um hazard ratio < 1 indica um risco menor do Cabazitaxel (substância ativa) 20 mg/m2 em relação ao 25 mg/m2.
O estudo EFC11785 demonstrou um melhor perfil de segurança para a dose de Cabazitaxel (substância ativa) 20 mg/m2. O perfil de segurança de Cabazitaxel (substância ativa) 25 mg/m2 observado neste estudo foi qualitativamente e quantitativamente semelhante ao observado no estudo EFC6193. Os pacientes no grupo 20 mg/m2, receberam uma média de 6 ciclos (duração média de 18 semanas), enquanto que os pacientes no grupo de 25 mg/m2 receberam uma média de 7 ciclos (duração média de 21 semanas). No grupo 25 mg/m2, 128 pacientes (21,5%) tiveram a dose reduzida de 25 para 20 mg/m2, 19 pacientes (3,2%) tiveram dose reduzida de 20 para 15 mg/m2 e 1 paciente (0,2%) teve dose reduzida de 15 para 12 mg/m2. No grupo de 20 mg/m2, 58 pacientes (10,0%) tiveram dose reduzida de 20 para 15 mg/m2 e 9 pacientes (1,6%) tiveram dose reduzida de 15 para 12 mg/m2.
Todos os graus de reações adversas com uma incidência superior a 10% foram maiores em pacientes tratados com 25 mg/m2 do que em pacientes tratados com 20 mg/m2: diarreia (39,8% versus 30,7%), náusea (32,1% versus 24,5%), fadiga (27,1% versus 24,7%), hematúria (20,8% versus 14,1%), astenia (19,7% versus 15,3%), diminuição do apetite (18,5% versus 13,1%), vômitos (18,2% versus 14,5%), constipação (18,0% versus 17,6%), dor nas costas (13,9% versus 11,0%), neutropenia clínica (10,9% versus 3,1%), infecção do trato urinário (10,8% versus 6,9%), neuropatia sensorial periférica (10,6% versus 6,6%) e disgeusia (10,6% versus 7,1%). Reações adversas grau ? 3 com uma incidência mais elevada que 5% foram observadas somente em pacientes tratados com 25 mg/m2: neutropenia clínica (9,6% a 25 mg/m2 versus 2,4% a 20 mg/m2) e neutropenia febril (9,2% a 25 mg/m2 versus 2,1% a 20 mg/m2). Houve menos anormalidades hematológicas relatadas em pacientes tratados com 20 mg/m2 em comparação com pacientes tratados com 25 mg/m2, com base nos valores laboratoriais: 73,3% para 25 mg/m2 versus 41,8%, para 20 mg/m2 para neutropenia grau ? 3; 13,7% versus 9,9%, respectivamente, para anemia grau ? 3; 4,2% versus 2,6%, respectivamente, para trombocitopenia grau ? 3.
Pacientes pediátricos
O Cabazitaxel (substância ativa) foi avaliado em um estudo aberto, multicêntrico, conduzido em duas fases, em um total de 39 pacientes pediátricos. A fase 1 de escalonamento de dose estabeleceu a dose máxima tolerada (DMT) de Cabazitaxel (substância ativa) em pacientes pediátricos (com idades entre 4-18 anos) com tumores sólidos recorrentes ou refratários com base na dose limitante de toxicidade (DLTs). A fase 2 avaliou a atividade e a segurança de Cabazitaxel (substância ativa) na DMT em pacientes pediátricos (com idades entre 3-16 anos) com glioma de alto grau (HGG) recorrente ou refratário ou glioma pontino intrínseco difuso (GPID). Os desfechos primários na fase 2 foram a taxa de resposta objetiva e a duração da resposta.
Todos os pacientes receberam profilaxia com G-CSF. Na fase 1, foram incluídos 23 pacientes tratados com doses entre 20 mg/m2 e 35 mg/m2. A dose máxima tolerada (DMT) foi estabelecida em 30 mg dose/m2.
Na fase 2, foram incluídos 16 pacientes e tratados com 30 mg/m2. Foram avaliados 11 pacientes para eficácia. Não houve resposta objetiva em pacientes com GPID ou HGG.
Os Eventos Adversos Emergentes de Tratamento (TEAEs) mais frequentes (?25%) em qualquer grau, foram fadiga (39,1%), dor de cabeça, diarreia, náuseas (todos em 34,8%), vômitos (30,4%) e constipação (26,1%) nos pacientes da fase 1; e diarreia (43,8%), disfagia (37,5%), náusea (31,3%), vômitos e dor de cabeça (ambos 25,0%) nos pacientes da fase 2.
Os eventos adversos graves (SAEs) relatados em mais de 2 pacientes em qualquer parte do estudo incluíram neutropenia febril em 5 pacientes (21,7%) na Fase 1; e neutropenia febril, reação anafilática e progressão da doença, todos relatados em 3 pacientes (18,8%) na fase 2.
Características Farmacológicas
Mecanismo de ação
Cabazitaxel (substância ativa) é um agente antineoplásico que age interrompendo a rede de microtúbulos nas células. O Cabazitaxel (substância ativa) se liga à tubulina e promove a agregação da tubulina em microtúbulos, ao passo que inibe, simultaneamente, sua desagregação. Isto leva à estabilização dos microtúbulos, que resulta na inibição das funções celulares de mitose e interfase.
Propriedades farmacodinâmicas
Cabazitaxel (substância ativa) demonstrou um amplo espectro de atividade antitumoral contra tumores humanos avançados xenotransplantados em camundongos, incluindo glioblastomas humanos intracranianos. Cabazitaxel (substância ativa) é ativo em tumores sensíveis ao docetaxel. Adicionalmente, Cabazitaxel (substância ativa) demonstrou atividade em modelos tumorais insensíveis à quimioterapia, incluindo docetaxel.
Propriedades farmacocinéticas
Uma análise farmacocinética populacional foi realizada em 170 pacientes incluindo pacientes com tumores sólidos avançados (n = 69), câncer de mama metastático (n = 34) e câncer de próstata metastático (n = 67). Esses pacientes receberam doses de Cabazitaxel (substância ativa) variando de 10 a 30 mg/m2 semanalmente ou a cada 3 semanas.
Interações medicamentosas
Indutores ou potentes inibidores da CYP3A podem afetar o Cabazitaxel (substância ativa), uma vez que o Cabazitaxel (substância ativa) é principalmente metabolizado pela CYP3A.
A prednisona/prednisolona administrada na dose de 10 mg diariamente não afetou a farmacocinética de Cabazitaxel (substância ativa).
In vitro, Cabazitaxel (substância ativa) não inibiu a proteína de múltipla resistência a drogas (MRP): MRP1 e MRP2 ou os transportadores de cátions orgânicos (OCT1). Cabazitaxel (substância ativa) inibiu o transporte da glicoproteína-P (P-gp) (digoxina, vinblastina), das proteínas resistente ao câncer de mama (BCRP) (metotrexato) e dos polipeptídeos transportadores de ânions orgânicos (OATP1B3) (CCK8), em concentrações pelo menos 15 vezes o que foi observado na prática clínica, ao mesmo tempo que inibiu o transporte de OATP1B1 (estradiol-17-glucoronida) em concentrações de apenas 5 vezes o que foi observado na prática clínica. Portanto, o risco de interação com substratos da MRP, OCT1, P-gp e OATP1B3, é improvável in vivo na dose de 25 mg/m2. O risco de interação com o transportador OATP1B1 é possivelmente notado durante a duração da infusão (1 hora) e até 20 minutos após o término da infusão.
Dados de segurança pré-clínica
informações complementares
| Fabricante |
| EUROFARMA |
| Princípio ativo |
| Cabazitaxel |
| Categoria do medicamento |
| Medicamentos Especiais |
