para o que é indicado e para que serve?
Para que serve Acetato de Lanreotida (substância ativa) é indicado para o tratamento de Acromegalia Tratamento de acromegalia quando os níveis de Hormônio de Crescimento (GH) e Fator de Crescimento similar à Insulina do tipo I (IGF-1) permanecem anormais após cirurgia e/ou radioterapia, ou para os pacientes para os quais cirurgia e/ou radioterapia não consistem opção de tratamento; Tratamento de sintomas clínicos associados à acromegalia.Continue lendo...
ofertas de
Somatuline Autogel - 90 M...
ofertas de Somatuline Autogel - 90 M...
R$ 3.261,24
R$ 4.843,70
R$ 4.843,70
R$ 4.843,80
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Acetato de Lanreotida (substância ativa) é indicado para o tratamento de
Contraindicação
Acetato de Lanreotida (substância ativa) é contraindicado para indivíduos com hipersensibilidade conhecida à somatostatina ou peptídeos relacionados, assim como com qualquer outro componente da formulação.
Este medicamento é contraindicado para menores de 18 anos de idade.
Como usar
Acetato de Lanreotida (substância ativa) é apresentado em três dosagens: 60 mg, 90 mg e 120 mg.
Início do Tratamento
Ajuste do Tratamento
O tratamento deve ser ajustado de acordo com a resposta individual do paciente. A dose deve ser individualizada de acordo com a resposta clínica, avaliada através do monitoramento dos níveis plasmáticos de GH e IGF-1 e dos sintomas clínicos.
Precauções
A lanreotida pode reduzir a motilidade da vesícula biliar e levar à formação de cálculo biliar. Sendo assim, os pacientes devem ser monitorados periodicamente.
Estudos farmacológicos em animais e humanos mostraram que a lanreotida, assim como a somatostatina e outros análogos desta, inibe a secreção de insulina e glucagon. Sendo assim, pacientes tratados com lanreotida podem apresentar hipoglicemia ou hiperglicemia. A glicemia deve ser monitorada quando o tratamento com lanreotida é iniciado e no caso de alteração de posologia, qualquer tratamento antidiabético deve ser ajustado conforme a necessidade.
Ligeiros decréscimos da função tireoidiana foram observados durante o tratamento com lanreotida em pacientes acromegálicos, apesar de casos de hipotireoidismo clínico serem raros. Testes para avaliação da função tireoidiana são recomendados de acordo com o escrutínio médico.
Em pacientes sem problemas cardíacos subjacentes, a lanreotida pode causar diminuição da frequência cardíaca, sem necessariamente ultrapassar o limite de bradicardia. Em pacientes com doenças cardíacas prévias ao tratamento com lanreotida, a bradicardia sinusal pode ocorrer. Recomenda-se cuidado ao iniciar tratamento com lanreotida em pacientes com bradicardia.
Efeitos sobre a capacidade de dirigir e usar máquinas
Enquanto o efeito sobre a capacidade de dirigir e usar máquinas não foi estabelecido para Acetato de Lanreotida (substância ativa), vertigem foi relatada para Somatuline PR. Caso o paciente apresente qualquer suspeita, não é recomendado que dirija ou utilize máquinas.
Gravidez e lactação
Categoria de risco na gravidez C.
Este medicamento não deve ser utilizado por mulheres grávidas, sem orientação médica ou do cirurgião-dentista.
Dados Não-Clínicos
Estudos realizados em animais não mostraram evidência de efeitos teratogênicos associados à lanreotida durante a organogênese. Redução da fertilidade foi observada em ratos fêmea devido à inibição da secreção de GH em doses terapêuticas humanas.
Dados Clínicos
Os dados sobre um número limitado de exposições à lanreotida durante a gravidez não indicam que a lanreotida tenha causado qualquer reação adversa à gravidez ou à saúde do feto ou neonato. Até a presente data, nenhum outro dado epidemiologicamente relevante está disponível.
Como estudos animais não são sempre preditivos da resposta humana, a lanreotida somente deve ser administrada em gestantes se estritamente necessário.
Não se sabe se a lanreotida é excretada no leite humano. Como muitos fármacos são excretados no leite humano, é necessário cuidado caso a lanreotida seja administrada durante a lactação.
Dados Pré-Clínicos de Segurança
Em estudos de bioensaio carcinogênico conduzidos em ratos e camundongos, não foram observadas alterações neoplásicas em doses terapêuticas humanas. Foi observado aumento da incidência de tumores subcutâneos no sítio de aplicação, provavelmente devido à alta frequência de aplicação em animais (diariamente) comparada à aplicação mensal em humanos, e, portanto, não é considerado fato clinicamente relevante.
A lanreotida não mostrou potencial genotóxico em baterias padronizadas de testes realizadas in vitro e in vivo.
Reações Adversas
As reações adversas e os eventos adversos são classificadas de acordo com a sua frequência, primeiro as mais frequentes, usando os seguintes parâmetros
|
Parâmetros |
Frequência |
|
Muito comum |
> 1/10 (> 10%) |
|
Comum (frequente) |
> 1/100, < 1/10 (> 1% e <10%) |
|
Incomum (infrequente) |
> 1/1000, < 1/100 (> 0,1% e <1%) |
|
Rara |
> 1/10.000, < 1/1000 (> 0,01% e < 0,1%) |
|
Muito rara |
< 1/10.000 (> 0,001%) |
Os eventos adversos relacionados à lanreotida mais comuns são distúrbios do sistema gastrointestinal (os mais comumente descritos são diarreia e dor abdominal, geralmente leve a moderada e transitória), colelitíase (frequentemente assintomática) e reações no sítio de injeção (dor, nódulos e endurecimento).
O perfil de eventos adversos é semelhante para todas as indicações.
| Classe de sistema de órgãos | Categoria de frequência | Reações adversas |
| Exames laboratoriais | Comum | ALT anormal, AST anormal, bilirrubina sanguínea aumentada, hiperglicemia, hemoglobina glicosilada aumentada, perda de peso, redução de enzimas pancreáticas |
| Incomum | AST elevada, fosfatase alcalina sanguínea aumentada, bilirrubina sanguínea anormal, hiponatremia | |
| Distúrbios Cardíacos | Comum | Bradicardia sinusal |
| Distúrbios do Sistema Nervoso Central | Comum | Vertigem, cefaléia, letargia |
| Distúrbios do Trato Gastrointestinal | Muito comum | Diarreia, fezes amolecidas, dor abdominal |
| Comum | Náusea, vômito, constipação, flatulência, distensão abdominal, desconforto abdominal, dispepsia, esteatorreia | |
| Incomum | Acolia fecal | |
| Distúrbios da Pele e Tecido Subcutâneo | Comum | Alopecia, hipotricose |
| Distúrbios Nutricionais e do Metabolismo | Comum | Hipoglicemia, redução de apetite, hiperglicemia, Diabetes mellitus |
| Distúrbios Vasculares | Incomum | Rubor |
| Doenças do tecido conjuntivo e músculo-esquelético | Incomum | Dor músculo-esquelética, mialgia |
| Distúrbios Gerais e do Local de Administração | Comum | Fadiga, reações no local de administração (dor, massa, endurecimento, nódulo, prurido), astenia |
| Distúrbios do Sistema Hepatobiliar | Muito comum | Colelitíase |
| Comum | Dilatação biliar | |
| Distúrbios Psiquiátricos | Incomum | Insônia |
Dados de segurança pós-comercialização
| Classe de sistema de órgãos | Categoria de frequência | Reações adversas |
| Distúrbios do Trato Gastrointestinal | Frequência desconhecida | Esteatorreia, pancreatite |
| Distúrbios do Sistema Hepatobiliar | Frequência desconhecida | Colecistite |
| Distúrbios do Sistema Imune | Frequência desconhecida | Um número pequeno de reações alérgicas associadas com a lanreotida (incluindo angioedema, anafilaxia, hipersensibilidade) foram relatadas. |
Atenção: Este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Estadual ou Municipal.
Interação Medicamentosa
Os efeitos farmacológicos da lanreotida no sistema gastrointestinal podem causar redução da absorção intestinal de fármacos administrados concomitantemente, incluindo ciclosporina.
A administração concomitante de ciclosporina e lanreotida pode causar decréscimo da biodisponibilidade relativa da ciclosporina, e, portanto, pode ser necessário o ajuste de dose da ciclosporina, a fim de se manter níveis terapêuticos do fármaco.
A interação com fármacos de alta afinidade por proteínas séricas é pouco provável, devido à afinidade moderada da lanreotida por proteínas séricas.
Foram publicados dados limitados indicando que a administração concomitante de análogos de somatostatina e bromocriptina pode causar aumento da disponibilidade de bromocriptina.
A administração concomitante de fármacos indutores de bradicardia (p.ex., bloqueadores beta adrenérgicos) e lanreotida pode causar efeito adicional na ligeira redução da frequência cardíaca associada à lanreotida. Sendo assim, pode ser necessário ajuste de dose de tais fármacos administrados concomitantemente.
Foram publicados dados limitados indicandoque análogos de somatostatina podem reduzir a depuração metabólica de substâncias metabolizadas pelas enzimas do complexo Citocromo P450, fato que pode estar relacionado à supressão do hormônio de crescimento.
Como este efeito da lanreotida não pode ser excluído, outros fármacos de baixo índice terapêutico metabolizados principalmente pela CYP3A4 (p.ex., quinidina, terfenadina) devem ser utilizados com cuidado.
Ação da Substância
Resultados de eficácia
Acromegalia
Acromegalia é uma doença crônica rara (incidência anual de 3-4 casos/milhão, com prevalência de 40-90 casos/milhão), causada por secreção excessiva de Hormônio de Crescimento (GH) por tumor principalmente da hipófise. Níveis plasmáticos elevados de GH causam os sintomas e a patologia da doença, seja diretamente através das ações em tecidos alvo, ou indiretamente através do estímulo à secreção excessiva de Fator de Crescimento similar à Insulina do tipo I (IGF-1), principalmente pelo fígado.
O tratamento de escolha é a cirurgia. Porém, a doença permanece ativa em mais de 50% dos pacientes, fato determinado pela elevação dos níveis sistêmicos de GH, IGF-1, a persistência de sintomas clínicos e aumento da morbidade e mortalidade. Os análogos da somatostatina reduzem a secreção de GH e IGF-1 em 50 a 70% dos pacientes. Além disso, eles são capazes de aliviar muitos sintomas da doença, melhorar complicações de comorbidades relacionadas e podem reduzir ou estabilizar o tamanho do tumor em um grupo de pacientes.
Os principais eventos adversos associados aos análogos de somatostatina são distúrbios gastrointestinais, incluindo cólica abdominal, diarreia e aumento da incidência de cálculos na vesícula biliar. Acetato de Lanreotida (substância ativa) (solução supersaturada de acetato de lanreotida) foi desenvolvido para tratamento a longo prazo de pacientes acromegálicos com resposta inadequada à cirurgia e/ou radioterapia, ou para os pacientes para os quais cirurgia e/ou radioterapia não consistem em opção de tratamento.
Estudos clínicos prospectivos recentes confirmaram o valor do tratamento de primeira linha com Acetato de Lanreotida (substância ativa) em pacientes acromegálicos.
A possibilidade de utilizar análogos de somatostatina para tratamento de pacientes não tratados previamente com cirurgia e/ou radioterapia é adicionalmente suportada pela literatura, e por consensos de especialistas, que recomendam o uso de análogos de somatostatina como terapia de primeira linha em pacientes acromegálicos selecionados, isto é, sem risco de prejuízo visual pelo tumor (caso de macroadenomas que não afetam o quiasma óptico), pacientes que não são indicados para cirurgia (comorbidades pulmonares ou cardíacas graves, elevado risco cirúrgico ou anestésico), pacientes que recusam cirurgia, pacientes com tumor cujo controle por cirurgia seja improvável (invasão lateral do seio cavernoso), e pacientes que requerem preservação da função hipofisária (especialmente fertilidade).
Tumores Neuroendócrinos / Carcinoides e Tumores Neuroendócrinos Gastroenteropancreáticos (GEP-NET)
Tumores neuroendócrinos são neoplasias raras, de comportamento amplamente variável e que podem apresentar crescimento lento, com incidência anual estimada em 1-3 casos/100.000. Tais tumores são originados de células neuroendócrinas, são usualmente localizados no trato gastrointestinal (90%) e pâncreas, mas também podem ser encontrados nos brônquios pulmonares.
Estes tumores podem ser endocrinologicamente inertes ou secretar uma variedade de hormônios que podem resultar em sintomas conhecidos como síndrome carcinoide. A liberação de substâncias vasoativas como serotonina, 5-HT e histamina na corrente sanguínea é considerada a causa de diarreia, flush, broncoconstrição, e eventualmente doença cardíaca valvar, associada à síndrome.
Cerca de 80 a 90% destas neoplasias malignas expressam receptores de somatostatina na superfície celular, aos quais a lanreotida se liga com elevada afinidade. A lanreotida inibe as vias intracelulares de transmissão de sinal mediada por receptores de somatostatina, causando a redução dos níveis de hormônio circulantes e da secreção de aminas biogênicas, fatores que podem melhorar os sintomas associados ao tumor e estabilizar o crescimento do tumor. O tratamento com lanreotida reduz os sintomas (flush e diarreia), marcadores bioquímicos (5-HIAA e Cromogranina A), associados aos tumores neuroendócrinos / carcinoides.
Adicionalmente ao perfil favorável de lanreotida no controle dos sintomas dos tumores neuroendócrinos / carcinoides, lanreotida demonstrou atividade anti-proliferativa em pacientes com Tumores Neuroendócrinos Gastroenteropancreáticos (GEP-NET) metastáticos, sendo associado com o aumento da sobrevida livre de progressão (PFS), de forma significativa.
Características Farmacológicas
Propriedades Farmacodinâmicas
Grupo farmacoterapêutico: Anti-hormônio de crescimento.
Código ATC: H01C B03.
A lanreotida é um octapeptídeo análogo da somatostatina endógena. Como a somatostatina, a lanreotida inibe diversas funções endócrinas, neuroendócrinas, exócrinas e parácrinas. A lanreotida apresenta elevada afinidade pelos receptores de somatostatina humana (SSTR) 2, e 5, e afinidade reduzida pelos receptores de somatostatina humana (SSTR) 1, 3 e 4. A atividade nos receptores de somatostatina humana 2 e 5 consiste no mecanismo primário de inibição de GH conhecido.
Em adição, a seletividade pela inibição da secreção de GH, comparada à inibição da secreção de insulina, torna a lanreotida adequada para o tratamento da acromegalia. Ao mesmo tempo, sua elevada especificidade e afinidade aos receptores SSTR torna a lanreotida autogel valioso recurso terapêutico em doenças neoplásicas que apresentam expressão e são mediadas por tais receptores, tais como os tumores neuroendócrinos / carcinoides.
Através da inibição de síntese de hormônio tireoestimulante (TSH), a lanreotida também normaliza a função tireoidiana em pacientes com adenomas secretores de TSH.
A ação inibitória da lanreotida na secreção exócrina intestinal, hormônios digestivos e mecanismos de proliferação celular é particularmente interessante para a sua aplicação no tratamento de sintomas de tumores neuroendócrinos do trato gastrointestinal, especialmente os carcinoides.
A lanreotida, assim como a somatostatina, apresenta ação antissecretória exócrina geral. Esta ação se deve à inibição da via metabólica intracelular do AMP cíclico mediada pela proteína G através da ação dos receptores celulares para somatostatina. Deste modo inibe a secreção de serotonina em tumores neuroendócrinos funcionantes, e por consequência reduz os níveis urinários do metabólito da serotonina 5-HIAAA (ácido 5- hidroxiindolacetico) na maioria dos pacientes com GEP-NET, e também reduz os níveis plasmáticos de cromogranina A (um peptídeo precursor de diversos hormonônios e de outras secreções encontradas em tumores neuroendócrinos entre outros). Inibe também a secreção basal de motilina, peptídeo gástrico inibitório e polipeptídeo pancreático, porém não apresenta efeito significativo sob a secreção de secretina no período de jejum ou da gastrina.
A lanreotida inibe o aumento do fluxo sanguíneo na artéria mesentérica e no sistema porta, induzido pela ingestão de alimentos. Também reduz significativamente a secreção jejunal de água, sódio, potássio e cloro, estimulada pela prostaglandina E1. A lanreotida também reduz níveis de prolactina em pacientes acromegálicos tratados a longo prazo.
A lanreotida, assim como a somatostatina, possui uma atividade antitumoral que é mediada através de mecanismos diretos e indiretos. Os mecanismos diretos envolvem a ativação de receptores de somatostatina em células tumorais que modulam as vias de transdução de sinalização intracelulares. Vários estudos “in vitro” utilizando linhas celulares transfectadas com os receptores de somatostatina indicam que todos os subtipos de receptores da somatostatina (sst1-5) podem mediar a inibição da proliferação celular, ao passo que os subtipos de receptores específicos (sst2,3) podem mediar a apoptose.
Estas ações parecem ser principalmente reguladas através da via de sinalização da MAP-cinase e através da ativação de fosfatases da fosfotirosina. Os mecanismos antiproliferativos indiretos incluem a inibição de fatores de crescimento mitogênicos, como o fator de crescimento semelhante à insulina (IGF), bem como a inibição da angiogênese do tumor através da interação com os receptores de somatostatina em células endoteliais e em monócitos.
Um estudo de fase III, de 96 semanas, duração fixa, multicêntrico, randomizado, duplo-cego, controlado por placebo de Acetato de Lanreotida (substância ativa) foi realizado em pacientes com tumores neuroendócrinos gastroenteropancreáticos para avaliar o efeito anti-proliferativo da lanreotida.
Os pacientes tinham doença irressecável metastática e/ou localmente avançada com tumores bem ou moderadamente diferenciados confirmados histologicamente, localizados primariamente no pâncreas, intestino médio, intestino grosso ou de localização primária desconhecida.
Os tumores eram não-funcionantes, e, portanto, os pacientes não tinham sintomas relacionados à secreção de hormônios, exceto por gastrinomas que estivessem adequadamente controlados por meio de inibidores de bomba de prótons por 4 meses ou mais.
A randomização foi estratificada por terapia prévia à entrada e à presença/ausência de progressão na linha de base, tal como avaliado por RECIST 1.0 (Critérios de Avaliação de Resposta em Tumores Sólidos), durante uma fase de triagem de 3-6 meses.
O endpoint primário foi a sobrevida livre de progressão (PFS), medido como o tempo para a progressão da doença por RECIST 1.0 ou morte dentro de 96 semanas após a administração do primeiro tratamento. A análise de PFS utilizou avaliação radiológica independente, centralmente revisada, da progressão. Os endpoints secundários incluíram a segurança, a sobrevida global, a porcentagem de pacientes vivos e progressão livre nas semanas 48-96 e o efeito sobre os marcadores tumorais.
Os pacientes foram randomizados na proporção 1:1 para receber Acetato de Lanreotida (substância ativa) 120mg (n = 101) ou placebo (n = 103), a cada 28 dias.
Os grupos de pacientes foram semelhantes com relação aos dados demográficos de sexo e idade (mediana de idade de 62,7 anos, 52,5% do sexo masculino). Além disso, 96% dos pacientes eram brancos, 69% dos pacientes tiveram um tumor de Grau 1 e 30% tinham Grau 2; 50,5% dos pacientes tinham Ki 67 ? 2% e 29% tiveram um Ki67 entre 2 e 10% (as informações sobre Ki67 não estavam disponíveis em 20% dos pacientes); 52,5% dos pacientes tinham uma carga de tumor hepático ? 10%, 14,5% tinham uma carga de tumor hepático> 10 e ? 25% e 33% tinham uma carga de tumor hepático> 25%.
O tratamento cruzado de placebo para Acetato de Lanreotida (substância ativa), na fase aberta de extensão do estudo, ocorreu em 45,6% (47/103) dos pacientes.
O tratamento mensal com Acetato de Lanreotida (substância ativa) demonstrou uma melhoria estatisticamente significativa na PFS, resultando em uma redução de 53% de progressão ou óbito, quando comparado com o grupo placebo (p = 0,0002). A mediana da PFS para os pacientes tratados com Acetato de Lanreotida (substância ativa) superou 96 semanas, enquanto a mediana da PFS do grupo placebo foi de 72 semanas, como se mostra a Tabela 1 e Figura 1.
Tabela 1: Resultados de eficácia no estudo de fase III:
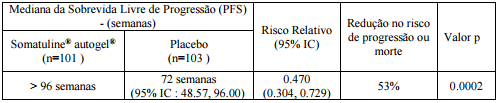 Figura 1: Curva Kaplan-Meier de Progressão da sobrevida:
Figura 1: Curva Kaplan-Meier de Progressão da sobrevida:
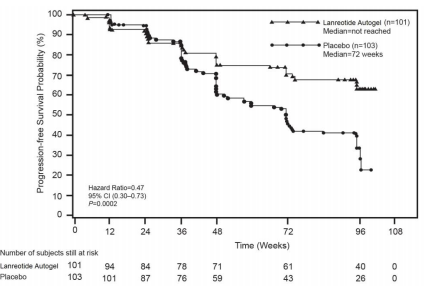
Com base nas curvas de Kaplan-Meier (KM) estima-se que à epoca da última avaliação realizada, 78% dos indivíduos tratados com placebo apresentaram progressão da doença ou tinham evoluido para óbito em comparação com 38% dos indivíduos tratados com Acetato de Lanreotida (substância ativa).
O efeito benéfico de lanreotida na redução do risco de progressão ou óbito foi consistente, independentemente da localização do tumor primário, da carga tumoral hepática, da quimioterapia prévia, do valor basal do Ki67, do grau do tumor ou de outras características pré-determinadas, como mostrado na Figura 2.
Figura 2 – Resultado da Análise de Riscos Proporcionais das Covariáveis na PFS no modelo de Cox:
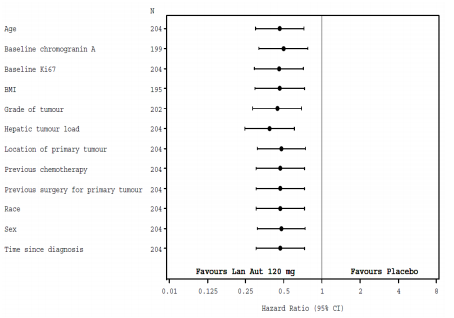
Observação: Todas as razões de risco são riscos relativos para Acetato de Lanreotida (substância ativa) versus placebo. Os resultados para covariáveis são obtidos de modelos separados de Cox nos períodos de tratamento, progressão basal, terapia anterior à entrada no estudo e o tempo desde o diagnóstico.
As alterações no tamanho do tumor também foram avaliadas durante o estudo. Quarenta e nove dos pacientes, no grupo Acetato de Lanreotida (substância ativa) (50,5%) em comparação com 18 dos pacientes do grupo placebo (17,8%), apresentaram diminuição do tumor, em algum momento durante o estudo. Dezoito dos pacientes no grupo Acetato de Lanreotida (substância ativa) (18,6%), em comparação com 20 dos pacientes do grupo placebo (19,8%), apresentaram uma alteração mínima da dimensão do tumor menor do que 1%. Observou-se um aumento no tamanho do tumor em 30 pacientes no grupo tratado com Acetato de Lanreotida (substância ativa) (30,9%) e em 63 pacientes no grupo placebo (62,4%).
Propriedades Farmacocinéticas
Os parâmetros farmacocinéticos intrínsecos da lanreotida, após administração intravenosa em voluntários sadios, indicam limitada distribuição intravascular, com volume de distribuição no estado estacionário de 16,1 L. A depuração total determinada foi de 23,7 L/h, a meia-vida terminal de 1,14 horas e o tempo médio de permanência no organismo de 0,68 horas.
Em estudos para avaliação da excreção, menos de 5% da lanreotida administrada foi excretada na urina, e menos de 0,5% foi recuperada inalterada nas fezes, indicando alguma excreção biliar.
Após administração subcutânea profunda de Acetato de Lanreotida (substância ativa) 60 mg, 90 mg e 120 mg em voluntários saudáveis, as concentrações de lanreotida atingiram concentrações séricas máximas médias de 4,25 / 8,39 / 6,79 ng/mL, respectivamente. Tais valores de Cmáx foram atingidos durante o primeiro dia após a administração, em 8 / 12 / 7 horas (valores médios).
A partir do pico de concentrações séricas máximas, as concentrações séricas de lanreotida diminuíram de acordo com cinética de primeira ordem, com meia-vida de eliminação terminal de 23,3 / 27,4 / 30,1 dias, respectivamente. Quatro semanas após a administração de lanreotida, os níveis séricos médios eram 0,9 / 1,11 / 1,69 ng/mL, respectivamente. A biodisponibilidade absoluta determinada foi 73,4 / 69,0 / 78,4%.
Após a administração subcutânea profunda de Acetato de Lanreotida (substância ativa) 60 mg, 90 mg e 120 mg em pacientes acromegálicos, as concentrações de lanreotida atingiram concentrações séricas máximas médias de 1,6 / 3,5 / 3,1 ng/mL, respectivamente. Tais valores de Cmáx foram atingidos durante o primeiro dia após a administração, em 6 / 6 / 24 horas. A partir do pico de concentrações séricas máximas, as concentrações séricas de lanreotida diminuíram de acordo com cinética de primeira ordem, e quatro semanas após administração de lanreotida, os níveis séricos médios eram 0,7 / 1,0 / 1,4 ng/mL, respectivamente.
As concentrações séricas de estado estacionário foram alcançadas, em média, após 4 injeções, administradas a cada 4 semanas. Após administrações repetidas da mesma posologia a cada 4 semanas, os valores médios de Cmáx no estado estacionário determinados foram 3,8 / 5,7 / 7,7 ng/mL, para lanreotida autogel 60 mg, 90 mg e 120 mg, respectivamente, sendo as médias de valores de Cmín obtidos de 1,8 / 2,5 / 3,8 ng/mL. O índice de variação pico-vale foi moderado, variando de 81 a 108%.
Foram observados perfis de liberação farmacocinética linear após administração subcutânea profunda de Acetato de Lanreotida (substância ativa) 60 mg, 90 mg e 120 mg em pacientes acromegálicos.
Numa análise farmacocinética populacional em 290 pacientes com Tumores Neuroendócrinos Gastroenteropancreáticos (GEP-NET) que receberam Acetato de Lanreotida (substância ativa) 120 mg, a liberação inicial rápida foi vista com valores médios de Cmáx de 7,49 ± 7,58 ng / mL alcançado no primeiro dia após uma única injeção. As concentrações no estado estacionário foram alcançadas após 4 a 5 injeções de Acetato de Lanreotida (substância ativa) 120 mg a cada 28 dias e foram sustentados até a última avaliação (até 96 semanas após a primeira injeção). No estado estacionário os valores médios de Cmáx foi de 13,9 ± 7,44 ng / mL e os níveis séricos médios foram 6,56 ± 1,99 ng / mL. A meia-vida terminal média aparente foi de 49,8 ± 28,0 dias.
informações complementares
| Fabricante |
| BEAUFOUR IPSEN |
| Princípio ativo |
| Acetato de lanreotida |
| Categoria do medicamento |
| Medicamentos Especiais |
