para o que é indicado e para que serve?
Para que serve Lugano é indicado para o tratamento de adultos e crianças acima de 12 anos com asma, nos casos em que o uso de uma associação (corticosteroide inalatório com um beta-2 agonista de ação prolongada) é apropriado.Continue lendo...
ofertas de
Lugano 12+250 Mcg - 60 Cá...
ofertas de Lugano 12+250 Mcg - 60 Cá...
R$ 49,90
R$ 59,90
R$ 99,99
R$ 104,45
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Lugano é indicado para o tratamento de adultos e crianças acima de 12 anos com asma, nos casos em que o uso de uma associação (corticosteroide inalatório com um beta-2 agonista de ação prolongada) é apropriado.
Como este medicamento funciona?
Lugano é um medicamento que contém duas substâncias ativas: propionato de fluticasona e fumarato de formoterol di-hidratado. As duas substâncias são usadas para o tratamento da asma em situações onde a combinação de corticosteroides (como o propionato de fluticasona - que tem ação na redução da inflamação das vias aéreas) e um beta2-agonista de longa duração (fumarato de formoterol di-hidratado - que tem ação broncodilatadora) é apropriada.
Contraindicação
Lugano é contraindicado na presença de hipersensibilidade conhecida a qualquer componente da fórmula.
Lugano é contraindicado em pacientes com tuberculose pulmonar ativa ou quiescente.
Lugano é contraindicado em pacientes portadores de tireotoxicose (aumento dos hormônios da tireoide).
Este medicamento é contraindicado para menores de 12 anos.
Como usar
Dose recomendada para adultos e crianças acima de 12 anos:
A dose recomendada para adultos e crianças maiores de 12 anos é de uma cápsula de Lugano por via oral inalatória duas vezes ao dia, uma pela manhã e outra à noite.
Não existem dados disponíveis para uso em crianças. Não é recomendado para o uso em crianças com menos de 12 anos de idade.
Instruções de uso:
Como usar a cápsula com o inalador
Atenção: Não engolir as cápsulas. Usar exclusivamente para inalação.
Para usar o inalador, proceda do seguinte modo:
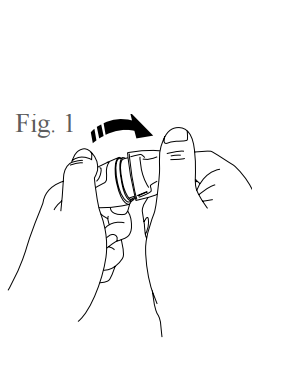
- Retire a tampa do inalador, conforme figura 1.
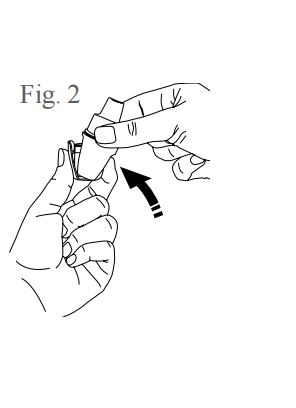
- Abra o compartimento da cápsula: segure nas laterais do inalador e com a outra mão empurre o compartimento pressionando com o dedo o local indicado, conforme figura 2.
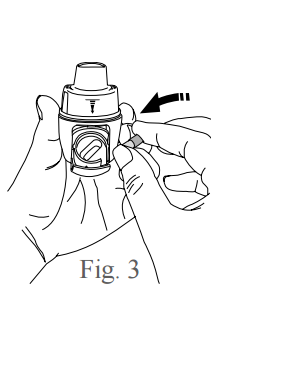
- Mantenha o inalador aberto na posição vertical indicada pela figura 3 e insira a cápsula no seu compartimento, conforme indicado pela figura 4. Certifique-se de que a cápsula está corretamente encaixada.
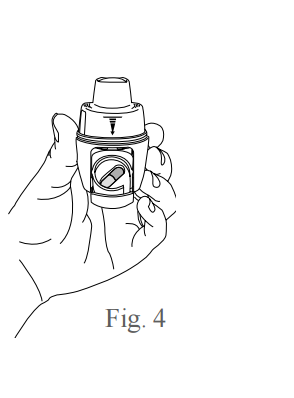
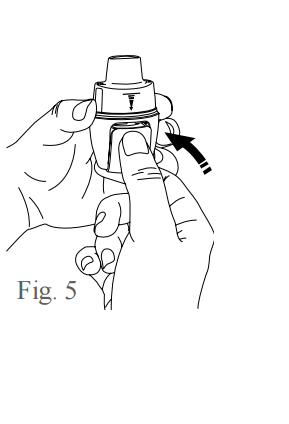
- Para fechar o compartimento da cápsula, mantenha o inalador na posição vertical e empurre para trás o compartimento da cápsula, em um movimento inverso ao de abertura, conforme figura 5. Você ouvirá um click quando o compartimento fechar.
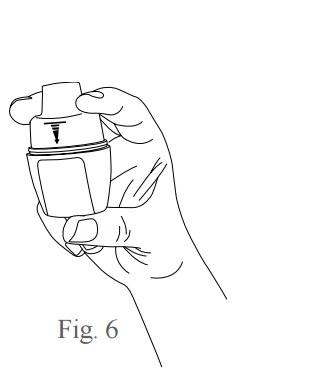
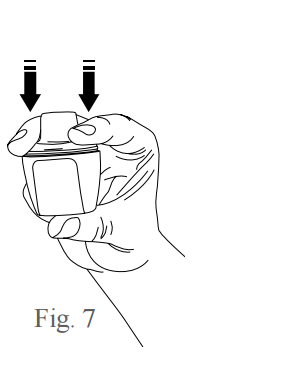
- Para romper a cápsula, segure o inalador na posição vertical, com o polegar sob a base do inalador e os dedos médio e indicador posicionados na lateral do bocal de inalação, conforme figura 6. Pressione o bocal de inalação para baixo firmemente, até que a linha superior da seta indicadora fique totalmente oculta, conforme figura 7. Depois solte o inalador para que o bocal de inalação volte a sua posição original.
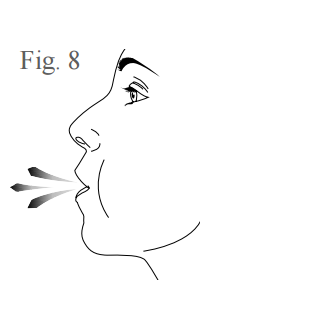
- Antes de inalar o medicamento, primeiramente segure o inalador afastado de sua boca e expire (solte todo o ar), conforme figura 8. Atenção: não sopre no inalador.
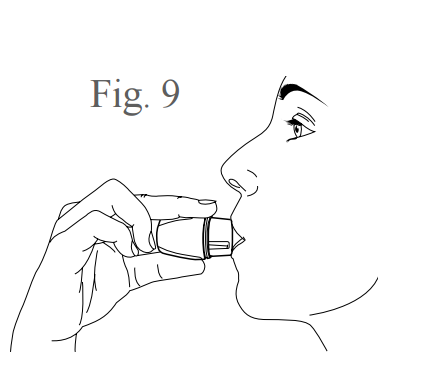
- Para inalação do medicamento, feche firmemente seus lábios ao redor do bocal e inspire (puxe o ar) o mais rápido e profundamente possível, conforme figura 9. Você vai ouvir um som de vibração da cápsula girando dentro da câmara para a dispersão do medicamento.
Atenção: Quando você estiver segurando o inalador durante a inalação, tomar cuidado para não bloquear as entradas de ar localizadas nas laterais do bocal do inalador, pois isto pode impedir a entrada do ar, reduzindo o movimento da cápsula e consequentemente a dispersão do medicamento. Não empurre o bocal para baixo durante a inspiração, pois isto pode bloquear o movimento da cápsula.
- Após inspirar através do inalador, segure sua respiração pelo maior tempo que você confortavelmente conseguir (em geral, 10 segundos são suficientes); enquanto isso retire o inalador da boca. Em seguida, expire pelo nariz. Abra o compartimento da cápsula e verifique se ainda há resíduo de pó na cápsula. Se ainda restar pó na cápsula, repita os passos de 6 a 8.
- Após o uso de todo o pó, abra o compartimento da cápsula (veja passo 2) e remova a cápsula vazia. Utilize um pano seco ou uma escova macia para remover qualquer pó que por ventura restou. Feche o compartimento da cápsula (veja passo 4) e recoloque a tampa.
Obs.: não utilize água para limpar o inalador. Utilizar o inalador por no máximo 3 meses a partir do primeiro uso. - Enxágue bem a sua boca com água, sem engolir, após a administração do medicamento.
Lugano deve ser usado exatamente como prescrito. Não utilize mais doses de Lugano do que o prescrito para você.
Informe ao seu médico se a sua asma piorar ou se não obtiver melhora.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser engolido, partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar este medicamento?
O esquecimento da dose pode comprometer a eficácia do tratamento. Tome a próxima dose no horário habitual recomendado pelo seu médico. Não tome o medicamento 2 vezes para compensar doses esquecidas.
Em caso de dúvidas, procure orientação do farmacêutico, de seu médico, ou cirurgião-dentista.
Precauções
Informe seu médico sobre qualquer medicamento que esteja usando, antes do início ou durante o tratamento. Este medicamento não deve ser utilizado durante a crise aguda de asma (crise de asma que se apresenta em tempo curto e de forma acentuada).
O controle da asma deve ser acompanhado, monitorando assim a resposta ao tratamento através de exame clínico e testes de função pulmonar.
Independentemente da resposta obtida após o uso de Lugano, você deve manter acompanhamento médico.
As cápsulas não devem ser engolidas.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
É recomendável a monitorização da função hepática (do fígado) como medida de precaução.
Reações Adversas
As reações adversas estão classificadas como:
- Reação muito frequente (ocorre em mais de 10% dos pacientes que utilizam este medicamento);
- Reação frequente (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento);
- Reação infrequente (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento);
- Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento);
- Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento).
As reações adversas encontram-se listadas abaixo por classe de sistema orgânico e por frequência:
Infecções e infestações
Reação frequente:
Infecção por um tipo de fungo na boca e na faringe (Candidíase oral e faríngea).
Distúrbios do sistema imune
Reações muito raras:
Reações de alergia na pele, inchaço na face e na boca, falta de ar, fechamento dos brônquios e reação alérgica grave.
Distúrbios endócrinos
Reação frequente:
Alterações no nível do hormônio cortisol no sangue.
Reações muito raras:
Síndrome de Cushing (síndrome causada pelo aumento por muito tempo do hormônio chamado cortisol), supressão da função da glândula adrenal, retardo do crescimento, redução da densidade do osso, alteração da visão (catarata) e aumento da pressão dentro do olho (glaucoma).
Distúrbios do metabolismo e nutrição
Reação frequente:
Náusea.
Reação muito rara:
Aumento dos níveis de glicose (açúcar) no sangue.
Distúrbios psiquiátricos
Reações frequentes:
Tremor, tontura e dor de cabeça.
Reações muito raras:
Ansiedade, distúrbios do sono e alterações comportamentais, incluindo hiperatividade e irritabilidade (predominantemente em crianças).
Distúrbios respiratórios, torácicos e mediastínicos
Reação frequente:
Rouquidão.
Reação rara:
Broncoespasmo paradoxal (fechamento dos brônquios).
Atenção: este produto é um medicamento que possui nova associação no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
População Especial
Gravidez e lactação
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
Cada cápsula de Lugano contém:
| Fumarato de formoterol di-hidratado | 12mcg |
| Propionato de fluticasona | 250mcg |
| Excipientes q.s.p. | 1 cápsula |
Excipientes: lactose monoidratada.
Superdosagem
Se acidentalmente você utilizar mais Lugano do que seu médico prescreveu, você pode apresentar os seguintes sintomas: tremores, cefaleia (dor de cabeça), palpitações (percepção incomum dos batimentos cardíacos) e taquicardia (aumento da frequência cardíaca). Também podem ocorrer hipotensão (pressão baixa), hipocalemia (concentração inferior ao normal de íons de potássio no sangue) e hiperglicemia (concentração elevada de glicose no sangue circulante) além de supressão temporária da função da glândula adrenal. Informe seu médico ou vá ao pronto socorro imediatamente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
São baixas as concentrações plasmáticas alcançadas do propionato de fluticasona após a inalação, devido ao efeito do metabolismo de primeira passagem e do alto clearence sistêmico pelo citocromo P450. Desse modo, é pouco provável interações medicamentosas clinicamente significativas.
Um estudo de interação medicamentosa em voluntários sadios mostrou que ritonavir (potente inibidor do citocromo P450 3A4) pode aumentar significativamente a concentração plasmática do propionato de fluticasona, gerando-se concentrações séricas de cortisol bastante reduzidas. Houve relatos de interações medicamentosas clinicamente significativas em pacientes que receberam propionato de fluticasona intranasal ou inalatório e ritonavir, o que resultou em efeitos corticosteroides sistêmicos, como síndrome de Cushing e supressão adrenal.
O uso concomitante de propionato de fluticasona e ritonavir deve ser evitado, a menos que os benefícios potenciais ao paciente sejam maiores que o risco de efeitos colaterais corticosteroides sistêmicos.
Outros estudos demonstraram que outros inibidores do citocromo P450 3A4 (eritromicina e cetoconazol) produzem discreto aumento da exposição sistêmica ao propionato de fluticasona, sem reduções séricas notáveis na concentração de cortisol. É necessário cuidado ao coadministrar inibidores potentes do citocromo P450 3A4 (p. ex., cetoconazol), já que há potencial de aumento da exposição sistêmica ao propionato de fluticasona.
O formoterol constante na associação dose fixa formoterol/fluticasona, como outros beta2-agonistas, deve ser administrado com cautela em pacientes tratados com fármacos com quinidina, disopiramida, procainamida, fenotiazínicos, anti-histamínicos, inibidores de monoaminoxidase e antidepressivos tricíclicos ou qualquer outro fármaco que prolongue o intervalo QT do eletrocardiograma, pois a ação dos agonistas adrenérgicos no sistema cardiovascular pode ser potencializada por estes agentes. Os fármacos que são conhecidos por prolongar o intervalo QT tem um risco aumentado de arritmia ventricular. O tratamento concomitante com inibidores da monoaminoxidase (IMAO), incluindo agentes com propriedades semelhantes, como furazolidona e procarbazina, pode precipitar reações hipertensivas.
A administração concomitante de outros agentes simpatomiméticos pode potencializar os efeitos não desejados da associação dose fixa formoterol/fluticasona.
O tratamento concomitante com derivados xantínicos, esteroides ou diuréticos pode potencializar o possível efeito hipocalêmico dos beta2-agonistas. A hipocalemia pode aumentar a suscetibilidade a arritmias cardíacas em pacientes tratados com digitálicos.
Os bloqueadores beta-adrenérgicos podem diminuir ou antagonizar o efeito do formoterol presente na combinação dose fixa de formoterol/ fluticasona. Portanto, não deve ser administrado juntamente com bloqueadores beta-adrenérgicos (inclusive colírios), a não ser que existam razões que obriguem seu uso.
As alterações do eletrocardiograma e/ ou hipocalemia que possam resultar da administração de diuréticos não poupadores de potássio (como diuréticos de alça ou tiazídicos) podem ser agravadas por beta-agonistas, especialmente quando a dose recomendada de beta-agonista é excedida. Recomenda-se cautela na coadministração de um beta-agonista com diuréticos não poupadores de potássio.
Os derivados da xantina e glicocorticoides podem potencializar o efeito hipocalêmico dos beta-agonistas.
Além disso, L-dopa, L-tiroxina oxitocina e álcool pode reduzir a tolerância cardíaca aos beta2 simpaticomiméticos.
Há um risco elevado de arritmias em pacientes que recebem anestesia concomitante com hidrocarbonetos halogenados.
Ação da Substância
Resultados de Eficácia
A segurança e a eficácia deste medicamento Fumarato de Formoterol Di-Hidratado + Propionato de Fluticasona (substância ativa) foram avaliadas em um estudo de fase III, randomizado, aberto, com três braços de tratamento que comparou a associação formoterol/fluticasona (este medicamento), formoterol/budesonida (medicamento comparador) e o corticosteroide inalado fluticasona (medicamento comparador) em 243 pacientes durante 12 semanas. Os pacientes considerados elegíveis apresentavam diagnóstico de asma persistente, em uso de corticosteroide inalatório, associado ou não a ?2-adrenérgico de longa duração e medicamentos de alívio.
Após a estratificação, de acordo com o centro de pesquisa e gravidade da asma, os pacientes foram randomizados na razão 1:1:1 para receber a combinação de formoterol 12 ?g e budesonida 400 ?g (cápsulas separadas, formoterol/budesonida medicamento comparador), fluticasona 500 ?g (dispositivo multidose, medicamento comparador) ou a nova associação (formoterol 12 ?g/fluticasona 250 ?g, cápsula inalatória única, este medicamento). As populações com intenção de tratar (ITT) e por protocolo (PP) foram constituídas por 235 e 195 indivíduos, respectivamente.
O desfecho primário foi a avaliação do valor do volume expiratório forçado em 1 segundo (VEF1) antes do uso do broncodilatador na visita final do estudo (VF) para demonstrar a não-inferioridade deste medicamento Fumarato de Formoterol Di-Hidratado + Propionato de Fluticasona (substância ativa) vs formoterol/budesonida (medicamento comparador).
Os desfechos secundários foram: VEF1 na VF, considerando?se as comparações de não?inferioridade e de superioridade deste medicamento Fumarato de Formoterol Di-Hidratado + Propionato de Fluticasona (substância ativa) vs formoterol/budesonida (referência); o escore no Questionário de Controle de Asma (ACQ?7) ao final do estudo; pico de fluxo expiratório (PFE) ao longo do estudo; o escore de sintomas (controle da asma) ao final do estudo; VEF1 ao longo do estudo; a avaliação do uso dos inaladores; a aderência ao uso dos inaladores; a aceitabilidade e preferência do tipo de inalador utilizado; o uso de medicação de resgate.
A análise primária de eficácia, realizada considerando?se o desfecho primário na população por protocolo, demonstrou a não?inferioridade do produto formoterol/fluticasona (este medicamento) em relação a formoterol/budesonida (comparador). Com relação aos desfechos secundários de eficácia, os produtos formoterol/fluticasona (este medicamento), formoterol/budesonida (comparador) e fluticasona (comparador) apresentaram desempenho semelhante para a maioria dos desfechos secundários (incluindo VEF1 [L] ao longo do estudo, VEF1 % na VF e ao longo do estudo, controle da asma, e avaliação do uso de inaladores), testados em análises feitas na população PP e na ITT comparando os três grupos.
Características Farmacológicas
Este medicamento Fumarato de Formoterol Di-Hidratado + Propionato de Fluticasona (substância ativa) pertence ao grupo farmacoterapêutico das drogas adrenérgicas em combinação com corticosteroides ou outras drogas (código ATC: R03AK11).
Propriedades Farmacodinâmicas
Este medicamento contém propionato de fluticasona e fumarato de formoterol di-hidratado. Os mecanismos de ação são descritos abaixo para os componentes individuais. Estas drogas representam duas classes de medicamentos: um corticosteroide sintético e um beta2-agonista seletivo de longa ação do receptor adrenérgico.
Propriedades Farmacocinéticas
Dados de segurança pré-clínicos
A toxicidade observada em estudos em animais com fumarato de formoterol e o propionato de fluticasona, administrados em combinação fixa ou separadamente, consistiu-se principalmente de efeitos associados à atividade farmacológica exagerada.
Efeitos sobre o sistema cardiovascular estão relacionados com a administração de formoterol incluindo taquicardia, arritmia e lesões do miocárdio. Após a administração da combinação não foi observado aumento de toxicidade e não houve ocorrência de descobertas inesperadas.
Cuidados de Armazenamento
Conservar em temperatura ambiente (entre 15 e 30oC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
A cápsula de Lugano apresenta-se com corpo incolor e tampa rosa contendo granulado branco a quase branco, isento de partículas estranhas.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Venda sob prescrição médica.
M.S.: 1.0043.1173
Farm. Resp.:
Dra. Maria Benedita Pereira- CRF-SP n°.: 30.378
Fabricado por:
Eurofarma Laboratórios SA
Rod. Pres. Castello Branco, km 35,6
Itapevi - SP
Registrado por:
Eurofarma Laboratórios SA
Av. Ver. José Diniz, 3.465 - São Paulo - SP
CNPJ 61.190.096/0001-92
Indústria Brasileira.
informações complementares
| Fabricante |
| EUROFARMA |
| Princípio ativo |
| Fumarato de formoterol di-hidratado + Propionato de fluticasona |
| Categoria do medicamento |
| Medicamentos de A-Z |
