para o que é indicado e para que serve?
Para que serve Marevan é indicado para a prevenção primária e secundária do tromboembolismo venoso (formação de trombos ou coágulos de sangue, dentro de uma veia, capazes de obstruir parcial ou totalmente o vaso sanguíneo), na prevenção do embolismo sistêmico em pacientes com prótese de válvulas cardíacas ou fibrilação atrial e na prevenção do acidente vascular cerebral (AVC, derrame), do infarto agudo do miocárdio e da recorrência do infarto.Continue lendo...
ofertas de Marevan - 5Mg 10 Comprimidos

R$ 7,50
Ir para a lojaR$ 8,49
Ir para a lojaR$ 9,22
Ir para a lojaR$ 9,37
Ir para a lojaATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Marevan é indicado para a prevenção primária e secundária do tromboembolismo venoso (formação de trombos ou coágulos de sangue, dentro de uma veia, capazes de obstruir parcial ou totalmente o vaso sanguíneo), na prevenção do embolismo sistêmico em pacientes com prótese de válvulas cardíacas ou fibrilação atrial e na prevenção do acidente vascular cerebral (AVC, derrame), do infarto agudo do miocárdio e da recorrência do infarto.
Os anticoagulantes orais também estão indicados na prevenção do embolismo sistêmico em pacientes com doença valvular cardíaca.
Como o Marevan funciona?
A varfarina sódica, princípio ativo de Marevan, é um anticoagulante que age na inibição dos fatores de coagulação dependentes da vitamina K.
O objetivo da terapia com anticoagulante é reduzir a capacidade de coagulação do sangue, de modo a evitar a trombose e, ao mesmo tempo, evitar a ocorrência de sangramento espontâneo.
A varfarina é rápida e completamente absorvida após a administração oral de Marevan.
Seu início de ação anticoagulante, no entanto, só se verifica 24 a 72 horas após a administração oral, e seu efeito anticoagulante máximo pode ocorrer em 72 a 96 horas. A duração da ação de uma única dose de Marevan é de 2 a 5 dias.
Contraindicação
Você não deve usar Marevan nas seguintes situações:
- Primeiras 24 horas antes ou após cirurgia ou parto;
- Gravidez, especialmente durante o primeiro trimestre, devido à possibilidade de má-formação fetal. A administração a gestantes em estágios mais avançados está associada à hemorragia fetal e aumento na taxa de aborto;
- Aborto incompleto;
- Doenças hepáticas ou renais graves;
- Hemorragias;
- Hipertensão arterial grave não controlada;
- Endocardite bacteriana (inflamação da camada mais interna do coração causada por bactérias que entraram na circulação sanguínea);
- Aneurisma cerebral ou aórtico;
- Hemofilia;
- Doença ulcerativa ativa do trato gastrointestinal;
- Feridas ulcerativas abertas;
- Hipersensibilidade (alergia) a qualquer um dos componentes da fórmula.
Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento. A varfarina é reconhecidamente teratogênica.
Como usar
A posologia de Marevan deve ser individualizada para cada paciente, de acordo com a resposta de TP/RNI (valores obtidos através de exames de sangue) do paciente ao medicamento.
Dosagem inicial:
Recomenda-se que a terapia com Marevan seja iniciada com uma dose de 2,5 mg a 5 mg ao dia, com ajustes posológicos baseados nos resultados de TP/RNI.
Manutenção:
Na maioria dos pacientes, a resposta é satisfatoriamente mantida com uma dose de 2,5 a 10 mg ao dia. A flexibilidade da dosagem pode ser obtida partindo-se os comprimidos ao meio.
A duração da terapia para cada paciente deve ser individualizada. De modo geral, a terapia com anticoagulante deve ser continuada até que o risco de trombose e embolia seja eliminado.
Este medicamento foi prescrito pelo médico para você. Por isso, nunca o administre a outra pessoa, pois pode ser prejudicial a ela, ainda que os sintomas sejam iguais.
A dose do medicamento depende dos resultados de exames de sangue que você deverá fazer periodicamente, orientado por seu médico.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Marevan?
O efeito anticoagulante de Marevan persiste por mais de 24 horas. Caso você se esqueça de tomar a dose prescrita de Marevan no horário marcado, tomar no mesmo dia, assim que possível. No dia seguinte, a dose esquecida não deve ser adicionalmente ingerida e o tratamento deve ser seguido normalmente. A dose nunca deve ser duplicada.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
- Marevan não deve ser administrado a pacientes que apresentem sangramento ativo e, em geral, o médico não deve prescrever a pacientes com risco de hemorragia, embora possa ser usado com extrema precaução.
- Os idosos e pacientes com deficiência de vitamina K requerem cuidado especial, assim como aqueles com hipertireoidismo.
- Se ocorrerem complicações hemorrágicas graves, deve-se interromper imediatamente a administração do Marevan.
- Em caso de suspeita de alteração do efeito de Marevan, seu médico deverá monitorar, cuidadosamente, a sua atividade anticoagulante, a fim de se aumentar ou diminuir a sua dose, se necessário.
- Se houver perda ou ganho de peso, o médico deve ser informado, a fim de verificar a necessidade de ajuste de dosagem.
- Caso ocorra qualquer indisposição ou sintoma de causa desconhecida, o paciente deverá entrar em contato imediatamente com o médico.
Reações Adversas
Hemorragia de menor ou maior intensidade pode ocorrer durante a terapia com Marevan, em qualquer tecido ou órgão, manifestando-se como sangramento externo ou interno, associado a sintomas e complicações dependentes do órgão ou sistema afetado.
Pode ocorrer também necrose da pele e de outros tecidos, êmbolos aterotrombóticos sistêmicos e microêmbolos de colesterol.
Algumas complicações hemorrágicas podem apresentar sinais e sintomas que não são imediatamente identificados como resultantes da hemorragia.
Estas reações adversas estão marcadas na tabela abaixo com um asterisco (*).
| Classe de sistemas de órgãos | Termo do MedDRA |
| Desordens do sistema linfático e sanguíneo | Anemia* |
| Desordens cardíacas | Dor no peito*, hemorragia pericárdica |
| Desordens endócrinas | Hemorradia da suprarrenal |
| Desordens oculares | Hemorragia ocular |
| Desordens gastrointestinais | Distensão abdominal, dor abdominal*, diarreia, disgeusia, disfagia*, flatulência, sangramento gengival, hematêmese, hematoquezia, melena, hemorragia retal, hemorragia retroperitonial, vômito |
| Desordens gerais e condições no local de administração | Astenia*, calafrios, fadiga*, mal-estar*, dor*, palidez*, inchaço* |
| Desordens hepatobiliares | Hemorragia hepática, hepatite |
| Desordens do sistema imune | Reação anafilática, hipersensibilidade |
| Sistema musculoesquelético, tecido conjuntivo e desordens ósseas | Artralgia*, hemartrose, mialgia* |
| Desordens do sistema nervoso | Tonturas*, cefaleias*, hemorragia intracraniana, parestesia*, paralisia*, hematoma espinhal |
| Desordens psiquiátricas | Letargia |
| Desordens urinárias | Hematúria |
| Desordens do sistema reprodutor e mama | Menorragia, hemorragia vaginal |
| Desordens respiratórias torácicas e mediastinais | Epistaxe, dispneia*, hemoptise, hemotórax, hemorragia pulmonar alveolar, calcificação pulmonar |
| Desordens do tecido subcutâneo e pele | Alopecia, dermatite, dermatite bolhosa, petéquias, prurido, erupção cutânea, necrose da pele, urticária |
| Desordens vasculares | Síndrome dos dedos roxos*, embolismo arterial, embolia gordurosa, hemorragia, hipotensão*, necrose, choque*, síncope*, vasculite |
(*) Sintomas ou condições médicas resultantes de complicações hemorrágicas.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe também a empresa através do seu serviço de atendimento.
População Especial
Gravidez
Se administrado no primeiro trimestre da gravidez, Marevan pode causar pontilhado ósseo no feto e anormalidades faciais e do sistema nervoso central, que também podem se desenvolver após administração no segundo e terceiro trimestres. A administração a gestante, em estágios mais avançados da gravidez, está associada à hemorragia fetal e aumento da taxa de aborto.
Idosos
A administração de varfarina em idosos deve ser realizada com muita cautela e monitoramento frequente.
Lactação (amamentação)
Embora a varfarina não tenha sido detectada no leite humano, a possibilidade de um efeito indesejável deste medicamento no lactente (criança que está sendo amamentada) não pode ser descartada.
Caso você esteja amamentando, informe ao seu médico, pois as crianças devem ser monitoradas quanto ao aparecimento de hematomas e sangramentos.
Composição
Cada comprimido de 2,5 mg contém:
Varfarina sódica: 2,5 mg
Excipientes: lactose monoidratada, amarelo de quinolina, amido, amidoglicolato de sódio, estearato de magnésio e água.
Cada comprimido de 5 mg contém:
Varfarina sódica: 5 mg
Excipientes: lactose monoidratada, corante vermelho ponceau 4R, amido, amidoglicolato de sódio, estearato de magnésio e água
Cada comprimido de 7,5 mg contém:
Varfarina sódica: 7,5 mg
Excipientes: lactose monoidratada, corante azul FDC nº 1, amido, amidoglicolato de sódio, estearato de magnésio e água.
Superdosagem
Em caso de superdose deve-se procurar orientação médica, através de seu médico ou de algum serviço hospitalar imediatamente.
Um dos sintomas que pode ocorrer após uma superdose é hemorragia de qualquer tecido ou órgão. Os sinais e sintomas variam de acordo com a localização e extensão do sangramento.
A possibilidade de hemorragia deve ser considerada em qualquer paciente sob terapia anticoagulante que sofra quedas, quando não houver um diagnóstico óbvio.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interação medicamento-medicamento
Deve-se ter cuidado no uso em conjunto de qualquer fármaco em pacientes recebendo tratamento com anticoagulante oral.
A atividade da Varfarina Sódica (substância ativa) pode ser potencializada por:
Esteroides anabólicos (como: etilestranol, metandrostenolona, noretrandolona), amiodarona, amitriptilina/nortriptilina, azapropazona, aztreonam, benzafibrato, cefamandol, cloranfenicol, hidrato de coral, cimetidina, ciprofloxacino, clofibrato, cotrimoxazol, danazol, destropropoxifeno, destrotiroxina, dipiridamol, eritromicina, neomicina, feprazona, fluconazol, glucagon, metronidazol, miconazol, oxifenilbutazona, fenformina, fenilbutazona, feniramidol, quinidina, salicilatos, tolbutamida, sulfonamidas (ex: sulfafenazol, sulfinpirazona), tamoxifeno, triclofos, diflunisal, flurbiprofeno, indometacina, ácido mefenâmico, piroxicam, sulindaco e, possivelmente, outros analgésicos anti-inflamatórios, cetoconazol, ácido nalidíxico, norfloxacino, tetraciclinas e outros antibióticos de largo espectro, alopurinol, dissulfiram, metilfenidato, paracetamol, fármacos para tratamento de disfunções da tireoide e qualquer fármaco potencialmente tóxico ao fígado.
Mulheres em uso de Varfarina Sódica (substância ativa) devem consultar o médico antes do uso concomitante de creme vaginal ou supositório de miconazol, pois pode haver potencialização do efeitoanticoagulante.
Tanto a potencialização quanto a inibição do efeito anticoagulante têm sido relatadas com fenitoína, ACTH e corticosteroides.
A colestiramina e o sulcralfato acarretam diminuição da atividade da Varfarina Sódica (substância ativa). A colestiramina pode também diminuir a absorção de vitamina K sem, no entanto, aumentar a atividade anticoagulante da Varfarina Sódica (substância ativa). O efeito anticoagulante pode ser diminuído pela administração de vitamina K, inclusive como constituinte de alguns alimentos, como saladas verdes.
A atividade anticoagulante da Varfarina Sódica (substância ativa) pode ser inibida por alguns fármacos, tais como:
Aminoglutetimida, barbiturato, carbamazepina, etclorvinol, glutatimida, griseofulvina, dicloralfenazona, primidona, rifampicina e contraceptivos orais.
Interação medicamento-substância
A atividade anticoagulante pode também ser aumentada com grandes quantidades ou ingestão crônica de álcool, particularmente em pacientes com insuficiência hepática.
Interação medicamento-exame laboratorial
Com exceção dos exames relacionados aos fatores da coagulação dependentes da vitamina K, que são deprimidos pela Varfarina Sódica (substância ativa), não há referência de interferência significativa com outros exames laboratoriais.
Interação Alimentícia
Alimentos contendo vitamina K alteram a eficácia anticoagulante.
Ação da Substância
Resultados de eficácia
Fibrilação Atrial (FA)
Em cinco estudos clínicos prospectivos, randomizados e controlados, envolvendo 3.711 pacientes com FA não reumática, a Varfarina Sódica (substância ativa) sódica reduziu significativamente o risco de tromboembolismo sistêmico, incluindo acidente vascular cerebral (vide Tabela 1). A redução do risco variou de 60% a 86% em todos os estudos clínicos, exceto em um (CAFA: 45%), que foi interrompido prematuramente devido aos resultados positivos publicados de dois desses estudos. A incidência de sangramentos importantes nesses estudos clínicos variou de 0,6 a 2,7% (vide Tabela 1).
Tabela 1: Estudos clínicos sobre a Varfarina Sódica (substância ativa) sódica em pacientes com FA não reumática*:

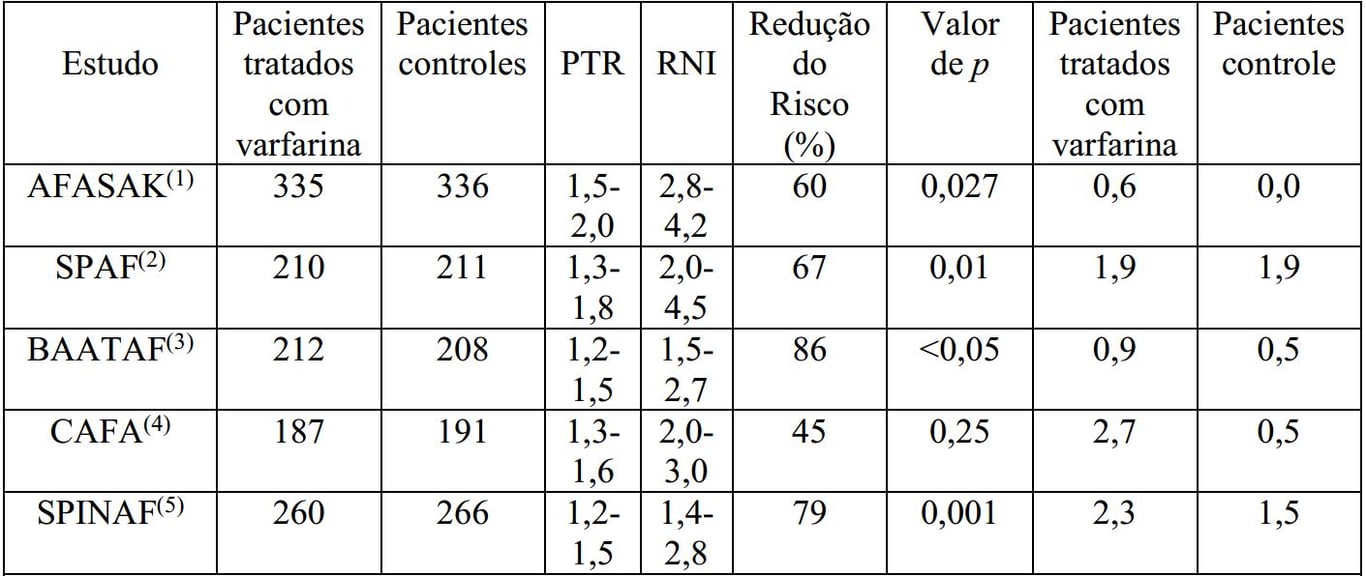
*Todos os resultados dos estudos com a Varfarina Sódica (substância ativa) versus controle se basearam na análise por intenção-de-tratar; incluíram acidente vascular cerebral sistêmico e tromboembolismo sistêmico e excluíram acidente vascular cerebral hemorrágico e ataque isquêmico transitório.
PTR = (prothrombin ratio, relação de protrombina); RNI = Razão (ou Índice) de Normalização Internacional.
Estudos em pacientes com FA e estenose mitral sugerem um benefício anticoagulante com o uso de Varfarina Sódica (substância ativa).
Infarto do Miocárdio
O estudo WARIS (Estudo de Recidiva de Infarto com Varfarina Sódica (substância ativa)) foi um estudo duplo-cego, randomizado, envolvendo 1.214 pacientes, em duas a quatro semanas após o infarto, tratados com Varfarina Sódica (substância ativa) até uma RNI-alvo de 2,8 a 4,8. O desfecho primário foi uma combinação entre a mortalidade total e a recidiva de infarto. Foi avaliado um desfecho secundário de eventos vasculares cerebrais. O tempo médio de acompanhamento dos pacientes foi de trinta e sete meses. Os resultados de cada desfecho separadamente, incluindo uma análise de morte vascular, são apresentados na Tabela 2.
Tabela 2: Análise dos desfechos de eventos separados:
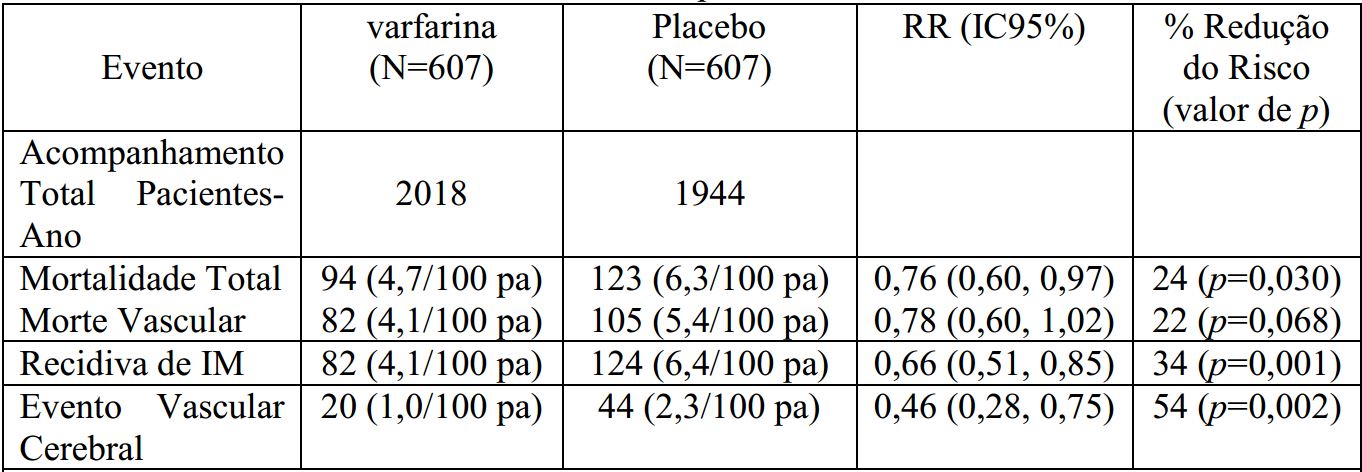
RR = Risco Relativo; Redução do risco = (1-RR); IC = Intervalo de Confiança; IM = Infarto do Miocárdio; pa = pacientes-ano.
Válvulas Cardíacas Mecânicas e Bioprotéticas
Em um estudo prospectivo, randomizado, aberto e de controle positivo, envolvendo 254 pacientes com válvulas cardíacas mecânicas e protéticas, o intervalo sem ocorrência de tromboembolismo foi considerado significantemente maior nos pacientes tratados com Varfarina Sódica (substância ativa) sódica isoladamente, em comparação aos pacientes tratados com a associação dipiridamol ácido acetilsalicílico (p<0,005) e pentoxifilina/ácido acetilsalicílico (p<0,05) (vide Tabela 3).
Tabela 3 - Estudo clínico prospectivo, randomizado, aberto e de controle positivo, de Varfarina Sódica (substância ativa) sódica em pacientes com válvulas cardíacas mecânicas protéticas:
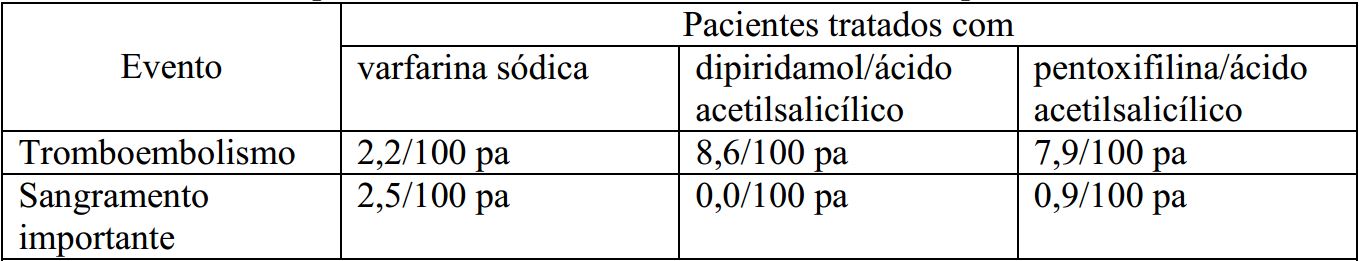
Pa = paciente por ano?.
Em um estudo clínico prospectivo aberto, comparando a terapia de intensidade moderada (RNI de 2,65) versus a terapia de alta intensidade (RNI de 9,0) com Varfarina Sódica (substância ativa) sódica, em 258 pacientes portadores de válvulas cardíacas mecânicas protéticas, os casos de tromboembolismo ocorreram com frequência semelhante nos dois grupos (4,0 e 3,7 eventos/100 pacientes-ano, respectivamente). O sangramento importante foi mais comum no grupo de alta intensidade (vide Tabela 4).
Tabela 4 - Estudo clínico prospectivo e aberto de Varfarina Sódica (substância ativa) em pacientes com válvulas cardíacas mecânicas protéticas
| Evento | Terapia de intensidade moderada com Varfarina Sódica (substância ativa) (RNI 2,65) | Terapia de alta intensidade com Varfarina Sódica (substância ativa) (RNI 9,0) |
| Tromboembolismo | 4,0/100 pa | 3,7/100 pa |
| Sangramento importante | 0,95/100 pa | 2,1/100 pa |
Pa = paciente por ano.
Em um estudo clínico randomizado com 210 pacientes, comparando dois tratamentos de intensidades diferentes com Varfarina Sódica (substância ativa) sódica (RNI de 2,0 a 2,25 versus RNI 2,5 a 4,0) por um período de três meses após a substituição do tecido da válvula cardíaca, os casos de tromboembolismo ocorreram com uma frequência semelhante nos dois grupos (eventos embólicos importantes 2,0% versus 1,9%, respectivamente, e eventos embólicos menores 10,8% versus 10,2%, respectivamente). Hemorragias importantes ocorreram em 4,6% dos pacientes na terapia de maior intensidade, quando comparadas a nenhuma complicação na terapia de menor intensidade.
Características farmacológicas
Farmacodinâmica
A Varfarina Sódica (substância ativa) atua inibindo a síntese de fatores de coagulação dependentes da vitamina K, incluindo os fatores II, VII, IX e X, e as proteínas anticoagulantes C e S. A vitamina K é um cofator essencial para a síntese pós-ribossômica dos fatores de coagulação dependentes dela. A vitamina K promove a biossíntese de resíduos do ácido gama-carboxiglutâmico nas proteínas que são essenciais para a atividade biológica. Supõe-se que a Varfarina Sódica (substância ativa) interfira na síntese do fator de coagulação através da inibição, redução e regeneração da vitamina K1-epóxido.
O efeito de anticoagulação geralmente ocorre em vinte e quatro horas após a administração de Varfarina Sódica (substância ativa) sódica. No entanto, a ocorrência do efeito anticoagulante máximo pode demorar de setenta e duas a noventa e seis horas. A duração da ação de uma dose única de Varfarina Sódica (substância ativa) é de dois a cinco dias. Seus efeitos podem se tornar mais evidentes com a manutenção do tratamento, de acordo com a sobreposição dos efeitos de cada dose administrada.
O efeito da Varfarina Sódica (substância ativa) sódica depende diretamente das meias-vidas dos fatores de coagulação dependentes de vitamina K e proteínas anticoagulantes afetadas: Fator II: sessenta horas, VII: quatro a seis horas, IX: vinte e quatro horas e X: quarenta e oito a setenta e duas horas, e proteínas C e S são de, aproximadamente, oito e trinta horas, respectivamente.
Farmacocinética
Absorção
A Varfarina Sódica (substância ativa) é praticamente absorvida por completo após a administração oral, sendo a concentração sérica máxima geralmente atingida nas primeiras quatro horas.
Distribuição
A Varfarina Sódica (substância ativa) tem um volume de distribuição aparente relativamente pequeno, de 0,14L/kg aproximadamente. A fase de distribuição, que dura de seis a doze horas, pode ser percebida após a administração oral de uma solução aquosa. Aproximadamente 99% da droga é ligada às proteínas plasmáticas.
Metabolismo
A Varfarina Sódica (substância ativa) é estereosseletivamente metabolizada por enzimas microssômicas hepáticas do citocromo P-450 (CYP450) em metabólitos hidroxilados inativos (via predominante), e por redutases em metabólitos reduzidos (álcoois de Varfarina Sódica (substância ativa)), com atividade anticoagulante mínima. Os metabólitos da Varfarina Sódica (substância ativa) identificados incluem a d-hidro Varfarina Sódica (substância ativa), dois álcoois diastereoisômeros e 4-, 6-, 7-, 8- e 10-hidroxiVarfarina Sódica (substância ativa). As isoenzimas do citocromo P-450 envolvidas no metabolismo da Varfarina Sódica (substância ativa) incluem a 2C9, 2C19, 2C8, 2C18, 1A2 e 3A4. O CYP2C9, uma enzima polimórfica, é provavelmente a principal forma do P-450 hepático humano que modula a atividade anticoagulante in vivo da Varfarina Sódica (substância ativa). Pacientes com uma ou mais variações dos alelos da isoenzima 2C9 apresentam um clearance da S-Varfarina Sódica (substância ativa) diminuído.
Excreção
A meia-vida terminal da Varfarina Sódica (substância ativa) após uma dose única é, aproximadamente, uma semana. No entanto, a meia-vida efetiva varia de vinte a sessenta horas, com uma média de aproximadamente quarenta horas. O clearance da R-Varfarina Sódica (substância ativa) é geralmente metade do clearance da S-Varfarina Sódica (substância ativa). Assim, uma vez que os volumes de distribuição são semelhantes, a meia-vida da R-Varfarina Sódica (substância ativa) é maior que a da S-Varfarina Sódica (substância ativa). A meia-vida da R-Varfarina Sódica (substância ativa) varia de trinta e sete a oitenta e nove horas, ao passo que a meia-vida da S-Varfarina Sódica (substância ativa) varia de vinte e uma a quarenta e três horas. Estudos com a droga marcada radioativamente demonstraram que até 92% da dose administrada por via oral é recuperada na urina, principalmente sob a forma de metabólitos. Uma quantidade muito pequena de Varfarina Sódica (substância ativa) não metabolizada é excretada na urina. A excreção urinária ocorre na forma de metabólitos.
Pacientes Idosos
Os pacientes com idade igual ou superior a 60 anos parecem apresentar uma resposta de Razão Normalizada Internacional (RNI) maior que a esperada para os efeitos anticoagulantes da Varfarina Sódica (substância ativa). A causa do aumento da sensibilidade aos efeitos anticoagulantes da Varfarina Sódica (substância ativa) nessa faixa etária é desconhecida, mas pode ser devida à combinação de fatores farmacocinéticos e farmacodinâmicos. Informações limitadas sugerem que não há diferença no clearance da S-Varfarina Sódica (substância ativa). No entanto, pode haver uma discreta redução no clearance da R-Varfarina Sódica (substância ativa) nos pacientes idosos em comparação com os jovens. Portanto, conforme a idade do paciente aumenta, é geralmente necessária uma dose menor de Varfarina Sódica (substância ativa) para que se atinja um nível terapêutico de anticoagulação.
Disfunção Renal
Pacientes com disfunção renal têm maior propensão para diátese hemorrágica. Pacientes com disfunção renal que fazem tratamento com Varfarina Sódica (substância ativa) devem monitorar a RNI cuidadosamente.
Disfunção Hepática
A disfunção hepática pode potencializar a resposta à Varfarina Sódica (substância ativa) através do comprometimento da síntese dos fatores de coagulação e da redução do metabolismo da Varfarina Sódica (substância ativa).
Cuidados de Armazenamento
Cuidados de conservação
Marevan deve ser conservado em temperatura ambiente (entre 15° e 30°C), em sua embalagem original.
Proteger da umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
- Marevan 2,5 mg: Comprimido amarelo, redondo, plano, chanfrado, sulcado em forma de cruz em uma das faces Livre de partículas estranhas Odor característico.
- Marevan 5 mg: Comprimido circular, de coloração rosada, plano, chanfrado, sulcado em forma de cruz em uma das faces Livre de partículas estranhas Odor característico
- Marevan 7,5 mg: Comprimido circular, de cor azul, plano, chanfrado, sulcado em forma de cruz em uma das faces Livre de partículas estranhas Odor característico.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Mensagens de Alerta
Informe ao seu médico se estiver amamentando.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS: 1.0390.0147
Farm. Resp: Dra. Marcia Weiss I. Campos
CRF-RJ n° 4499
Registrado por:
Farmoquímica S/A
Av. José Silva de Azevedo Neto, 200,
Bloco 1, 1° andar, salas 101 a 104 e 106 a 108.
Rio de Janeiro – RJ
CNPJ: 33.349.473/0001-58
Fabricado por:
Farmoquímica S/A
Rua Viúva Cláudio, 300 Rio de Janeiro - RJ
CNPJ: 33.349.473/0003-10
Indústria brasileira
informações complementares
| Fabricante |
| FQM FARMOQUÍMICA |
| Princípio ativo |
| Varfarina Sódica |
| Categoria do medicamento |
| Medicamentos de A-Z |
