Bula
Sevoflurano - 1 Ml/Ml Solução De Uso Inalatório Frasco 250 Ml Rest Hosp Biochimico GenéricoATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Bula - Sevoflurano - 1 Ml/Ml Solução De Uso Inalatório Frasco 250 Ml Rest Hosp Biochimico Genérico
Para que serve
Sevoflurano (substância ativa) é destinado à indução e manutenção de anestesia geral em pacientes pediátricos ou adultos, em procedimentos cirúrgicos hospitalares ou ambulatoriais.
Contraindicação
Sevoflurano (substância ativa) não deve ser utilizado em pacientes com suscetibilidade genética conhecida ou suspeita de hipertermia maligna.
Sevoflurano (substância ativa) não deve ser utilizado em pacientes com sensibilidade conhecida ou suspeita ao Sevoflurano (substância ativa) ou a outro agente anestésico inalatório halogenado (por exemplo, histórico de hepatotoxicidade, incluindo geralmente aumento das enzimas hepáticas, febre, leucocitose e/ ou eosinofilia temporária relacionada à anestesia com um desses agentes).
Como usar
Pré-medicação
Deve ser selecionada de acordo com a necessidade individual do paciente e decisão médica do anestesiologista.
Anestesia cirúrgica
A concentração de Sevoflurano (substância ativa) liberada pelo vaporizador durante a anestesia deve ser conhecida. Isto pode ser controlado através do uso de vaporizadores calibrados especificamente para Sevoflurano (substância ativa).
Indução
A dosagem deve ser individualizada e titulada para o efeito desejado de acordo com a idade e quadro clínico do paciente. Um barbitúrico de ação curta ou outro agente indutor intravenoso pode ser administrado seguindo-se a inalação de Sevoflurano (substância ativa). A indução com Sevoflurano (substância ativa) deve ser realizada em oxigênio, ou em uma mistura do oxigênio/óxido nitroso. Para indução anestésica, as concentrações inspiradas de até 8% de Sevoflurano (substância ativa) geralmente produzem anestesia cirúrgica em menos de 2 minutos, tanto em adultos quanto em crianças.
Manutenção
Níveis cirúrgicos de anestesia podem ser sustentados com concentrações de 0,5 a 3% de Sevoflurano (substância ativa), com ou sem uso concomitante de óxido nitroso.
Valores da CAM para pacientes adultos e pediátricos, de acordo com a idade
| Idade do paciente (anos) | Sevoflurano (substância ativa) em oxigênio | Sevoflurano (substância ativa) em 65% de N2O / 35% O2 |
| 0 – 1 mês* | 3,3% | |
| 1 - < 6 meses | 3,0% | 2,0** |
| 6 meses - < 3 anos | 2,8% | 2,0** |
| 3 – 12 | 2,5% | |
| 25 | 2,6% | 1,4% |
| 40 | 2,1% | 1,1% |
| 60 | 1,7% | 0,9% |
| 80 | 1,4% | 0,7% |
*Neonatos com idade gestacional completa. A CAM para prematuros não foi determinada.
**Em pacientes pediátricos de 1 a <3 anos, foi usada mistura de 60% N2O/ 40% O2.
Despertar
Após anestesia com Sevoflurano (substância ativa), o tempo de despertar anestésico é geralmente curto; portanto, os pacientes podem necessitar mais precocemente de analgésicos no pós-operatório.
Idosos
A CAM (concentração alveolar mínima) diminui com o aumento da idade. A concentração média de Sevoflurano (substância ativa) para atingir a CAM em pacientes de 80 anos é de aproximadamente 50% daquela requerida para um paciente de 20 anos de idade.
Precauções
Sevoflurano (substância ativa) pode causar depressão respiratória, que pode ser agravada por pré-medicação narcótica ou outros agentes que causam depressão respiratória. A respiração deve ser supervisionada e, se necessário, assistida. Sevoflurano (substância ativa) somente deve ser administrado por médicos treinados na administração de anestesia geral. Recursos para a manutenção da patência das vias aéreas, ventilação mecânica, administração de oxigênio e ressuscitação circulatória devem estar disponíveis para uso imediato. Deve-se conhecer com exatidão a concentração de Sevoflurano (substância ativa) que está sendo liberada pelo vaporizador. Como anestésicos voláteis diferem em suas propriedades físicas, apenas vaporizadores especificamente calibrados para Sevoflurano (substância ativa) devem ser utilizados. A administração de anestésicos gerais deve ser individualizada de acordo com a resposta do paciente. Hipotensão e depressão respiratória aumentam na medida em que a anestesia é aprofundada. Foram relatados casos isolados de prolongamento de intervalo QT, muito raramente associados à torsade de pointes (em casos excepcionais, fatal). Deve-se exercer cautela quando Sevoflurano (substância ativa) for administrado em pacientes suscetíveis. Também foram relatados casos isolados de arritmia ventricular em pacientes pediátricos com Doença de Pompe. Anestésicos gerais, incluindo o Sevoflurano (substância ativa), devem ser administrados com cautela em pacientes com desordem mitocondrial.
Gerais
Durante a manutenção anestésica, o aumento da concentração de Sevoflurano (substância ativa) produz diminuição dose-dependente na pressão sanguínea. A diminuição excessiva da pressão sanguínea pode estar relacionada ao aprofundamento da anestesia e, nestes casos, pode ser corrigida pela diminuição da concentração de Sevoflurano (substância ativa) inspirado. Como com todos os anestésicos, a manutenção da estabilidade hemodinâmica é importante para evitar isquemia miocárdica em pacientes com doenças arterial coronariana. A recuperação da anestesia geral deve ser avaliada com cuidado, antes que os pacientes estejam dispensados da unidade de cuidados pós-anestésica. Embora a recuperação da consciência geral ocorra dentro de minutos após a cessação da administração de Sevoflurano (substância ativa), o impacto sobre a função intelectual por 2 ou 3 dias após a anestesia não foi estudado. Como com outros anestésicos, pequenas alterações no humor podem persistir por diversos dias após a administração do anestésico.
Hepáticas
Casos muito raros de disfunção hepática leve, moderada e severa no pós-operatório ou hepatite com ou sem icterícia têm sido relatados a partir de experiências pós-comercialização. Deve-se realizar uma avaliação clínica quando Sevoflurano (substância ativa) for administrado em pacientes com uma condição hepática subjacente ou sob tratamento com fármacos conhecidos por causar disfunção hepática. Há relatos de que a exposição prévia a anestésicos com hidrocarbonetos halogenados pode aumentar o potencial de lesão hepática, especialmente se esta ocorrer em um intervalo inferior a 3 meses.
Hipertermia maligna
Assim como outros agentes inalatórios, a anestesia com Sevoflurano (substância ativa) pode causar um estado hipermetabólico da musculatura esquelética em indivíduos suscetíveis, levando a uma elevada demanda de oxigênio e consequente síndrome clínica conhecida como hipertermia maligna. Esta síndrome é caracterizada por hipercapnia e pode incluir rigidez muscular, taquicardia, taquipneia, cianose, arritmias e/ou instabilidade da pressão sanguínea. Alguns destes sinais inespecíficos podem aparecer durante uma anestesia leve, hipóxia aguda, hipercapnia e hipovolemia. Em estudos clínicos, um caso de hipertermia maligna foi relatado. Adicionalmente, houve relatos pós-comercialização de hipertermia maligna. Alguns desses relatos foram fatais.
O tratamento consiste na descontinuação dos agentes causadores (como Sevoflurano (substância ativa)), administração de dantrolene sódico intravenoso (consulte as informações de prescrição do dantrolene sódico intravenoso para informações adicionais sobre o manejo dos pacientes) e aplicação de medidas de suporte. Tal terapia inclui esforço vigoroso para restaurar a temperatura corpórea a valores normais, suportes respiratório e circulatório como indicado e manejo dos distúrbios ácido-básicos, de fluidos e eletrólitos. Insuficiência renal pode surgir tardiamente e, dentro do possível, o fluxo urinário deve ser monitorado e mantido.
Hipercalemia perioperatória
O uso de agentes anestésicos inalatórios foi associado a raros aumentos nos níveis de potássio sérico que resultaram em arritmias cardíacas e morte de pacientes pediátricos durante o período pós-operatório. Pacientes com doenças neuromusculares latentes ou manifestas, particularmente com distrofia muscular de Duchenne, parecem ser mais vulneráveis. O uso concomitante de succinilcolina foi associado à maioria destes casos, mas não a todos. Estes pacientes também mostraram elevações significativas dos níveis de creatinoquinase e, em alguns casos, alterações na urina consistentes com mioglobinúria. Apesar da similaridade deste quadro à hipertermia maligna, nenhum destes pacientes exibiu sinais ou sintomas de rigidez muscular ou estado hipermetabólico. Intervenção precoce e agressiva para o tratamento da hipercalemia e arritmias resistentes é recomendável, assim como subsequente avaliação de doenças neuromusculares latentes.
Substituição de absorventes de CO2 dessecados
Casos raros de calor extremo, fumaça e/ou fogo espontâneo no aparelho de anestesia foram relatados durante o uso de Sevoflurano (substância ativa) em conjunto com o uso de absorventes de CO2 dessecados, especificamente aqueles que contêm hidróxido de potássio. Um aumento tardio incomum ou um declínio inesperado da concentração estabelecida no vaporizador pode estar associado ao aquecimento excessivo dos absorventes de CO2. Uma reação exotérmica, degradação exacerbada de Sevoflurano (substância ativa) e produção de produtos da degradação podem ocorrer quando os absorventes de CO2 estão dessecados, como ocorre após o período prolongado de alto fluxo de gás seco através do reservatório dos absorventes de CO2.
Os produtos de degradação de Sevoflurano (substância ativa) (metanol, formaldeído, monóxido de carbono, e Composto A, B, C e D) foram observados no circuito respiratório de uma máquina experimental de anestesia, usando absorventes de CO2 dessecados e concentrações máximas de Sevoflurano (substância ativa) (8%) por um período detempo longo (? 2 horas). As concentrações de formaldeído observadas no circuito respiratório de anestesia (utilizando absorventes contendo hidróxido de sódio) foram consistentes com os níveis que sabidamente causam irritação respiratória suave. A relevância clínica da presença dos produtos de degradação observados neste modelo experimental sob condições extremas é desconhecida. Quando um médico suspeita que os absorventes de CO2 possam estar dessecados, eles devem ser substituídos antes da administração do Sevoflurano (substância ativa), o indicador de cor desses absorventes não muda necessariamente como resultado de dessecamento. Consequentemente, a falta de mudança significativa de cor não deve ser entendida como um estado de hidratação adequado. Os absorventes de CO2 devem ser substituídos rotineiramente, independentemente da coloração do indicador.
Disfunção renal
Devido ao baixo número de casos estudados de pacientes com insuficiência renal (creatinina sérica basal maior do que 1,5 mg/dL), a segurança do uso de Sevoflurano (substância ativa) neste grupo de pacientes ainda não pode ser completamente estabelecida. Portanto, o Sevoflurano (substância ativa) deve ser utilizado com cautela em pacientes com insuficiência renal.
Anestesia neurocirúrgica
Em pacientes com risco de aumento da pressão intracraniana, o Sevoflurano (substância ativa) deve ser administrado cautelosamente, em conjunto com manobras para reduzir a pressão intracraniana, como a hiperventilação.
Convulsões
Raros casos de convulsão foram relatados associados com o uso de Sevoflurano (substância ativa).
Uso em idosos
Ficou demonstrado que Sevoflurano (substância ativa) é um agente efetivo e seguro para indução e manutenção anestésicas. A dosagem deve ser individualizada e titulada para efeito desejado de acordo com a idade e quadro clínico do paciente.
Uso pediátrico
Ficou demonstrado que Sevoflurano (substância ativa) é um agente efetivo e seguro para indução e manutenção anestésicas. A dosagem deve ser individualizada e titulada para o efeito desejado de acordo com a idade e quadro clínico do paciente. A utilização de Sevoflurano (substância ativa) foi associada com convulsões. Muitas dessas ocorreram em crianças e adultos jovens a partir de 2 meses de idade, a maioria dos quais não possuíam fatores de risco predisponentes. Julgamento clínico deve ser exercido quando se utilizar Sevoflurano (substância ativa) em pacientes sob risco de convulsões.
Gravidez
Estudos de reprodução foram realizados em ratos e coelhos em doses de até 1,0 CAM (concentração alveolar mínima) e não revelaram qualquer evidência de dano à fertilidade ou prejuízo ao feto causados pelo Sevoflurano (substância ativa). Não existem estudos adequados e bem controlados em mulheres grávidas e, portanto, Sevoflurano (substância ativa) deve ser usado durante a gravidez apenas se absolutamente necessário. A segurança do Sevoflurano (substância ativa) foi demonstrada em estudo clínico, tanto para mães quanto para conceptos, quando utilizado para anestesia de parto tipo cesárea; a segurança para uso durante o trabalho de parto e parto normal não foi demonstrada.
Sevoflurano (substância ativa), assim como outros agentes inalatórios, possui efeito relaxante no útero com risco potencial para sangramento uterino. Julgamento clínico deve ser exercido quando Sevoflurano (substância ativa) foi utilizado durante anestesia obstétrica.
Categoria de Risco: B.
Este medicamento não deve ser utilizado em mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Lactação
Não se sabe se o Sevoflurano (substância ativa) ou seus metabólitos são excretados no leite humano. Devido à falta de experiência documentada, mulheres lactantes devem ser orientadas a não amamentarem por 48 horas após a administração de Sevoflurano (substância ativa) e descartar o leite produzido neste período.
Efeitos na capacidade de dirigir e operar máquinas
Os pacientes devem ser advertidos de que o desempenho em atividades que requeiram atenção constante, tais como conduzir veículos motorizados ou operar maquinário pesado, pode ser prejudicado por algum tempo após a anestesia geral.
Reações Adversas
Assim como todos os anestésicos inalatórios potentes, Sevoflurano (substância ativa) pode causar depressão cardiorrespiratória dose-dependente.
Muitos eventos adversos são leves ou moderados na intensidade e transitórios na duração. Náuseas, vômitos e delírios têm sido observados no período pós-operatório, conseqüências comuns da cirurgia e da anestesia geral, que podem ser devidas ao anestésico inalatório ou outro agente administrado no período intra ou pós-operatório, ou devidas à resposta do paciente ao procedimento cirúrgico.
Todos os eventos considerados como provavelmente relacionados à administração de Sevoflurano (substância ativa) estão descritos a seguir.
As seguintes definições de freqüências foram adotadas
- Muito comum (?1/10);
- Comum (?1/100 e <1/10);
- Incomum (?1/1000 e <1/100);
- Rara (?1/10000 e <1/1000);
- Muito rara (<1/10000), incluindo relatos isolados.
Reação muito comum (?1/10)
Agitação, bradicardia, hipotensão, tosse, náusea e vômitos.
Reação comum (? 1/100 e <1/10)
Sonolência, tontura, cefaleia, taquicardia, hipertensão, alterações respiratórias, laringoespasmos, hipersecreção salivar, calafrios e pirexia, glicose sangüínea anormal, teste anormal de função de função hepática*, contagem de leucócitos anormal, aumento nos níveis de fluoreto** e hipotermia.
Reação incomum (?1/1000 e <1/100)
Bloqueio átrio ventricular completo.
*Casos ocasionais das alterações transitórias em teste de função hepática foram relatados com o uso de Sevoflurano (substância ativa) e agentes de referência.
**Aumentos transitórios nos níveis de fluoreto inorgânico sérico podem ocorrer durante após a anestesia com Sevoflurano (substância ativa). O pico das concentrações de fluoreto inorgânico geralmente ocorre dentro de 2 horas do término da anestesia com Sevoflurano (substância ativa) e retornam ao nível pré-operatório em 48 horas. Em ensaios clínicos, concentrações elevadas de fluoreto não foram associadas à disfunção renal.
Frequência desconhecida
Prolongamento do intervalo QT associado com torsade.
Eventos adversos da experiência pós-comercialização
Eventos adversos foram espontaneamente relatados durante o período de comercialização do Sevoflurano (substância ativa). Estes eventos foram relatados por uma população com taxa de exposição desconhecida. Portanto, não é possível estimar a verdadeira incidência dos eventos adversos ou estabelecer uma relação de exposição ao Sevoflurano (substância ativa).
Eventos adversos pós-comercialização de Sevoflurano (substância ativa)
| Sistema/Órgão | Reação adversa |
| Alterações do sistema imune |
Reação anafilática* |
|
Reação anafilactoide | |
|
Hipersensibilidade* | |
| Alterações do sistema nervoso |
Convulsão |
|
Distonia | |
| Alterações cardíacas | Parada cardíaca** |
| Alterações respiratórias, torácicas e mediastinais |
Broncoespasmo |
|
Dispnéia* | |
|
Respiração com dificuldade* | |
| Alterações hepatobiliares |
Hepatite |
|
Falência hepática | |
|
Necrose hepática | |
| Alterações de pele e tecido subcutâneo |
Rash* |
|
Urticária | |
|
Prurido | |
|
Dermatite de contato* | |
|
Edema de face* | |
| Alterações gerais |
Hipertermia maligna |
|
Desconforto torácico* |
*Pode estar associado a reação de hipersensibilidade, particularmente em associação a exposição ocupacional por longo período a agentes anestésicos inalatórios.
**Houve relatos muito raros na pós comercialização de casos de parada cardíaca no ajuste do uso de Sevoflurano (substância ativa).
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, disponível em http://www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
Agentes beta-simpatomiméticos como isoprenalina e agentes alfa- e beta-simpatomiméticos como adrenalina e noradrenalina devem ser usados com precaução durante a narcose com Sevoflurano (substância ativa), devido ao risco potencial de arritmia ventricular.
Inibidores não seletivos de monoaminoxidase (MAO)
Risco de crises durante operação. Geralmente, é recomendado que o tratamento seja suspenso 2 semanas anteriormente à cirurgia.
O Sevoflurano (substância ativa) pode levar a uma marcada hipotensão em pacientes tratados com antagonistas de cálcio, em particular derivados da di-hidropiridina. Precaução deve ser exercida quando antagonistas de cálcio, precaução deve ser exercida quando antagonistas de cálcio são utilizados concomitantemente com anestésicos inalatórios devido ao risco de efeito inotrópico negativo aditivo. O uso concomitante de succinilcolina com agentes anestésicos inalantes tem sido associado com raros aumentos dos níveis do potássio sérico que resultaram em arritmias cardíacas e morte em pacientes pediátricos durante o período pós-operatório.
Medicamentos com importante potencial de interação observado
Benzodiazepínicos e opioides
Do mesmo modo como ocorre com os demais anestésicos inalatórios, espera-se que os benzodiazepínicos e opioides diminuam a CAM do Sevoflurano (substância ativa). A administração de Sevoflurano (substância ativa) é compatível com os benzodiazepínicos e opioides comumente utilizados na prática cirúrgica.
Bloqueadores neuromusculares
Assim como outros agentes anestésicos inalatórios, Sevoflurano (substância ativa) afeta tanto a intensidade quanto a duração do bloqueio neuromuscular produzido por relaxantes musculares não despolarizantes. Quando utilizado como suplemento para anestesia feita com alfentanila/N2O, o Sevoflurano (substância ativa) potencializa o bloqueio neuromuscular induzido com pancurônio, vecurônio e atracúrio.
Os ajustes de dose para estes miorrelaxantes, quando administrados com Sevoflurano (substância ativa), são similares àqueles requeridos com isoflurano. O efeito do Sevoflurano (substância ativa) na succinilcolina e a duração da despolarização do bloqueio neuromuscular não foram avaliados. A redução de dose dos bloqueadores neuromusculares durante a indução anestésica pode resultar em retardo para se atingir condições adequadas para a intubação endotraqueal ou relaxamento muscular inadequado, porque a potencialização dos bloqueadores neuromusculares é observada poucos minutos após o início da administração de Sevoflurano (substância ativa). Dentre os agentes não despolarizantes, as interações com vecurônio, pancurônio e atracúrio foram estudadas.
Na ausência de orientações específicas
- Para intubação endotraqueal, não reduza a dose dos relaxantes musculares não despolarizantes;
- Durante a manutenção da anestesia, é desejável reduzir a dose dos relaxantes musculares não despolarizantes, de modo análogo ao feito durante anestesia com N2O/opioides.
A administração de doses suplementares de relaxantes musculares deve ser orientada pela resposta à estimulação nervosa.
Indutores da CYP2E1
Produtos medicinais e compostos que aumentam a atividade da isoenzima CYP2E1 do citocromo P450, como a isoniazida e o álcool, podem aumentar o metabolismo do Sevoflurano (substância ativa) e levar a aumentos significantes nas concentrações de fluoreto no plasma.
Óxido nitroso
Do mesmo modo como ocorre com os demais anestésicos voláteis halogenados, a CAM do Sevoflurano (substância ativa) diminui quando administrado em combinação com óxido nitroso. A CAM equivalente está reduzida em aproximadamente 50 % nos adultos e 25% nos pacientes pediátricos.
Medicamentos sem potencial de interação clinicamente importante ou sem interação observada
O Sevoflurano (substância ativa) mostrou-se seguro e efetivo quando administrado concomitantemente a uma grande variedade de fármacos, geralmente encontrados no ambiente cirúrgico, tais como
Agentes do sistema nervoso central, fármacos autônomos, miorrelaxantes, anti-infecciosos (incluindo aminoglicosídeos), hormônios e substitutos sintéticos, hemoderivados e fármacos cardiovasculares (incluindo epinefrina).
Barbitúricos
A administração de Sevoflurano (substância ativa) é compatível com os barbitúricos comumente utilizados na prática cirúrgica.
Interações medicamento-exame laboratorial
O uso de Sevoflurano (substância ativa) pode provocar alterações nos testes de glicose sanguínea e de contagem de leucócitos. Casos ocasionais de alterações transitórias em teste de função hepática foram relatados com o uso de Sevoflurano (substância ativa) e agentes de referência. Aumentos transitórios nos níveis de fluoreto inorgânico sérico podem ocorrer durante e após a anestesia com Sevoflurano (substância ativa). O pico das concentrações de fluoreto inorgânico geralmente ocorre dentro de 2 horas do término da anestesia com Sevoflurano (substância ativa) e retornam ao nível pré-operatório em 48 horas. Em ensaios clínicos, concentrações elevadas de fluoreto não foram associadas à disfunção renal.
Ação da Substância
Resultados de eficácia
Numerosos estudos clínicos foram conduzidos com Sevoflurano (substância ativa) usado como anestésico para pacientes adultos e pediátricos. Os resultados demonstraram que o Sevoflurano (substância ativa) proporciona uma indução rápida e suave, bem como uma recuperação rápida da anestesia. Quando comparado com os anestésicos padrões, o Sevoflurano (substância ativa) foi associado a tempos mais rápidos para indução e também para eventos do despertar anestésico, como resposta à ordens e orientação.
Estudos de eficácia
Manutenção da anestesia em procedimentos de média duração
Neste estudo clínico, a eficácia de Sevoflurano (substância ativa) foi comprovada durante a manutenção da anestesia em pacientes adultos ASA classes I, II, e III. Este estudo de fase III, aberto, randomizado, multicêntrico foi realizado em 12 unidades cirúrgicas. A população estudada incluiu 555 pacientes adultos, submetidos a procedimentos cirúrgicos de duração intermediária (pelo menos 1 hora), dividido em dois grupos. No grupo 1 (n=272), os pacientes foram submetidos a manutenção da anestesia com Sevoflurano (substância ativa) e no grupo 2 (n=283), de controle, o anestésico isoflurano foi usado para manutenção do procedimento anestésico. Despertar, a resposta aos comandos, orientação e a primeira solicitação de analgesia pós-operatória foram todos maisrápidos após descontinuação do anestésico no grupo que utilizou Sevoflurano (substância ativa). (Tabela 1)
Tabela 1
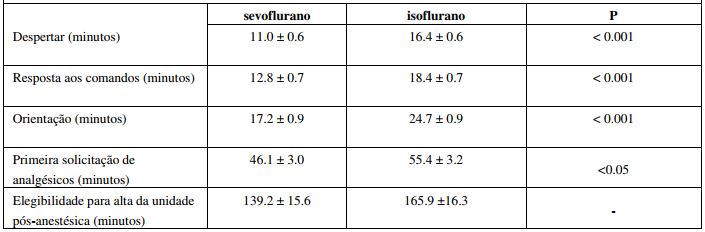
Concluiu-se pelo estudo que a eficácia dos agentes anestésicos avaliados foi comparável, sendo que Sevoflurano (substância ativa) associou-se a uma recuperação anestésica mais rápida.
Manutenção da anestesia em procedimentos ambulatoriais
Neste segundo estudo, comparou-se a eficácia de Sevoflurano (substância ativa) versus isoflurano em procedimentos cirúrgicos ambulatoriais. Este foi um estudo de fase III, multicêntrico, randomizado, onde 500 pacientes submetidos à procedimentos cirúrgicos ambulatoriais receberam os agentes anestésicos Sevoflurano (substância ativa) (grupo 1, n=247) ou isoflurano (grupo 2, n=253). Foram comparados os seguintes parâmetros entre os grupos: tempo médio de despertar, resposta a comandos e orientação têmporo-espacial. Para todos os parâmetros avaliados, Sevoflurano (substância ativa) demonstrou respostas significativamente mais rápidas comparando-se ao isoflurano. (Tabela 2)
Tabela 2
| Sevoflurano (substância ativa) | Isoflurano | |
| Despertar (minutos) | 8.2 | 9.3 |
| Resposta aos comandos (minutos) | 8.5 | 9.8 |
| Orientação (minutos) | 10.6 | 13.0 |
Na avaliação dos resultados de eletreoencefalografia, demonstrou-se que o grupo Sevoflurano (substância ativa) apresentou uma redução mais rápida das ondas delta e rápido aumento da atividade alfa em relação ao grupo isoflurano, indicando um despertar mais rápido no grupo do Sevoflurano (substância ativa).
Indução e manutenção da anestesia geral
Neste estudo, foram comparados procedimentos de anestesia geral realizados com Sevoflurano (substância ativa) versus propofol, tanto para indução quanto a manutenção da anestesia. Pacientes (n=50) com ASA classes I e II e com idades variando de 17 a 70 anos foram incluídos neste estudo randomizado, controlado, que comparou a facilidade de indução e o tempo necessário para o despertar da anestesia. Concluiu-se que os parâmetros avaliados foram semelhantes em ambos os grupos estudados. (Tabela 3)
Tabela 3
O Sevoflurano (substância ativa) permitiu uma rápida indução inalatória e despertar da anestesia geral.
Indução e manutenção da anestesia geral na população pediátrica
Neste estudo, foram comparados os dados de eficácia no despertar e recuperação anestésica com o uso de diferentes anestésicos inalatórios
Sevoflurano (substância ativa), desflurano e halotano. Foram incluídas 80 crianças submetidas à adenoidectomia e miringotomia bilateral com inserção de tubos de ventilação, randomizados para um dos 4 grupos:
- Grupo 1 (n= 20) - indução e manutenção com Sevoflurano (substância ativa);
- Grupo 2 (n= 20) indução com halotano e manutenção com Sevoflurano (substância ativa);
- Grupo 3 (n= 20) indução e manutenção com halotano;
- Grupo 4 (n= 20) - indução com halotano e manutenção com desflurano.
Um observador independente, cego para esquema anestésico avaliou cada paciente nas fases de emergência e recuperação. Os resultados dos parâmetros avaliados estão na (Tabela 4)
Tabela 4

O despertar e a recuperação da anestesia foram significativamente mais rápidos com o uso do desflurano (grupo 4) comparado com os outros grupos, porém houve maior incidência de agitação e excitação neste grupo (55%) em relação aos grupos que receberam Sevoflurano (substância ativa) (10%) e halotano (25%), e não houve diferenças entre os grupos para critério de alta hospitalar.
Outros estudos
Anestesia em adultos
Indução
Em estudos com adultos nos quais foi realizada indução por máscara, foi demonstrado que Sevoflurano (substância ativa) promove indução anestésica rápida e suave.
Manutenção
Em 28 estudos que envolveram 3591 pacientes adultos (2022 com Sevoflurano (substância ativa), 1196 com isoflurano, 111 com enflurano, 262 com propofol), ficou demonstrado que Sevoflurano (substância ativa) é um agente efetivo para manutenção anestésica. Do mesmo modo, evidenciou-se que Sevoflurano (substância ativa)é um agente anestésico apropriado para uso em neurocirurgia, cirurgia tipo cesariana, para pacientes submetidos a revascularização cardíaca e para os pacientes não cardiopatas com risco de isquemia do miocárdio.
Anestesia pediátrica
Em 5 estudos que envolveram 1498 pacientes (837 com Sevoflurano (substância ativa), 661 com halotano), ficou demonstrado que Sevoflurano (substância ativa) é um agente efetivo para indução e manutenção anestésicas.
Indução
A indução anestésica por máscara teve um tempo de indução mais curto e incidência de tosse menor do que halotano, de modo estatisticamente significativo.
Segurança
Estudos clínicos foram conduzidos em uma grande variedade de pacientes (adultos, crianças, idosos, nefropatas, hepatopatas, obesos, pacientes submetidos à revascularização cardíaca, pacientes tratados com aminoglicosídeos ou indutores metabólicos, pacientes expostos a repetidas cirurgias, pacientes submetidos a cirurgias com mais de 6 horas de duração). Os resultados dos parâmetros laboratoriais (por exemplo, AST, ALT, fosfatase alcalina, bilirrubina total, creatinina sérica e ureia), bem como a incidência de eventos adversos relatados pelos investigadores em relação às funções renais e hepáticas, demonstraram que Sevoflurano (substância ativa) não teve efeito clínico significativo sobre as funções renais e hepáticas, nem exacerbou disfunções hepática ou renal previamente existentes nas populações avaliadas.
Não houve diferença estatisticamente significante entre Sevoflurano (substância ativa) e as drogas de referência (isoflurano, halotano, enflurano e propofol) na proporção de pacientes que tiveram alterações nos parâmetros bioquímicos. O impacto na função renal foi comparável entre Sevoflurano (substância ativa) e as drogas de referência, entre tipos de circuitos de anestesia, entre taxas de fluxo, e entre pacientes com ou sem as concentrações de fluoreto inorgânico maiores ou iguais a 50µm. A incidência de disfunção renal foi menor do que 1% tanto para Sevoflurano (substância ativa) (0,17%) quanto para drogas de referência (isoflurano, halotano, enflurano, propofol) (0,22%). Em todos os casos existiu uma causa alternativa ou explicação razoável para o aparecimento da disfunção renal.
Disfunção hepática
Durante a fase de desenvolvimento clínico, o Sevoflurano (substância ativa) foi efetivo e bem tolerado como agente anestésico primário para a manutenção anestésica em pacientes com insuficiência hepática classe Child-Pugh A e B, e não exacerbou doença hepática pré- existente. Para reações adversas hepáticas verificadas na fase pós-comercialização, verificar seções.
Disfunção renal
Em indivíduos portadores de nefropatia, com creatinina sérica basal maior ou igual a 1,5 mg/dL (130 micromole/L), o Sevoflurano (substância ativa) demonstrou não causar piora na função renal. Baseado na incidência e magnitude das alterações na concentração sérica de creatinina, Sevoflurano (substância ativa) não piora a função renal.
Características farmacológicas
Descrição
Sevoflurano (substância ativa) é um agente anestésico líquido fluorado, não inflamável, para uso em anestesia geral inalatória, por meio de vaporização. É um derivado do éter metil isopropílico. Sevoflurano (substância ativa) é quimicamente identificado como éter fluorometil 1- (trifluorometil) 2,2,2-triofluoro etílico, possui um peso molecular de 200,05 e apresenta as seguintes propriedades físico-químicas.
Propriedades físico-químicas
| Ponto de ebulição a 760 mmHg | 58,6°C |
| Gravidade específica a 20°C | 1,520 - 1,525 |
| Pressão de vapor (calculada), em mmHg** | |
| A 20°C | 157 |
| A 25°C | 197 |
| A 36°C | 317 |
| Coeficientes de partição a 37°C | |
| Água: gás | 0,36 |
| Cérebro: gás | 1,15 |
| Óleo de oliva: gás | 47,2 -53,9 |
| Coeficientes médios de partição componentes/gás a 25°C, para polímeros geralmente usados em equipamentos médicos | |
| Borracha condutiva | 14,0 |
| Borracha butil | 7,7 |
| Cloreto Polivinílico | 17,4 |
| Polietileno | 1,3 |
**Equação para cálculo da pressão de vapor (mmHg): Log10Pvap = A + B/T.
Onde: A = 8,086; B = -1726,68; T = °C + 273,16°K (Kelvin).
Degradação do Sevoflurano (substância ativa)
O Sevoflurano (substância ativa) é estável quando armazenado sob condições normais de luminosidade ambiente. Não ocorre degradação identificável na presença de ácidos fortes ou calor. O Sevoflurano (substância ativa) não possui efeito corrosivo sobre aço inoxidável, bronze, alumínio, bronze níquel-chapeado, bronze cromo-chapeado ou à liga de cobre e berílio. Os anestésicos inalatórios podem sofrer degradação sob exposição a absorvente de CO2, dentro da máquina de anestesia. Quando usado como orientado com absorventes frescos, a degradação do Sevoflurano (substância ativa) é mínina e dos degradantes indetectáveis ou não tóxicos. A degradação do Sevoflurano (substância ativa) e a formação do produto subsequente é realçada por aumento da temperatura do absorvente, absorvente de CO2 dessecado (especialmente que contém hidróxido de potássio), concentração aumentada de Sevoflurano (substância ativa) e baixo fluxo de gás fresco. O Sevoflurano (substância ativa) pode sofrer degradação alcalina por duas vias. A primeira resulta da perda de fluoreto de hidrogênio com a formação de fluorometil pentafluoroisopropenil éter (PIFE, também conhecido como composto A). A segunda via para a degradação do Sevoflurano (substância ativa) ocorre somente na presença de absorventes dessecados de CO2 e conduz à dissociação do Sevoflurano (substância ativa) em hexafluoroisopropanol (HFIP) e formaldeído. O HFIP é inativo, não é genotóxico, é rapidamente glucuronidado e depurado, e tem toxicidade comparável ao Sevoflurano (substância ativa).
O formaldeído está presente durante o processo metabólico normal. Uma vez exposto a um absorvente de CO2 altamente dessecado, o formaldeído pode ainda ser degradado em metanol e formato. Na presença de altas temperaturas, o metabólito formato pode contribuir para a formação do monóxido de carbono. O metanol pode reagir com o Composto A, formando o Composto B por metóxi-adição. O Composto B pode sofrer posteriormente eliminação HF, formando os Compostos C, D e E. Com absorventes altamente dessecados, especialmente aqueles que contêm hidróxido de potássio, pode ocorrer a formação de formaldeído, metanol, monóxido de carbono, Composto A e talvez de alguns de seus produtos de degradação, os Compostos B, C e D.
Farmacodinâmica
Estudos com Sevoflurano (substância ativa) no homem e em diversas espécies animais demonstraram que este agente não é irritativo e tem rápido início de ação. A administração tem sido associada à indução anestésica com perda de consciência rápida e suave, bem como à rápida recuperação após descontinuação da anestesia. A indução é acompanhada por um mínimo de excitação ou sinais de irritação no trato respiratório superior; não há evidências de secreções excessivas na árvore traqueobrônquica, bem como ausência de estimulação do SNC. Em estudos com pacientes pediátricos que receberam indução anestésica por máscara, a incidência de tosse foi mais baixa com Sevoflurano (substância ativa) do que com halotano, de modo estatisticamente significativo. Assim como outros anestésicos inalatórios potentes, Sevoflurano (substância ativa) deprime a função respiratória e a pressão arterial de forma dose-potente.
Estudos em humanos e animais (cães) demonstraram que o limiar arritmogênico para Sevoflurano (substância ativa), induzido por epinefrina, foi comparável ao do isoflurano e maior do que halotano. Estudos em cães demonstraram que Sevoflurano (substância ativa) não reduz a perfusão colateral do miocárdio. Em estudos clínicos, a incidência de isquemia miocárdica e infarto do miocárdio, em pacientes com risco de isquemia miocárdica, foram comparáveis entre Sevoflurano (substância ativa) e isoflurano.
Estudos em animais evidenciam que a circulação sanguínea regional (por exemplo, circulação hepática, cerebral ou renal) mantém-se adequada com Sevoflurano (substância ativa). Em estudos com animais (cães e coelhos) e estudos clínicos, as mudanças da hemodinâmica cerebral (pressão intracraniana, fluxo sanguíneo cerebral/ velocidade do fluxo sanguíneo, taxa de metabolização cerebral do oxigênio e pressão de perfusão cerebral) foram comparáveis entre Sevoflurano (substância ativa) e isoflurano. Sevoflurano (substância ativa) tem efeito mínimo na pressão intracraniana e preserva a responsividade ao CO2. Mesmo em exposição anestésica prolongada, até aproximadamente 9 horas, Sevoflurano (substância ativa) não afeta a capacidade de concentração renal.
Concentração alveolar mínima
A concentração alveolar mínima (CAM) é a concentração alveolar na qual 50% dos indivíduos não manifestam repostas motoras a um estímulo de incisão/doloroso. De acordo com diferentes grupos etários, há diferentes equivalentes de CAM para Sevoflurano (substância ativa). A CAM de Sevoflurano (substância ativa) em oxigênio foi determinada em 2,05%, para um indivíduo adulto de 40 anos. Como observado com outros agentes anestésicos halogenados, os valores da CAM diminuem com a idade e na presença de óxido nitroso.
Farmacocinética
Solubilidade
A baixa solubilidade do Sevoflurano (substância ativa) no sangue poderia sugerir que as concentrações alveolares devessem aumentar rapidamente durante a indução, diminuindo também de forma rápida quando da descontinuação do agente inalado. Isto foi confirmado através de um estudo clínico, no qual as concentrações da inspiração e do final da expiração (F1 e FA) foram medidas. A taxa de aumento nas concentrações alveolares durante a indução (FA/F1) foi 0,85 e a taxa de diminuição seguindo a descontinuação de inalação (FA/FAO) foi de 0,15.
Distribuição
Os efeitos do Sevoflurano (substância ativa) no deslocamento de drogas ligadas às proteínas séricas e aos tecidos não foram investigados. Outros anestésicos voláteis fluorados têm demonstrado, in vitro, deslocar drogas ligadas às proteínas séricas e teciduais. O significado clínico desse fato é desconhecido. Sobre este aspecto, estudos clínicos têm demonstrado que não há efeitos indesejáveis quando Sevoflurano (substância ativa) é administrado a pacientes que fazem uso de outros fármacos que tenham forte ligação proteica e com pequeno volume de distribuição (por exemplo, fenitoína).
Metabolismo
A eliminação pulmonar rápida do Sevoflurano (substância ativa) minimiza o montante do anestésico disponível para metabolização. Em humanos, menos de 5% do Sevoflurano (substância ativa) absorvido é metabolizado via citocromo P450 2E1 em hexafluorisopropil (HFIP), com liberação de fluoretos inorgânicos e dióxido de carbono (ou um fragmento do carbono). Uma vez formado o HFIP, este é rapidamente conjugado com ácido glucurônico e eliminado como metabólito urinário. Não foram identificadas outras vias metabólicas para o Sevoflurano (substância ativa). Sevoflurano (substância ativa) é o único anestésico fluorado volátil que não é metabolizado em ácido trifluoroacético.
Íon fluoreto
As concentrações de íon fluoreto são influenciadas pela duração da anestesia, pela concentração do Sevoflurano (substância ativa) administrado, e pela composição da mistura de gases anestésicos. A desfluoração de Sevoflurano (substância ativa) não é induzível por barbitúricos.
Dados de segurança Pré-Clínica
Estudos de toxicidade foram conduzidos em várias espécies animais, sendo que a indução da anestesia foi rápida e suave, sem resistência, sinais de respiração ofegante (“gasping”) ou outras reações indesejáveis. Mortes por exposição a concentrações letais foram devidas a parada respiratória. Nos animais estudados, a exposição não foi associada a nenhuma toxicidade orgânica específica, nem de desenvolvimento. Uma amostra de 344 ratos Fischer foi anestesiada dentro de 2 a 3 minutos após exposição a 1,4% de Sevoflurano (substância ativa) por até 10 horas. Nenhum prejuízo funcional ou morfológico decorreu da administração de Sevoflurano (substância ativa). Em um estudo sobre reprodução, o Sevoflurano (substância ativa) não causou efeitos significativos na capacidade reprodutiva de machos ou fêmeas expostos a concentrações de até 1,0 CAM (2,2%). Estudos posteriores indicam que o Sevoflurano (substância ativa) não é um elemento tóxico seletivo para a fase de desenvolvimento.
Composto A
Um estudo de toxicidade aguda em ratos Wistar indicou que a LC50 (concentração letal de 50%) do Composto A foi de 1.050 – 1.090 ppm em animais expostos por 1 hora e 400-420 ppm em animais expostos por 3 horas (as concentrações letais médias foram aproximadamente 1070 e 330 para 490 ppm, respectivamente). Os ratos foram expostos a 30, 60 ou 120 ppm do Composto A em um estudo de toxicidade crônica por 8 semanas, envolvendo 24 exposições, com duração de exposição de 3 horas cada. Nenhuma evidência de toxicidade aparente foi observada com esses animais, além de perda de peso corporal, em fêmeas no último dia de estudo. Em outro estudo, o Composto A foi administrado a ratos Sprague-Dawley por exposição inalatória nasal em um sistema aberto (25, 50, 100 ou 200 ppm) [0,0025 a 0,02%]; o grupo controle foi exposto ao ar ambiente. O limiar no qual alterações reversíveis nos parâmetros clínicos e urinários indicaram alterações renais (aumentos de ureia, glicose, creatinina, proporção creatinina/proteína, proporção creatinina/N-acetil-glicosamidas e dose-dependentes) foi de 114 ppm de Composto A. As lesões histológicas foram todas reversíveis. São esperados níveis mais elevados de Composto A (degradado do Sevoflurano (substância ativa)), ou de 2-bromo-2-cloro-1,1-difluoroetileno (BCDFE) (degradado/metabólito do halotano), em pequenos roedores do que em humanos, pois a captação inalatória é substancialmente maior em ratos do que em humanos. Além disso, a atividade de uma enzima importante (beta-liase), envolvida na nefrotoxicidade haloalcalina, é dez vezes maior em ratos do que em humanos.
Há relatos de aumento das concentrações do Composto A com aumento da temperatura do absorvente de CO2, com o aumento da concentração de Sevoflurano (substância ativa) e com a diminuição das taxas de fluxo de gás corrente. Tem sido relatado que a concentração do Composto A aumenta significativamente com a desidratação prolongada da cal baritada. Sob situação clínica, as mais altas concentrações de Composto A no circuito anestésico, com cal sodada como absorvente de CO2, foram de 15 ppm para pacientes pediátricos e de 32 ppm para adultos. Entretanto, as concentrações de 61 ppm foram encontradas em pacientes sob sistemas de cal baricada como absorvente de CO2. O nível de Composto A no qual ocorre toxicidade para humanos não é conhecido. Embora a exposição à Sevoflurano (substância ativa) em sistemas de baixo fluxo seja limitada, não há evidência de disfunção renal atribuída ao Composto A.
Composto B
Em situações clínicas, a concentração de Composto B detectada no circuito anestésico não excedeu 1,5 ppm. Exposição inalatória ao Composto B, sob concentração até 2.400 ppm (0,24%), por três horas, resultou em ausência de eventos adversos nos parâmetros renais ou na histologia tecidual em ratos Wistar.
Carcinogênese
Estudos com carcinogenicidade não foram realizados. Nenhum efeito mutagênico foi observado, conforme estudo realizado pelo teste de Ames. Não houve indução de aberrações cromossômicas em culturas de células de mamíferos.