para o que é indicado e para que serve?
Para que serve Tratamento da hipertensão.Continue lendo...
sem ofertas para Torlós - 25Mg 28 Comprimidos

Parece que não há ofertas disponíveis para o produto no momento.
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Tratamento da hipertensão.
Tratamento da insuficiência cardíaca.
Indicado para reduzir o risco de morbidade e mortalidade cardiovascular avaliado pela incidência combinada de morte cardiovascular, acidente vascular cerebral e infarto do miocárdio em pacientes hipertensos com hipertrofia ventricular esquerda.
Indicado para retardar a progressão da doença renal avaliada pela redução da incidência combinada de duplicação da creatinina sérica, insuficiência renal terminal (necessidade de diálise ou transplante renal) ou morte; e para reduzir a proteinúria.
Contraindicação
Contra-indicado para pacientes com hipersensibilidade a qualquer componente do produto.
Como usar
Pode ser administrado com ou sem alimentos e pode ser administrado com outros agentes anti-hipertensivos.
A dose usual inicial e de manutenção é de 50 mg uma vez ao dia.
Alguns pacientes podem obter benefício adicional se a dose for aumentada para 100 mg uma vez ao dia.
Precauções
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO Informe ao seu médico sobre quaisquer problemas de saúde que esteja apresentando ou tenha apresentado e sobre quaisquer tipos de alergia Informe ao seu médico se tiver apresentado recentemente episódios de vômito ou diarreia excessivos É muito importante informar problemas dos rins ou do fígado Gravidez e Amamentação: o uso de TORLÓS® não é recomendado enquanto você estiver grávida ou amamentando TORLÓS® pode causar danos ou a morte do feto Converse com seu médico sobre outras maneiras para diminuir sua pressão sanguínea se você pretende engravidar Se você engravidar enquanto toma TORLÓS® informe seu médico imediatamente Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica Informe imediatamente seu médico em caso de suspeita de gravidez Uso Pediátrico: não existe experiência com o uso de TORLÓS® em crianças, portanto TORLÓS® não deve ser administrado a crianças Idosos: TORLÓS® age igualmente bem e também é bem tolerado pela maioria dos pacientes adultos mais jovens e mais idosos A maioria dos pacientes mais idosos requer a mesma dose que os pacientes mais jovens Uso em Pacientes de Raça Negra com Pressão Alta e Hipertrofia do Ventrículo Esquerdo: em um estudo que envolveu pacientes com pressão alta e hipertrofia do ventrículo esquerdo, losartana potássica diminuiu o risco de derrame e ataque cardíaco e ajudou os pacientes a viverem mais No entanto, esse estudo também mostrou que esses benefícios, quando comparados aos benefícios de outro medicamento para hipertensão denominado atenolol, não se aplicam aos pacientes de raça negra Dirigir ou Operar Máquinas: quase todos os pacientes podem realizar essas atividades, porém você deve evitar atividades que exijam muita atenção (por exemplo, dirigir ou operar máquinas perigosas) até saber como você reage ao medicamento BU-05
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO Informe ao seu médico sobre quaisquer problemas de saúde que esteja apresentando ou tenha apresentado e sobre quaisquer tipos de alergia Informe ao seu médico se tiver apresentado recentemente episódios de vômito ou diarreia excessivos É muito importante informar problemas dos rins ou do fígado Gravidez e Amamentação: o uso de TORLÓS® não é recomendado enquanto você estiver grávida ou amamentando TORLÓS® pode causar danos ou a morte do feto Converse com seu médico sobre outras maneiras para diminuir sua pressão sanguínea se você pretende engravidar Se você engravidar enquanto toma TORLÓS® informe seu médico imediatamente Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica Informe imediatamente seu médico em caso de suspeita de gravidez Uso Pediátrico: não existe experiência com o uso de TORLÓS® em crianças, portanto TORLÓS® não deve ser administrado a crianças Idosos: TORLÓS® age igualmente bem e também é bem tolerado pela maioria dos pacientes adultos mais jovens e mais idosos A maioria dos pacientes mais idosos requer a mesma dose que os pacientes mais jovens Uso em Pacientes de Raça Negra com Pressão Alta e Hipertrofia do Ventrículo Esquerdo: em um estudo que envolveu pacientes com pressão alta e hipertrofia do ventrículo esquerdo, losartana potássica diminuiu o risco de derrame e ataque cardíaco e ajudou os pacientes a viverem mais No entanto, esse estudo também mostrou que esses benefícios, quando BU-02 comparados aos benefícios de outro medicamento para hipertensão denominado atenolol, não se aplicam aos pacientes de raça negra Dirigir ou Operar Máquinas: quase todos os pacientes podem realizar essas atividades, porém você deve evitar atividades que exijam muita atenção (por exemplo, dirigir ou operar máquinas perigosas) até saber como você reage ao medicamento
Advertências e precauções e
Reações Adversas
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR Qualquer medicamento pode apresentar efeitos não esperados ou indesejáveis, denominados efeitos adversos Alguns pacientes podem apresentar tontura, fadiga, atordoamento, erupções cutâneas, urticária, alteração de paladar, vômitos ou aumento da sensibilidade da pele ao sol Seu médico tem uma lista mais completa dos efeitos adversos Informe ao seu médico imediatamente se você apresentar esses sintomas ou outros sintomas incomuns Alguns pacientes, especialmente pacientes com diabetes tipo 2 e proteinúria, também podem apresentar aumento dos níveis de potássio no sangue Informe ao seu médico se você apresentar doença renal e diabetes tipo 2 e proteinúria e/ou estiver tomando suplementos de potássio, medicamentos poupadores de potássio ou substitutos do sal da dieta que contenham potássio Se você apresentar reação alérgica com inchaço da face, dos lábios, da garganta e/ou da língua que possa dificultar sua respiração ou capacidade de engolir, pare de tomar TORLÓS® e procure seu médico imediatamente Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento Informe também à empresa através do seu serviço de atendimento 9 O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO
Composição
COMPOSIÇÃO Cada comprimido revestido de TORLÓS® 25 mg contém: losartana potássica 25 mg Excipientes: lactose monoidratada, amido, hiprolose, talco, estearato de magnésio, TRC coat A e óxido de ferro vermelho II- INFORMAÇÕES AO PACIENTE 1
COMPOSIÇÃO) Você não deve tomar TORLÓS® se você tem diabetes e está tomando um medicamento chamado alisquireno para reduzir a pressão arterial 4
COMPOSIÇÃO Cada comprimido revestido de TORLÓS® 50 mg contém: losartana potássica 50 mg Excipientes: lactose monoidratada, amido, hiprolose, talco, estearato de magnésio, TRC Coat A e óxido de ferro vermelho Cada comprimido revestido de TORLÓS® 100 mg contém: losartana potássica 100 mg Excipientes: lactose, amido, estearato de magnésio, celulose microcristalina, talco, dióxido de silício (coloidal), hipromelose, hiprolose e dióxido de titânio II- INFORMAÇÕES AO PACIENTE 1
Superdosagem
Em caso de superdose, avise ao seu médico imediatamente para que ele possa prestar atendimento de urgência
Os sintomas mais prováveis de superdose são pressão arterial baixa e ritmo cardíaco acelerado, mas também podem ocorrer batimentos cardíacos mais lentos BU-05 Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível Ligue para 0800 722 6001, se você precisar de mais orientações
Os sintomas mais prováveis de superdose são pressão arterial baixa e ritmo cardíaco acelerado, mas também podem ocorrer batimentos cardíacos mais lentos Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível BU-02 Ligue para 0800 722 6001, se você precisar de mais orientações
Interação Medicamentosa
Nos estudos clínicos de farmacocinética realizados com hidroclorotiazida, digoxina, varfarina, cimetidina, fenobarbital, cetoconazol e eritromicina, não foram identificadas interações medicamentosas de importância clínica.
Houve relatos de redução dos níveis do metabólito ativo pela rifampicina e pelo fluconazol. Não foram avaliadas as consequências clínicas dessas interações.
A exemplo do que ocorre com outros fármacos que bloqueiam a angiotensina II ou os seus efeitos, o uso concomitante de diuréticos poupadores de potássio (como espironolactona, triantereno e amilorida), suplementos de potássio ou substitutos do sal que contenham potássio pode resultar em aumento do potássio sérico.
A exemplo de outros fármacos que afetam a excreção de sódio, a excreção de lítio pode ser reduzida. Por isso, deve-se monitorar com cautela os níveis séricos do lítio, caso sais de lítio sejam administrados concomitantemente a antagonistas de receptores de angiotensina II.
Os fármacos anti-inflamatórios não esteroides (AINEs), incluindo os inibidores seletivos da cicloxigenase-2 (inibidores da COX-2), podem reduzir o efeito de diuréticos e outros medicamentos anti-hipertensivos. Por isso, o efeito anti-hipertensivo de antagonistas de receptores da angiotensina II ou inibidores da ECA pode ser atenuado pelos AINEs, incluindo os inibidores seletivos da COX-2.
Para alguns pacientes com função renal comprometida (por exemplo, pacientes idosos ou hipovolêmicos, incluindo aqueles em terapia diurética) que estão em tratamento com fármacos anti-inflamatórios não esteroides, incluindo inibidores seletivos da COX-2, a administração concomitante de antagonistas de receptores da angiotensina II ou inibidores da ECA pode resultar em maior deterioração da função renal, incluindo possível insuficiência renal aguda.
Esses efeitos são usualmente reversíveis, portanto a combinação deve ser administrada com cautela a pacientes com comprometimento da função renal.
Dado do estudo clínico demonstrou que o bloqueio duplo do sistema renina-angiotensina-aldosterona através do uso combinado de inibidores da ECA, antagonistas de receptor da angiotensina II ou alisquireno está associado com uma frequência maior de reações adversas tais como hipotensão, hipercalemia e diminuição da função renal (incluindo insuficiência renal aguda) comparado com o uso de apenas um agente que atua no sistema renina-angiotensina-aldosterona.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados da eficácia
Em estudos clínicos, a administração de losartana potássica em dose única diária a pacientes com hipertensão essencial leve à moderada propiciou reduções estatisticamente significativas das pressões arteriais sistólica e diastólica; nos estudos clínicos, o efeito anti-hipertensivo foi mantido por até um ano.
A medida da pressão arterial no vale (24 horas após a dose) em relação à pressão no pico (5 a 6 horas após a dose) demonstrou redução da pressão arterial relativamente uniforme nas 24 horas.
O efeito anti-hipertensivo acompanhou os ritmos diurnos naturais. A redução da pressão arterial no final do intervalo posológico foi de aproximadamente 70% a 80% do efeito observado 5 a 6 horas após a dose. A descontinuação da losartana em pacientes hipertensos não resultou em rebote abrupto da pressão arterial.
Apesar da diminuição significativa da pressão arterial, a administração de losartana potássica não exerceu efeito clinicamente significativo na frequência cardíaca.
A administração de 50mg a 100mg de losartana potássica uma vez ao dia produz efeito anti-hipertensivo significativamente maior do que a administração de 50mg a 100mg de captopril uma vez ao dia. O efeito anti-hipertensivo de losartana potássica 50mg é semelhante ao da administração única diária de enalapril 20mg.
O efeito anti-hipertensivo da administração única diária de 50mg a 100mg de losartana potássica é comparável ao da administração única diária de 50mg a 100mg de atenolol e equivalente ao da administração de 5mg a 10mg de felodipina de liberação prolongada em idosos hipertensos ( ? 65 anos) após 12 semanas de terapia.
A losartana potássica é igualmente eficaz em pacientes hipertensos de ambos os sexos e em pacientes hipertensos mais jovens (< 65 anos) e mais velhos ( ? 65 anos).
A exemplo do que ocorre com outros medicamentos que afetam o sistema renina-angiotensina, a resposta média à monoterapia com losartana é menor em pacientes da raça negra, embora o efeito anti-hipertensivo de losartana se manifeste em todas as raças.
Os efeitos de losartana potássica administrada concomitantemente com diuréticos tiazídicos na redução da pressão arterial são aproximadamente aditivos.
Estudo Life (Losartan Intervention For Endpoint reduction in hypertension)
Foi um estudo de grande porte, multicêntrico, multinacional, randômico e triplo-cego, controlado com medicação ativa, que envolveu 9.193 pacientes hipertensos com idades entre 55 e 80 anos (média de 67 anos) e hipertrofia ventricular esquerda documentada por ECG.
No período basal, 1.195 (13%) pacientes apresentavam diabetes; 1.326 (14%), hipertensão sistólica isolada; 1.468 (17%), doença coronariana e 728 (8%), doença vascular cerebral. O objetivo do estudo foi demonstrar os efeitos protetores cardiovasculares de losartana potássica versus atenolol, além dos benefícios do controle da pressão arterial (medida no vale).
Para atingir esse objetivo, a meta da pressão arterial foi a mesma para os dois grupos de tratamento. Os pacientes foram distribuídos de modo randômico para receber 50mg de losartana potássica ou 50mg de atenolol uma vez ao dia. Quando a meta da pressão arterial (< 140/90mmHg) não era atingida, adicionava-se, em primeiro lugar, a hidroclorotiazida (12,5mg) e, se necessário, aumentava-se a dose de losartana potássica ou de atenolol para 100mg uma vez ao dia.
Se para atingir a meta ainda houvesse a necessidade de outras modificações do esquema terapêutico (por exemplo, aumento da dose de hidroclorotiazida para 25mg ou adição de outro tratamento diurético ou de bloqueadores dos canais de cálcio, alfabloqueadores ou agentes de ação central), estas eram feitas. A adição de inibidores da ECA, antagonistas da angiotensina II ou betabloqueadores não foi permitida.
Nos dois grupos de tratamento, a pressão arterial foi significativamente reduzida para níveis semelhantes e uma proporção semelhante de pacientes atingiu a meta da pressão arterial. A duração média do período de acompanhamento foi de 4,8 anos.
O desfecho primário foi o composto de morbidade e mortalidade cardiovasculares, avaliado pela redução da incidência combinada de morte cardiovascular, acidente vascular cerebral e infarto do miocárdio.
Os resultados mostraram que o tratamento com losartana potássica, em comparação ao com atenolol, resultou em 13,0 % de redução do risco (P = 0,021) para os pacientes que atingiram o desfecho primário composto.

Figura 1. Estimativas de Kaplan-Meier do desfecho primário composto de morte cardiovascular, acidente vascular cerebral ou infarto do miocárdio nos grupos que receberam losartana potássica ou atenolol, ajustadas para o escore de risco de Framingham e o grau de hipertrofia ventricular esquerda (HVE) ao ECG no período basal.
O tratamento com losartana potássica, em comparação ao com atenolol, reduziu o risco de acidente vascular cerebral em 25% (P = 0,001). As taxas de morte cardiovascular e de infarto do miocárdio não foram significativamente diferentes entre os grupos de tratamento. O efeito de losartana potássica no desfecho primário composto aparentemente foi superior e além dos efeitos benéficos do controle da pressão arterial isoladamente.
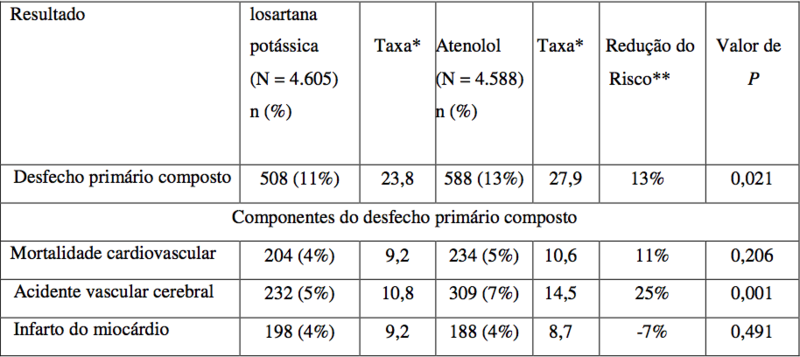
*Por 1.000 pacientes-anos de acompanhamento.
**Ajustada para o escore de risco de Framingham e o grau de HVE ao ECG no período basal.
Os outros desfechos clínicos do estudo Life foram: mortalidade por todas as causas, hospitalização por insuficiência cardíaca ou angina pectoris, procedimentos de revascularização coronariana ou periférica e parada cardíaca com ressuscitação.
Não ocorreram diferenças significativas entre os grupos de tratamento nas taxas desses desfechos. Os pacientes que receberam losartana potássica apresentaram redução significativamente maior dos índices de hipertrofia ventricular esquerda no ECG em comparação com os que receberam atenolol.
Os efeitos de losartana potássica versus atenolol na morbimortalidade cardiovascular foram examinados em subgrupos de pacientes com histórico de diabetes mellitus (n = 1.195) ou hipertensão sistólica isolada (HSI) (n = 1.326) no período basal.
Em relação ao desfecho primário composto, os resultados observados nesses subgrupos foram compatíveis com o benefício do tratamento com losartana potássica observado na população global do estudo: observou-se redução de 24% do risco (P = 0,03) nos pacientes com diabetes e de 25% (P = 0,06) nos pacientes com hipertensão sistólica isolada.
Compatível com os resultados observados na população global, a redução do risco de acidente vascular cerebral foi um importante fator contribuinte para o benefício observado nos pacientes com diabetes ou HSI.
Raça
Com base no estudo Life, os benefícios de losartana potássica sobre a morbidade e a mortalidade cardiovasculares em comparação com os do atenolol não se aplicam a pacientes negros com hipertensão e hipertrofia ventricular esquerda, embora os dois esquemas de tratamento tenham reduzido de forma eficaz a pressão arterial nessa população de pacientes.
No estudo Life, losartana potássica, em comparação ao atenolol, diminuiu o risco de morbidade e mortalidade cardiovasculares em pacientes hipertensos não negros com hipertrofia ventricular esquerda (n = 8.660) conforme medido pelo desfecho primário de incidência combinada de morte cardiovascular, acidente vascular cerebral e infarto do miocárdio (P = 0,003).
Nesse estudo, entretanto, o risco de apresentar o desfecho primário composto foi menor em pacientes negros que receberam atenolol em comparação com os que receberam losartana potássica (P = 0,03). No subgrupo de pacientes negros (n = 533; 6% dos pacientes do estudo Life), ocorreram 29 desfechos primários entre os 263 pacientes do grupo do atenolol (11%, 25,9/1.000 pacientes-anos) e 46 entre os 270 pacientes (17%, 41,8/1.000 pacientes-anos) do grupo de losartana potássica.
Nesse estudo, losartana potássica em geral foi bem tolerada e seu perfil de tolerabilidade foi superior ao do atenolol, conforme evidenciado pela incidência significativamente mais baixa de descontinuações por efeitos adversos.
Estudo RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartana)
Foi um estudo mundial de grande porte, multicêntrico, com distribuição randômica, controlado com placebo e duplo-cego que envolveu 1.513 pacientes com diabetes tipo 2 e proteinúria (751 receberam losartana potássica), com ou sem hipertensão.
O objetivo do estudo foi demonstrar os efeitos protetores renais de losartana potássica além dos benefícios do controle da pressão arterial isoladamente. Para atingir esse objetivo, a meta da pressão arterial foi a mesma para os dois grupos de tratamento.
Os pacientes com proteinúria e creatinina sérica entre 1,3 e 3,0mg/dL foram distribuídos de modo randômico para receber 50mg de losartana potássica uma vez ao dia, titulados de acordo com a resposta da pressão arterial, ou placebo e tratamento anti-hipertensivo convencional, excluindo-se inibidores da ECA e antagonistas da angiotensina II.
Os pesquisadores foram orientados a titular o medicamento do estudo para 100mg uma vez ao dia, conforme apropriado; 72% dos pacientes tomaram a dose diária de 100mg durante a maior parte do tempo em que receberam o medicamento de estudo.
Em ambos os grupos, quando necessário, puderam ser adicionados outros agentes anti-hipertensivos (diuréticos, bloqueadores dos canais de cálcio, alfa ou betabloqueadores e agentes de ação central). Os pacientes foram acompanhados por até 4,6 anos (média de 3,4 anos).
O desfecho primário do estudo foi o desfecho composto de duplicação da creatinina sérica, insuficiência renal terminal (necessidade de diálise ou transplante) ou morte.
Os resultados mostraram que o tratamento com losartana potássica (327 eventos) em comparação com o placebo (359 eventos) resultou em redução do risco de 16,1% (P = 0,022) para os pacientes que atingiram o desfecho primário composto.
Os resultados também demonstraram redução significativa do risco no grupo tratado com losartana potássica em relação aos seguintes componentes individuais e combinados do desfecho primário: 25,3% de redução do risco de duplicação da creatinina sérica (P = 0,006), 28,6% de redução do risco de insuficiência renal terminal (P = 0,002), 19,9% de redução do risco de insuficiência renal terminal ou morte (P = 0,009) e 21% de redução do risco de duplicação da creatinina sérica ou de insuficiência renal terminal ( P = 0,010).
A taxa de morte por todas as causas não foi significativamente diferente entre os dois grupos de tratamento.
Os desfechos secundários do estudo foram: alteração da proteinúria, taxa de progressão da nefropatia e o composto de morbimortalidade de causas cardiovasculares (hospitalização por insuficiência cardíaca, infarto do miocárdio, revascularização, acidente vascular cerebral, hospitalização por angina instável ou morte cardiovascular).
Os resultados mostraram redução média de 34,3% do nível de proteinúria no grupo de losartana potássica (P < 0,001). O tratamento com losartana potássica reduziu a taxa de declínio da função renal durante a fase crônica do estudo em 13,9%, P = 0,003 (taxa média de declínio de 18,5%, P = 0,01), conforme medido pela recíproca da concentração sérica de creatinina.
Não houve diferença significativa entre o grupo que recebeu losartana potássica (247 eventos) e o grupo placebo (268 eventos) no desfecho composto de morbimortalidade cardiovascular, embora o estudo não tenha sido desenhado para detectar esse efeito.
Nesse estudo, losartana potássica em geral foi bem tolerada, conforme evidenciado pela incidência semelhante de descontinuações por efeitos adversos na comparação com o placebo.
Estudos Elite I e Elite II
No estudo Elite, de 48 semanas de duração, que envolveu 722 pacientes com insuficiência cardíaca (Classes II-IV da New York Heart Association [NYHA]), não foram observadas diferenças no desfecho primário de disfunção renal persistente entre os pacientes que receberam losartana potássica e os que receberam captopril.
A observação não esperada do benefício superior de losartana potássica na redução do risco de morte em relação ao captopril no estudo Elite não foi confirmada no estudo de sobrevida definitivo, o Elite II, descrito a seguir.
No Elite II, estudo que envolveu pacientes com insuficiência cardíaca, desenhado para avaliar prospectivamente a mortalidade, comparou-se um esquema de 50mg de losartana potássica em dose única diária (dose inicial de 12,5mg titulada para 25mg e 50mg 1x/dia) a um esquema de 50mg de captopril, 3x/dia (dose inicial de 12,5mg titulada para 25mg e 50mg 3x/dia).
Nesse estudo (n = 3.152), pacientes com insuficiência cardíaca (Classe II-IV da NYHA) foram acompanhados durante dois anos aproximadamente (mediana de acompanhamento de 1,5 ano) para que se avaliasse se losartana potássica era superior ao captopril na redução da mortalidade por todas as causas.
O desfecho primário não mostrou diferença estatisticamente significativa entre losartana potássica e captopril na redução da mortalidade por todas as causas (17,7% para losartana potássica e 15,9% para o captopril, P = 0,16). O desfecho secundário não mostrou diferença estatisticamente significativa na redução de morte súbita de origem cardíaca e/ou parada cardíaca com ressuscitação (9,0% para losartana potássica e 7,3% para captopril, P = 0,08).
O desfecho terciário de mortalidade por todas as causas e/ou hospitalizações por todas as causas não mostrou diferença estatisticamente significativa entre losartana potássica e captopril (47,7% para losartana potássica e 44,9% para captopril, P = 0,18).
Em geral, os outros desfechos de morbidade e de mortalidade, incluindo melhora da classe funcional de acordo com a classificação da NYHA, não foram diferentes entre os grupos de tratamento.
Nesses dois estudos clínicos controlados em pacientes com insuficiência cardíaca, losartana potássica em geral foi bem tolerada e seu perfil de tolerabilidade foi superior ao do captopril, conforme avaliado pela incidência significativamente mais baixa de descontinuações por efeitos adversos e incidência significativamente mais baixa de tosse.
Características Farmacológicas
Farmacologia clínica
A losartana potássica, a primeira de uma nova classe de agentes para o tratamento da hipertensão e da insuficiência cardíaca, é um antagonista do receptor (tipo AT1) da angiotensina II.
A losartana também reduz o risco combinado de morte cardiovascular, acidente vascular cerebral e infarto do miocárdio em pacientes hipertensos com hipertrofia ventricular esquerda e oferece proteção renal para pacientes com diabetes tipo 2 e proteinúria.
Mecanismo de ação
A angiotensina II, um potente vasoconstritor, é o principal hormônio ativo do sistema renina-angiotensina e o maior determinante da fisiopatologia da hipertensão. A angiotensina II liga-se ao receptor AT1 encontrado em muitos tecidos (por exemplo, músculo liso vascular, glândulas adrenais, rins e coração) e desencadeia várias ações biológicas importantes, incluindo vasoconstrição e liberação de aldosterona.
A angiotensina II também estimula a proLiferação de células musculares lisas. Foi identificado um segundo receptor da angiotensina II (subtipo AT2), mas sua função na homeostase cardiovascular é desconhecida. A losartana é um composto sintético potente, ativo por via oral.
De acordo com bioensaios de ligação e farmacologia, a losartana liga-se seletivamente ao receptor AT1. In vitro e in vivo, tanto a losartana como o seu metabólito ácido carboxílico farmacologicamente ativo (E-3174) bloqueiam todas as ações fisiologicamente relevantes da angiotensina II, independentemente da fonte ou da via de síntese.
Diferentemente de alguns antagonistas peptídicos da angiotensina II, a losartana não apresenta efeitos agonistas.
A losartana liga-se seletivamente ao receptor AT1 e não se liga ou bloqueia outros receptores de hormônios ou canais iônicos importantes na regulação cardiovascular.
Além disso, a losartana não inibe a ECA (cininase II), a enzima que degrada a bradicinina.
Consequentemente, os efeitos não relacionados diretamente ao bloqueio do receptor AT1, como a potencialização dos efeitos mediados pela bradicinina ou o desenvolvimento de edema (losartana: 1,7%; placebo: 1,9%), não estão associados à losartana.
Absorção
Após a administração oral, a losartana é bem absorvida e sofre metabolismo de primeira passagem, formando um metabólito ácido carboxílico ativo e outros metabólitos inativos. A biodisponibilidade sistêmica dos comprimidos de losartana é de aproximadamente 33%.
As concentrações máximas médias de losartana e de seu metabólito ativo são atingidas em 1 hora e em 3 a 4 horas, respectivamente. Não houve efeito clinicamente significativo no perfil da concentração plasmática de losartana quando o fármaco foi administrado com uma refeição padrão.
Distribuição
Tanto a losartana como o seu metabólito ativo apresentam taxa de ligação a proteínas plasmáticas ? 99%, principalmente com a albumina. O volume de distribuição da losartana é de 34 litros. Estudos em ratos indicam que a losartana praticamente não atravessa a barreira hematoencefálica.
Metabolismo
Aproximadamente 14% da dose de losartana administrada por via intravenosa ou oral é convertida em seu metabólito ativo. Após a administração intravenosa ou oral de losartana potássica marcada com 14C, a radioatividade plasmática circulante principal é atribuída à losartana e ao seu metabólito ativo.
Observou-se conversão mínima de losartana ao seu metabólito ativo em aproximadamente 1% dos indivíduos estudados.
Além do metabólito ativo, são formados metabólitos inativos, incluindo dois principais, formados por hidroxilação da cadeia lateral butílica, e um secundário, um glucuronídeo N-2 tetrazol.
Eliminação
A depuração plasmática da losartana e a de seu metabólito ativo são de aproximadamente 600mL/min e 50mL/min, respectivamente. A depuração renal da losartana e a de seu metabólito ativo são de aproximadamente 74mL/min e 26mL/min, respectivamente.
Quando a losartana é administrada por via oral, aproximadamente 4% da dose é excretada inalterada na urina e 6%, na forma de metabólito ativo. As farmacocinéticas da losartana e de seu metabólito ativo são lineares com doses de losartana potássica de até 200mg, administradas por via oral.
Após a administração oral, as concentrações plasmáticas da losartana e de seu metabólito ativo diminuem poliexponencialmente, com meia-vida final de aproximadamente 2 horas e de 6 a 9 horas, respectivamente. Durante a administração da dose única diária de 100mg, a losartana e o seu metabólito ativo não se acumulam significativamente no plasma.
Tanto a excreção biliar como a urinária contribuem para a eliminação de losartana e seus metabólitos. Após uma dose oral de losartana potássica marcada com 14C em humanos, aproximadamente 35% da radioatividade é recuperada na urina e 58%, nas fezes. Após dose intravenosa de losartana potássica marcada com 14C em humanos, aproximadamente 43% da radioatividade é recuperada na urina e 50%, nas fezes.
Farmacodinâmica
Losartana
A losartana inibe as respostas pressoras sistólica e diastólica a infusões de angiotensina II. No pico, 100mg de losartana potássica inibem essas respostas em aproximadamente 85%; 24 horas após a administração de doses únicas e múltiplas, a inibição é de cerca de 26%-39%.
Durante a administração de losartana, a remoção do feedback negativo da angiotensina II sobre a secreção de renina aumenta a atividade da renina plasmática, o que resulta em aumento da angiotensina II no plasma.
Durante o tratamento crônico (6 semanas) de pacientes hipertensos com 100mg/dia de losartana, foram observados aumentos nos níveis plasmáticos de angiotensina II de aproximadamente 2-3 vezes quando ocorreram concentrações plasmáticas máximas do fármaco.
Em alguns pacientes, foram observados aumentos maiores, particularmente durante o tratamento de curto prazo (2 semanas). No entanto, a atividade anti-hipertensiva e a supressão da concentração plasmática da aldosterona foram aparentes em 2 e 6 semanas, indicando bloqueio efetivo do receptor de angiotensina II.
Após a descontinuação da losartana, os níveis de atividade da renina plasmática (ARP) e da angiotensina II declinaram aos níveis anteriores ao tratamento em 3 dias.
Uma vez que a losartana é um antagonista específico do receptor de angiotensina II tipo AT1, esse composto não inibe a ECA (cininase II), a enzima que degrada a bradicinina. Em um estudo que comparou os efeitos de 20mg e de 100mg de losartana potássica e de um inibidor da ECA nas respostas à angiotensina I, à angiotensina II e à bradicinina, a losartana demonstrou bloquear as respostas à angiotensina I e à angiotensina II sem afetar as respostas à bradicinina.
Esse achado é compatível com o mecanismo de ação específico da losartana. Em contrapartida, o inibidor da ECA demonstrou bloquear as respostas à angiotensina I e aumentar as respostas à bradicinina sem alterar a resposta à angiotensina II, proporcionando assim uma diferenciação farmacodinâmica entre a losartana e os inibidores da ECA.
As concentrações plasmáticas de losartana e seu metabólito ativo e o efeito anti-hipertensivo da losartana crescem com o aumento da dose.
Como a losartana e seu metabólito ativo são ambos antagonistas do receptor de angiotensina II, eles contribuem para o efeito anti-hipertensivo.
Em um estudo de dose única que incluiu indivíduos do sexo masculino sadios, a administração de 100mg de losartana potássica, sob condições nutricionais com altos e baixos teores de sal, não alterou a taxa de filtração glomerular, o fluxo plasmático renal efetivo ou a fração de filtração.
A losartana apresentou efeito natriurético que foi mais acentuado com uma dieta pobre em sal e que pareceu não estar relacionado à inibição da reabsorção inicial proximal de sódio. A losartana também aumentou de modo transitório a excreção urinária de ácido úrico.
Em pacientes hipertensos sem diabetes com proteinúria (? 2 g/24 horas) tratados durante 8 semanas, a administração de 50mg de losartana potássica titulada para 100mg reduziu significativamente a proteinúria em 42%. A excreção fracionária de albumina e de IgG também foi significativamente reduzida. Nesses pacientes, a losartana manteve a taxa de filtração glomerular e reduziu a fração de filtração.
Em hipertensas pós-menopáusicas tratadas durante 4 semanas, a losartana potássica na dose de 50mg não apresentou efeito sobre os níveis renais ou sistêmicos de prostaglandina.
A losartana não teve efeito sobre os reflexos autonômicos e não teve efeitos sustentados sobre a norepinefrina plasmática.
A losartana potássica, administrada em doses únicas diárias de até 150mg, não causou alterações clinicamente importantes nos níveis de triglicérides, colesterol total ou colesterol HDL de pacientes hipertensos em jejum. As mesmas doses de losartana não apresentaram efeito sobre os níveis de glicemia de jejum.
A losartana potássica, administrada em doses únicas diárias de até 150mg, não causou alterações clinicamente importantes nos níveis de triglicérides, colesterol total ou colesterol HDL de pacientes hipertensos em jejum. As mesmas doses de losartana não apresentaram efeito sobre os níveis de glicemia de jejum.
Em um estudo de 12 semanas, de desenho paralelo, que incluiu pacientes com insuficiência ventricular esquerda (Classes Funcionais II-IV da NYHA), cuja maioria estava recebendo diuréticos e/ou digitálicos, a losartana potássica administrada em doses únicas diárias de 2,5mg, 10mg, 25mg e 50mg foi comparada a placebo. As doses de 25mg e 50mg produziram efeitos hemodinâmicos e neuro-hormonais positivos, que foram mantidos durante todo o estudo.
As respostas hemodinâmicas foram caracterizadas por aumento do índice cardíaco e reduções da pressão capilar pulmonar, resistência vascular sistêmica, pressão arterial sistêmica média e frequência cardíaca. A ocorrência de hipotensão nesses pacientes com insuficiência cardíaca foi relacionada à dose.
Os resultados neuro-hormonais foram caracterizados por redução dos níveis circulantes de aldosterona e norepinefrina.
Dizeres Legais
III- DIZERES LEGAIS MS - 1 0525 0005 Farmacêutica Responsável: Dra Cintia M Ito Sakaguti- CRF-SP n° 31 875 Fabricado por: Torrent Pharmaceuticals Ltd Baddi - Índia Importado por: Torrent do Brasil Ltda Av Tamboré, 1180 - Módulo A5 Barueri - SP CNPJ 33 078 528/0001-32 SAC: 0800 7708818 VENDA SOB PRESCRIÇÃO MÉDICA Esta bula foi aprovada em 15/07/2015 BU-05 Guia de Submissão Eletrônica de Texto de Bula_v5_13 01 14 Anexo B Histórico de alteração para a bula Dados da submissão eletrônica Dados da petição/notificação que altera bula Dados das alterações de bulas Data do expediente N° expediente Assunto Data do expediente N° expediente Assunto Data de aprovação Itens de bula Versões (VP/VPS)
III- DIZERES LEGAIS MS - 1 0525 0005 Farmacêutica Responsável: Dra Cintia M Ito Sakaguti- CRF-SP n° 31 875 Fabricado por: Torrent Pharmaceuticals Ltd Indrad - Índia Importado por: Torrent do Brasil Ltda Av Tamboré, 1180 - Módulo A5 Barueri - SP CNPJ 33 078 528/0001-32 SAC: 0800 7708818 VENDA SOB PRESCRIÇÃO MÉDICA Esta bula foi aprovada em 15/07/2015 BU-05 Guia de Submissão Eletrônica de Texto de Bula_v5_13 01 14 Anexo B Histórico de alteração para a bula Dados da submissão eletrônica Dados da petição/notificação que altera bula Dados das alterações de bulas Data do expediente N° expediente Assunto Data do expediente N° expediente Assunto Data de aprovação Itens de bula Versões (VP/VPS)
III- DIZERES LEGAIS MS - 1 0525 0005 Farmacêutica Responsável: Dra Cintia M Ito Sakaguti- CRF-SP n° 31 875 Fabricado por: Torrent Pharmaceuticals Ltd Indrad - Índia Importado por: Torrent do Brasil Ltda Av Tamboré, 1180 - Módulo A5 Barueri - SP CNPJ 33 078 528/0001-32 SAC: 0800 7708818 VENDA SOB PRESCRIÇÃO MÉDICA Esta bula foi aprovada em 11/09/2014 BU-02 BU-02 Baddi BULA PARA PACIENTE Bula de acordo com a Resolução-RDC nº 47/2009 TORLÓS® losartana potássica
III- DIZERES LEGAIS MS - 1 0525 0005 Farmacêutica Responsável: Dra Cintia M Ito Sakaguti- CRF-SP n° 31 875 Fabricado por: Torrent Pharmaceuticals Ltd Baddi - Índia Importado por: Torrent do Brasil Ltda Av Tamboré, 1180 - Módulo A5 Barueri - SP CNPJ 33 078 528/0001-32 SAC: 0800 7708818 VENDA SOB PRESCRIÇÃO MÉDICA Esta bula foi aprovada em 11/09/2014 BU-02 BU-02 Anexo B Histórico de alteração para a bula20 Dados da submissão eletrônica Dados da petição/notificação que altera bula Dados das alterações de bulas Data do expediente N° expediente Assunto Data do expediente N° expediente Assunto Data de aprovação Itens de bula 21 Versões (VP/VPS)22
Dizeres Legais VP e VPS Comprimidos revestidos 50 mg: embalagens com 14 e 30 comprimidos Comprimidos revestidos 100 mg: embalagens com 10 e 30 comprimidos 27/08/2014 0712358/14-2 Notificação de Alteração de Texto de Bula - RDC 60/12
Dizeres Legais VP e VPS Comprimidos revestidos 50 mg: embalagens com 14 e 30 comprimidos Comprimidos revestidos 100 mg: embalagens com 10 e 30 comprimidos 04/02/2014 0086391/14-2 Notificação de Alteração de Texto de Bula - RDC 60/12 O que devo saber antes de usar este medicamento ,
Dizeres Legais VP e VPS Comprimidos revestidos 50 mg: embalagens com 14 e 30 comprimidos Comprimidos revestidos 100 mg: embalagens com 10 e 30 comprimidos Guia de Submissão Eletrônica de Texto de Bula_v5_13 01 14 11/10/2013 0858705/13-1 Inclusão Inicial de Texto de Bula – RDC 60-12 Atualização de texto de bula conforme bula padrão publicada no bulário VP e VPS Comprimidos revestidos 50 mg: embalagens com 14 e 30 comprimidos Comprimidos revestidos 100 mg: embalagens com 10 e 30 comprimidos Guia de Submissão Eletrônica de Texto de Bula_v5_13 01 14
informações complementares
| Fabricante |
| TORRENT |
| Princípio ativo |
| Losartana Potássica |
| Categoria do medicamento |
| Medicamentos de A-Z |
