Comparamos o preço de ZESTRIL - 20MG 30 COMPRIMIDOS, veja o menor preço

RReferência
Para que serve
Hipertensão
Zestril é indicado para o tratamento da hipertensão (pressão alta) e hipertensão renovascular.
Pode ser usado como monoterapia (sozinho) ou associado a outras classes de medicamentos anti-hipertensivos.
Insuficiência Cardíaca Congestiva
Zestril é indicado para o controle da insuficiência cardíaca congestiva (incapacidade do coração de bombear o sangue de maneira adequada), como tratamento adjuvante com diuréticos (que estimulam a eliminação da urina) e, quando apropriado, digitálicos (medicamento utilizado para problemas do coração).
Doses elevadas reduzem o risco de mortalidade e hospitalização.
Infarto Agudo do Miocárdio
Zestril é indicado para o tratamento de pacientes hemodinamicamente estáveis (com circulação sanguínea adequada) que sofreram infarto agudo do miocárdio nas últimas 24 horas, para prevenir o desenvolvimento subsequente de disfunção do ventrículo esquerdo (disfunção no músculo do coração) ou insuficiência cardíaca, além de melhorar a sobrevida.
Os pacientes devem receber, apropriadamente, o tratamento padrão recomendado tal como: trombolíticos (medicamentos utilizados para dissolução de coágulos sanguíneos), ácido acetilsalicílico e betabloqueadores (medicamentos que agem através do bloqueio de um receptor específico atuando como antiarrítmicos ou anti-hipertensivos).
Complicações Renais e Retinianas de Diabetes Mellitus
Zestril reduz a taxa de excreção urinária de albumina (tipo de proteína) em pacientes diabéticos normotensos (com pressão arterial normal) insulino-dependentes e em pacientes diabéticos hipertensos não insulino-dependentes que apresentam nefropatia incipiente (excreção urinária de albumina) caracterizada por microalbuminúria (tipo de excreção urinária de albumina).
Zestril reduz o risco de progressão de retinopatia em pacientes diabéticos normotensos insulino-dependentes.
Como Zestril funciona?
O uso contínuo de Zestril Controla a pressão arterial; controla os problemas de fraqueza no coração (insuficiência cardíaca congestiva) quando utilizado com medicamentos que estimulam a eliminação da urina (diuréticos), diminuindo o risco de hospitalização e mortalidade; previne problemas no coração após o infarto; protege os rins e os olhos (retina) em pacientes diabéticos.
Zestril é efetivo por 24 horas após dose oral única diária.
Contraindicação
Você não deve utilizar Zestril nas seguintes situações:
- Alergia ao lisinopril ou a qualquer um dos componentes da fórmula;
- Em pacientes com reações anafiláticas/anafilactoide (reações alérgicas graves e imediatas que podem levar à morte) ou angioedema (dificuldade para respirar ou engolir com ou sem inchaço na face, lábios, língua e/ou garganta) relacionado ao tratamento prévio com inibidor da enzima conversora da angiotensina (ex.: captopril, enalapril) e angioedema hereditário ou idiopático. Em pacientes no segundo e terceiro trimestres de gravidez;
- Em pacientes com diabettes mellitus (tipo I e II) ou insuficiência renal moderada que utilizam medicamentos contendo alisquireno.
Como usar
Zestril deve ser ingerido por via oral, com água como uma dose única diária.
Como a absorção de Zestril não é afetada por alimentos, os comprimidos podem ser administrados antes, durante ou após as refeições.
O seu médico pode ajustar a dose de acordo com a resposta hipotensora. Como ocorre com todas as medicações administradas 1 vez ao dia, Zestril deve ser administrado aproximadamente no mesmo horário todos os dias.
Zestril 5 mg e 10 mg
Podem ser partidos ao meio.
Zestril 20 mg
Este medicamento não deve ser partido.
Posologia
Pressão Alta (hipertensão)
A dose inicial recomendada é de 10 mg, 1 vez ao dia. A dose usual de manutenção é de 20 mg, 1 vez ao dia.
Em geral, se o efeito terapêutico desejado não puder ser alcançado em um período de 2 a 4 semanas em um certo nível de dosagem, a dose pode ser aumentada.
A dose máxima usada por longo prazo em estudos clínicos controlados foi de 80 mg por dia.
Doses iniciais menores são necessárias na presença de comprometimento da função renal, em pacientes nos quais a terapêutica diurética não possa ser descontinuada, em pacientes depletados de volume e/ou sal e em pacientes com hipertensão renovascular.
Posologia para populações especiais
Pacientes Tratados com Diuréticos
Pode ocorrer hipotensão (pressão arterial baixa) sintomática após o início da terapia com Zestril. Isto é mais provável em pacientes que estejam sendo tratados concomitantemente com diuréticos (que estimulam a eliminação da urina).
Recomenda-se precaução, pois estes pacientes podem estar depletados de volume e/ou sal.
Os diuréticos devem ser descontinuados 2 a 3 dias antes de iniciar o uso de Zestril.
Em pacientes hipertensos (com pressão alta) nos quais os diuréticos não possam ser descontinuados, a terapia com Zestril deve ser iniciada com a dose diária de 5 mg.
A dose subsequente de Zestril deve ser ajustada de acordo com a resposta da pressão arterial.
Se necessário, a terapêutica diurética pode recomeçar.
Pacientes com Insuficiência Renal
A posologia em pacientes com problemas renais deve estar de acordo com as instruções do seu médico (baseada no clearance de creatinina).
Hipertensão Renovascular
Alguns pacientes com hipertensão renovascular, especialmente aqueles com estenose bilateral da artéria renal (estreitamento da artéria dos rins) ou estenose da artéria renal em rim único, podem desenvolver resposta exagerada à primeira dose de Zestril, recomenda-se uma dose inicial de 2,5 mg ou 5 mg.
A partir daí, a dose pode ser ajustada de acordo com a resposta da pressão arterial.
Insuficiência Cardíaca Congestiva
Como tratamento adicional aos diuréticos e, quando apropriado, com digitálicos, a dose inicial é de 2,5 mg administrada 1 vez ao dia.
Para reduzir o risco de mortalidade e hospitalização, a dose de Zestril deve ser aumentada por incrementos de no máximo 10 mg, em intervalos de no mínimo 2 semanas, para a dose mais alta tolerada pelo paciente, no máximo de 35 mg uma vez ao dia.
O ajuste da dose deve ser baseado na resposta clínica individual do paciente.
Pacientes com alto risco de apresentar hipotensão sintomática como, por exemplo, pacientes com depleção de sal, com ou sem hiponatremia (concentração anormalmente baixa de íons de sódio no sangue), pacientes com hipovolemia (diminuição do volume sanguíneo) ou que tenham recebido rigorosa terapêutica diurética, devem ter estas condições corrigidas, se possível, antes de iniciar a terapia com Zestril.
O efeito da dose inicial de Zestril sobre a pressão arterial deve ser monitorado cuidadosamente.
Pacientes com alto risco de apresentar hipotensão sintomática como, por exemplo, pacientes com depleção de sal, com ou sem hiponatremia (concentração anormalmente baixa de íons de sódio no sangue), pacientes com hipovolemia (diminuição do volume sanguíneo) ou que tenham recebido rigorosa terapêutica diurética, devem ter estas condições corrigidas, se possível, antes de iniciar a terapia com Zestril.
O efeito da dose inicial de Zestril sobre a pressão arterial deve ser monitorado cuidadosamente.
Infarto Agudo do Miocárdio
O tratamento com Zestril pode ser iniciado dentro de 24 horas após o início dos sintomas.
A primeira dose de Zestril é de 5 mg, seguido de 5 mg após 24 horas, 10 mg após 48 horas e então 10 mg, 1 vez ao dia.
Pacientes com baixa pressão sistólica (120 mmHg ou menos) devem receber uma dose menor - 2,5 mg - quando o tratamento é iniciado ou durante os 3 primeiros dias após o infarto.
Se ocorrer hipotensão (pressão sistólica menor ou igual a 100 mmHg), uma dose diária de manutenção de 5 mg pode ser administrada com reduções temporárias a 2,5 mg, se necessário.
Se ocorrer hipotensão prolongada (pressão sistólica menor que 90 mmHg por mais de uma hora), Zestril deve ser descontinuado.
A administração deve continuar por 6 semanas. Pacientes que desenvolverem sintomas de insuficiência cardíaca devem continuar com Zestril.
Zestril é compatível com trinitrato de gliceril transdérmico ou intravenoso.
Complicações Renais e Retinianas de Diabetes Mellitus
A dose diária de Zestril é de 10 mg 1 vez ao dia. Essa dose pode ser aumentada para 20 mg, se necessário, para atingir a pressão diastólica, na posição sentada, inferior a 75 mmHg.
Em pacientes diabéticos hipertensos não insulino-dependentes, a dose é a mesma descrita acima para atingir uma pressão diastólica, na posição sentada, inferior a 90 mmHg.
Idosos
Não há alteração da eficácia e segurança no paciente idoso. Entretanto, quando a idade avançada está associada à diminuição da função renal, devem ser utilizadas as orientações para pacientes com insuficiência renal para determinar a dose inicial de Zestril. A partir daí, a posologia deve ser ajustada de acordo com a resposta da pressão arterial.
Consulte seu médico em relação à dose de Zestril a ser administrada nestes casos.
Crianças
A segurança e a eficácia de Zestril em crianças não foram estabelecidas.
Zestril deve ser utilizado continuamente até que o médico defina quando deve ser interrompido o uso deste medicamento.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer te usar Zestril?
Caso você se esqueça de tomar um dia o comprimido de Zestril, não é necessário tomar a dose esquecida, deve-se apenas tomar a próxima dose, no horário habitual.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Zestril deve ser utilizado com cuidado nas seguintes situações:
- Em pacientes com distúrbios vascular do colágeno e renal, deve-se considerar a monitoração periódica da contagem de glóbulos brancos no sangue;
- Em pacientes com problemas cardiovasculares, com diarreia ou vômito, com problemas renais e que fazem diálise;
- Em pacientes que estão em terapia diurética, dieta com restrição de sais e tomam suplementos de potássio ou substituto de sal de cozinha que contém potássio e outros medicamentos que podem elevar o nível de potássio no sangue (ex.: heparina e cotrimoxazol);
- Em pacientes que estão recebendo tratamento de dessensibilização para alguma alergia (ex.: picada de inseto);
- Em pacientes que têm pressão baixa pode-se notar fraqueza ou tontura;
- Em pacientes que apresentaram as seguintes reações alérgicas: inchaço das mãos, pés, tornozelos, face, lábios, garganta e/ou língua, com dificuldade de engolir ou respirar;
- Em pacientes negros o efeito pode ser menor quando comparado aos demais pacientes;
- Em pacientes diabéticos em uso de antidiabéticos, principalmente associado à insuficiência renal (mal funcionamento dos rins) pode haver queda do açúcar no sangue;
- A combinação de lisinopril com medicamentos inibidores da enzima conversora da angiotensina (ECA), bloqueadores dos receptores de angiotensina II (medicamentos que reduzem e controlam a pressão arterial) ou alisquireno não é recomendada.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Podem ocorrer as seguintes reações adversas:
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento)
Tontura, dor de cabeça, efeitos ortostáticos (incluindo queda da pressão arterial), tosse, diarreia, vômito e alterações da função dos rins.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
Hipercalemia (concentração superior ao normal de íons de potássio no sangue), alterações no humor (incluindo sintomas de depressão), parestesia (sensação de dormência), vertigem, alterações do paladar e do sono, alucinações, ataque cardíaco (infarto) e derrame cerebral possivelmente devido à queda de pressão arterial em pacientes de alto risco, palpitações.
Taquicardia (aumento da frequência cardíaca) e síncope* (desmaio), rinite, náusea, dor abdominal, indigestão, lesões na pele com vermelhidão (erupção cutânea). coceira (prurido), alergia/inchaço da face, extremidades, lábios, língua, glote e/ou laringe, impotência sexual, cansaço, fraqueza, uremia (aumento de ureia no sangue), aumento da creatinina no sangue e aumento nas enzimas hepáticas (do fígado).
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
Secreção inapropriada do hormônio antidiurético (hormônio que reduz a produção da urina), hiponatremia (concentração anormalmente baixa de íons de sódio no sangue), confusão mental, distúrbio olfativo, boca seca, urticária (coceira), alopecia (queda de cabelo), descamação e vermelhidão na pele (psoríase), insuficiência renal aguda (queda súbita da função dos rins), diminuição da hemoglobina e hematócrito e aumento na bilirrubina sérica.
Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento)
Depressão da medula óssea (diminuição da produção de componentes no sangue), anemia, trombocitopenia (diminuição do número de plaquetas no sangue), leucopenia (diminuição do número de leucócitos no sangue), agranulocitose (diminuição do número de glóbulos brancos do tipo granulócitos no sangue) e anemia hemolítica (anemia com destruição de glóbulos vermelhos no sangue).
Hipoglicemia (baixa concentração de glicose no sangue), broncoespasmo (contração do músculo liso nas paredes de brônquios e bronquíolos, causando o estreitamento dos mesmos), sinusite, pancreatite (inflamação do pâncreas), angioedema intestinal (inchaço do intestino), diaforese (suor excessivo), pênfigo (bolhas na pele), necrólise epidermal tóxica (doença de pele semelhante a uma queimadura de segundo grau).
Síndrome de Stevens-Johnson (vermelhidão inflamatória da pele com presença de bolhas), eritema multiforme (vermelhidão inflamatória da pele), pseudolinfoma cutâneo (lesões na pele semelhantes a uma queimadura de segundo grau), oligúria/anúria (diminuição/ausência de micção), hepatite (inflamação do fígado), icterícia (presença de coloração amarela na pele e nos olhos) e insuficiência hepática (mal funcionamento do fígado).
*Frequência se refere à população de pacientes hipertensos
A frequência na população de pacientes com insuficiência cardíaca congestiva é “comum”.
Reação com frequência não conhecida
Reação anafilática/anafilactoide.
Um complexo de sintomas tem sido relatado os quais podem incluir um ou mais dos sintomas a seguir: febre, vasculite, mialgia, artralgia/artrite, um exame positivo para anticorpos antinucleares (ANA), aumento da velocidade de hemossedimentação (VHS), eosinofilia, leucocitose, erupções cutâneas, fotossensibilidade e outras manifestações dermatológicas.
No caso de uso de doses elevadas de Zestril em pacientes com insuficiência cardíaca congestiva, pode ocorrer vertigem, um tipo de desmaio chamado de síncope, aumento anormal de cálcio no sangue e creatinina sérica aumentada.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
População Especial
Gestantes
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Capacidade de dirigir e operar máquinas
Não se espera que Zestril afete a capacidade de dirigir veículos e operar máquinas. Entretanto, alguns pacientes podem sentir tontura ou cansaço.
Pacientes portadores de diabetes
Atenção: este medicamento contém manitol (19,39 mg/comprimido de Zestril 5 mg, 38,78 mg/comprimido de Zestril 10 mg e 30,83 mg/comprimido de Zestril 20 mg), portanto, deve ser usado com cautela e a critério médico em pacientes portadores de diabetes.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Composição
Zestril 5 mg
Cada comprimido de Zestril contém:
5,45 mg de lisinopril di-hidratado equivalente a 5 mg de lisinopril anidro.
Excipientes: manitol, estearato de magnésio, amido de milho, amido de milho pré-gelatinizado, fosfato de cálcio dibásico di-hidratado e óxido férrico.
Zestril 10 mg
Cada comprimido de Zestril contém:
10,89 mg de lisinopril di-hidratado equivalente a 10 mg de lisinopril anidro.
Excipientes: manitol, estearato de magnésio, amido de milho, amido de milho pré-gelatinizado, fosfato de cálcio dibásico di-hidratado e óxido férrico.
Zestril 20 mg
Cada comprimido de Zestril contém:
21,78 mg de lisinopril di-hidratado equivalente a 20 mg de lisinopril anidro.
Excipientes: manitol, estearato de magnésio, amido de milho, amido de milho pré-gelatinizado, fosfato de cálcio dibásico di-hidratado e óxido férrico.
Superdosagem
Possíveis sintomas
Redução importante da pressão arterial, distúrbio eletrolítico e alteração renal.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Interação Medicamentosa
Anti-hipertensivos
Quando combinado com outros medicamentos anti-hipertensivos, pode ocorrer queda aditiva da pressão arterial. Estudos clínicos demostraram que o bloqueio do SRAA através do uso combinado de inibidores da ECA, bloqueadores do receptor de angiotensina II ou alisquireno é associado à maior frequência de reações adversas como hipotensão, hipercalemia e diminuição da função renal (incluindo insuficiência renal aguda) quando comparado ao uso individual de agente do SRAA.
Medicamentos que podem aumentar o risco de angioedema
O tratamento concomitante de inibidores da ECA com inibidores do receptor-alvo da rapamicina nos mamíferos (por exemplo, temsirolimo, sirolimo, everolimo), inibidores da endopeptidase neutra (por exemplo racecadotril) ou ativadores de plasminogênio tecidual pode aumentar o risco de angioederma.
Diuréticos
Quando um diurético é acrescentado à terapia com Lisinopril (substância ativa) o efeito anti-hipertensivo é geralmente potencializado.
Pacientes que já utilizam diuréticos e especialmente aqueles nos quais a terapia diurética tenha sido recentemente instituída podem ocasionalmente apresentar excessiva redução da pressão arterial quando Lisinopril (substância ativa) é acrescentado. A possibilidade de hipotensão sintomática com Lisinopril (substância ativa) pode ser minimizada com a interrupção do diurético antes da introdução do tratamento com Lisinopril (substância ativa).
Antidiabéticos
Estudos epidemiológicos têm sugerido que a administração concomitante de inibidores da ECA e medicamentos antidiabéticos (insulina, hipoglicemiantes orais) pode causar um aumento do efeito hipoglicemiante com risco de hipoglicemia. Este fenômeno aparece com mais frequência durante as primeiras semanas de tratamento combinado e em pacientes com insuficiência renal.
Suplementos de potássio, agentes poupadores de potássio ou substitutos do sal de cozinha contendo potássio e outros medicamentos que podem elevar o nível sérico de potássio
Embora estudos clínicos demonstrem que o potássio sérico geralmente se mantém dentro dos limites normais, hipercalemia ocorreu em alguns pacientes. Os fatores de risco para o desenvolvimento da hipercalemia incluem insuficiência renal, diabetes mellitus e uso concomitante de diuréticos poupadores de potássio (por ex.: espironolactona, triantereno ou amilorida), suplementos de potássio ou substitutos do sal de cozinha contendo potássio e outros medicamentos que podem elevar o nível sérico de potássio (ex.: heparina e cotrimoxazol).
O uso destes agentes, especialmente em pacientes com comprometimento da função renal, pode levar a um aumento significativo do potássio sérico.
Se o uso concomitante de Lisinopril (substância ativa) com qualquer um dos agentes acima mencionados é julgado apropriado, eles devem ser feitos com cautela, e com monitoração frequente do potássio sérico.
Se Lisinopril (substância ativa) é administrado com um diurético depletor de potássio a hipocalemia induzida pelo diurético pode ser amenizada.
Lítio
Assim como ocorre com outros fármacos que eliminam sódio, a eliminação de lítio pode ser diminuída. Portanto, os níveis séricos de lítio devem ser cuidadosamente monitorados se sais de lítio são administrados.
Ouro (por ex.: aurotiomalato de sódio)
Reações nitritoides (sintomas de vasodilatação incluindo rubor, náuseas, tontura e hipotensão que podem ser muito graves) foram relatadas com maior frequência em pacientes tratados com inibidores da ECA após aplicações de injeções de ouro (por exemplo, aurotiomalato de sódio).
Terapia concomitante
A indometacina pode diminuir a eficácia anti-hipertensiva de Lisinopril (substância ativa) quando administrados concomitantemente.
Em alguns pacientes com comprometimento da função renal, que estão sendo tratados com anti-inflamatórios não esteroidais, a coadministração de Lisinopril (substância ativa) pode resultar em uma deterioração adicional da função renal.
O Lisinopril (substância ativa) foi usado concomitantemente com nitratos sem evidências de interações adversas clinicamente significativas.
Ação da Substância
Hipertensão
Em dois estudos de dose-resposta, 438 pacientes portadores de hipertensão leve a moderada receberam Lisinopril (substância ativa) uma vez ao dia. A pressão foi verificada após 24 horas. Apesar de já haver resposta com 5mg/dia em alguns pacientes, a eficácia foi maior nas doses de 10, 20 e 80mg/dia.
Em estudos controlados, 20 a 80mg de Lisinopril (substância ativa) foram comparados com 12,5 a 50mg/dia de hidroclorotiazida e 50 a 200mg/dia de atenolol em pacientes com hipertensão leve a moderada e com metoprolol 100 a 200mg/dia em pacientes portadores de hipertensão, moderada a grave.
O Lisinopril (substância ativa) foi superior à hidroclorotiazida e semelhante ao atenolol e metoprolol na redução da pressão diastólica e foi superior às três medicações na redução da pressão sistólica.
Insuficiência Cardíaca Congestiva
O efeito de Lisinopril (substância ativa) na mortalidade e morbidade em insuficiência cardíaca congestiva foi estudado, comparando-se uma dose alta (32,5mg ou 35mg uma vez ao dia) com uma dose baixa (2,5mg ou 5mg uma vez ao dia).
Em um estudo realizado com 3164 pacientes, durante período médio de 46 meses de acompanhamento, a dose alta de Lisinopril (substância ativa) produziu, no tempo final combinado, uma redução de 12% do risco de mortalidade e hospitalização de todas as possíveis causas (p = 0,002), e uma redução de 8% do risco de mortalidade de todas as possíveis causas e de hospitalização cardiovascular (p = 0,036) em comparação com a dose baixa. Foram observadas reduções no risco de mortalidade de todas as causas (8%; p = 0,128) e de mortalidade cardiovascular (10%; p = 0,073).
Em uma análise post-hoc, o número de hospitalizações por insuficiência cardíaca foi reduzido em 24% (p = 0,002) em pacientes tratados com a dose alta de Lisinopril (substância ativa) em comparação com a dose baixa. Os benefícios sintomáticos foram similares em pacientes tratados com doses altas e baixas de Lisinopril (substância ativa).
Os resultados do estudo mostraram que os perfis globais de eventos adversos para pacientes tratados com dose alta ou baixa de Lisinopril (substância ativa) foram similares quanto à natureza e ao número.
Eventos previsíveis resultantes da inibição da ECA, tais como, hipotensão ou função renal alterada, foram controláveis e raramente levaram a descontinuação do tratamento. Tosse foi menos frequente em pacientes tratados com dose elevada de Lisinopril (substância ativa) em comparação com dose baixa.
Infarto Agudo do Miocárdio
No estudo GISSI-3, o qual foi usado um desenho fatorial 2 x 2 para comparar os efeitos de Lisinopril (substância ativa) e gliceril trinitrato usados sozinhos ou em combinação por 6 semanas comparados com controle em 19.394 pacientes nos quais foi administrado tratamento dentro de 24 horas após um infarto agudo do miocárdio, Lisinopril (substância ativa) produziu uma redução estatisticamente significativa do risco da mortalidade de 11% versus controle (2p = 0,03).
A redução do risco com uso de gliceril trinitrato não foi significativa, mas a combinação de Lisinopril (substância ativa) e gliceril trinitrato produziu uma significativa redução do risco de mortalidade de 17% versus controle (2p = 0,02).
Em um subgrupo de idosos (idade > 70 anos) e mulheres, pré-definidos como pacientes de alto risco de mortalidade, um benefício significativo foi observado para combinação dos desfechos de mortalidade e função cardíaca. A combinação dos desfechos para todos os pacientes, como também os subgrupos de alto risco, também demonstrou benefício significativo para os tratamentos com Lisinopril (substância ativa) aos 6 meses ou Lisinopril (substância ativa) mais gliceril trinitrato por 6 semanas, indicando os efeitos preventivos para Lisinopril (substância ativa).
Como esperado para qualquer tratamento com vasodilatadores, o aumento das incidências de hipotensão e disfunção renal estão associados ao tratamento com Lisinopril (substância ativa), mas não estão associados a um aumento proporcional da mortalidade.
Complicações Renais e Retinianas de Diabetes Mellitus
Pode-se prevenir praticamente todas as complicações do diabetes com os inibidores da ECA. Em pacientes portadores de diabetes do tipo I e microalbuminúria, que receberam Lisinopril (substância ativa) apresentaram um risco menor de progressão para macroalbuminúria e esse efeito se manteve quando ajustado para as variações na pressão arterial. Houve também a diminuição do risco para progressão em pacientes já com macroalbuminúria.
O tratamento com inibidores da ECA está associado a menores níveis de fator de crescimento endotelial vascular (VEGF) em pacientes portadores de retinopatia proliferativa diabética e estudos sugerem um forte potencial de uso dos inibidores da ECA no tratamento da retinopatia diabética.
Em um estudo clínico duplo-cego, randomizado, multicêntrico o qual comparou Lisinopril (substância ativa) com um bloqueador dos canais de cálcio em 335 pacientes hipertensos e com diabetes tipo 2 com nefropatia incipiente caracterizada pela microalbuminúria, Lisinopril (substância ativa) 10 a 20mg administrado uma vez ao dia por 12 semanas, reduziu a pressão sistólica/diastólica em 13/10mmHg e o valor de excreção urinária de albumina em 40%.
Quando comparado com bloqueadores dos canais de cálcio, os quais produzem uma redução similar da pressão sanguínea, todos os pacientes tratados com Lisinopril (substância ativa) mostraram uma redução significativamente maior nos níveis de excreção urinária de albumina, demonstrando que a ação inibitória da ECA de Lisinopril (substância ativa) reduziu a microalbuminúria por um mecanismo direto nos tecidos renais além do seu efeito hipotensor.
Características farmacológicas
Propriedades Farmacodinâmicas
O Lisinopril (substância ativa) é um inibidor da peptidil dipeptidase. Ele inibe a enzima conversora da angiotensina (ECA) que catalisa a conversão da angiotensina I ao peptídeo vasoconstritor, angiotensina II. A angiotensina II estimula também a secreção de aldosterona pelo córtex da adrenal.
A inibição da ECA resulta em concentrações diminuídas de angiotensina II, as quais resultam em diminuição da atividade vasopressora e redução da secreção de aldosterona. A diminuição tardia da aldosterona pode resultar em um aumento da concentração sérica de potássio.
Acredita-se que o mecanismo pelo qual o Lisinopril (substância ativa) diminui a pressão arterial é principalmente a supressão do sistema renina-angiotensina-aldosterona. Entretanto, o Lisinopril (substância ativa) é eficaz na redução da pressão arterial mesmo em pacientes hipertensos com baixa renina. A ECA é idêntica à cininase II, enzima que degrada a bradicinina. Ainda não está elucidado se níveis aumentados de bradicinina, um potente peptídeo vasodilatador, exercem papel importante sobre os efeitos terapêuticos do Lisinopril (substância ativa).
É sabido que a ECA está presente no endotélio e que a atividade aumentada da ECA em pacientes diabéticos, que resulta na formação de angiotensina II e destruição de bradicinina, potencializa os danos ao endotélio causados por hiperglicemia. Os inibidores da ECA, incluindo Lisinopril (substância ativa), inibem a formação de angiotensina II e a degradação da bradicinina, melhorando consequentemente a disfunção endotelial.
Os efeitos de Lisinopril (substância ativa) na taxa de excreção urinária de albumina e na progressão de retinopatia em pacientes diabéticos são mediados pela redução na pressão sanguínea, bem como pelo mecanismo direto nos tecidos retinal e renal.
Propriedades Farmacocinéticas
Absorção
Após administração oral de Lisinopril (substância ativa), o pico de concentração sérica ocorre em cerca de 7 horas, apesar de haver uma tendência a um pequeno retardo no tempo para alcançar o pico de concentração sérica em pacientes com infarto agudo do miocárdio.
Baseado na recuperação urinária, a extensão média de absorção de Lisinopril (substância ativa) é de aproximadamente 25%, com variações entre os pacientes (6-60%) em todas as doses testadas (5-80mg). A biodisponibilidade absoluta é reduzida em aproximadamente 16% em pacientes com insuficiência cardíaca. A absorção de Lisinopril (substância ativa) não é afetada pela presença de alimentos.
Distribuição
O Lisinopril (substância ativa) parece não ligar-se às outras proteínas séricas, diferentemente da enzima conversora de angiotensina circulante (ECA). Estudos em ratos indicam que o Lisinopril (substância ativa) pouco atravessa a barreira hematoencefálica.
Eliminação
O Lisinopril (substância ativa) não é metabolizado e o fármaco absorvido é inteiramente excretado inalterado na urina. Em doses múltiplas, o Lisinopril (substância ativa) possui uma meia-vida efetiva de acúmulo de 12,6 horas. A depuração plasmática de Lisinopril (substância ativa) em pacientes sadios é de aproximadamente 50mL/min. O declínio das concentrações séricas exibe uma fase terminal prolongada que não contribui para o acúmulo do fármaco.
Essa fase terminal provavelmente representa ligações saturadas à ECA e não é proporcional à dose.
Insuficiência hepática
O comprometimento da função hepática em pacientes com cirrose resultou na diminuição da absorção de Lisinopril (substância ativa) (cerca de 30% determinado pela recuperação urinária) e um aumento na exposição (aproximadamente 50%) comparada a voluntários sadios devido à diminuição da depuração plasmática.
Insuficiência renal
O comprometimento da função renal diminui a eliminação de Lisinopril (substância ativa), que é excretado via renal, mas essa diminuição torna-se clinicamente importante somente quando a velocidade de filtração glomerular é menor que 30mL/min.
Tabela 1: Parâmetros farmacocinéticos de Lisinopril (substância ativa) para diferentes grupos de pacientes renais após administração de múltiplas doses de 5mg.
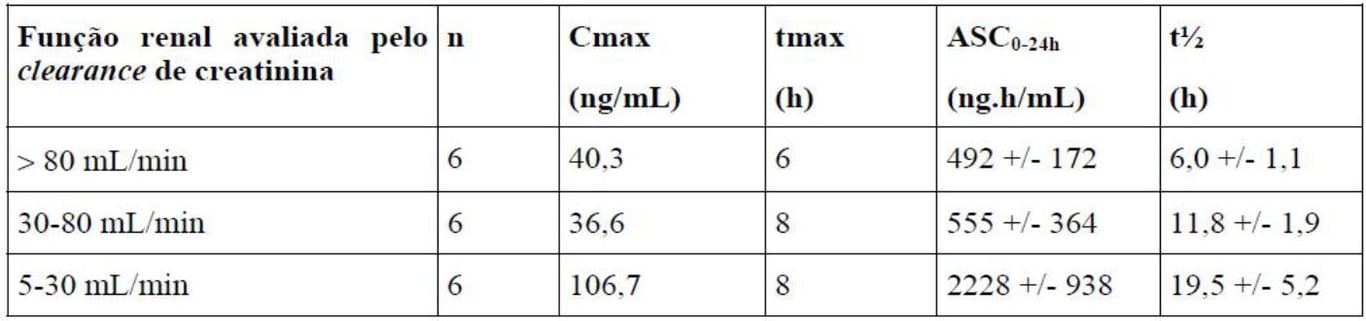
Com um clearance de creatinina de 30-80mL/min, o valor da ASC média aumentou apenas 13%, enquanto que o valor médio da ASC aumentou 4-5 vezes com o clearance de creatinina de 5-30mL/min.
O Lisinopril (substância ativa) pode ser removido por diálise. Durante 4 horas de hemodiálise, a concentração plasmática média de Lisinopril (substância ativa) diminuiu em 60%, com uma depuração da diálise entre 40 e 55 mL/min.
Insuficiência cardíaca
Pacientes com insuficiência cardíaca têm uma maior exposição de Lisinopril (substância ativa) comparado com voluntários sadios (um aumento da média ASC de 125%), mas baseado na recuperação urinária de Lisinopril (substância ativa), há uma redução da absorção de aproximadamente 16% comparada com voluntários sadios.
Idosos
Pacientes idosos apresentam níveis sanguíneos mais elevados e valores da ASC mais elevados (aumento de aproximadamente 60%) em comparação com pacientes mais jovens.
Cuidados de Armazenamento
Você deve conservar Zestril em temperatura ambiente (15ºC a 30°C).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido.
Guarde-o em sua embalagem original.
Todo medicamento deve ser mantido fora do alcance das crianças.
Características organolépticas
Zestril 5 mg e 10 mg
São apresentados como comprimidos redondos, sulcados e de cor rosa.
Zestril 20 mg
É apresentado como comprimidos redondos e de cor rosa.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais
Farm. Resp.:
Dra. Gisele H. V. C. Teixeira
CRF-SP nº 19.825.
Fabricado por
AstraZeneca do Brasil Ltda
Rod. Raposo Tavares, km 26,9
Cotia - SP - CEP 06707-000
CNPJ 60.318.797/0001-00
Indústria Brasileira.
Venda sob prescrição médica.