Comparamos o preço de Alfainterferona 2B 5 Mui Milhões Recombinante, veja o menor preço

BBiológicos
Para que serve
Este medicamento é destinado ao tratamento de Hepatites B e C crônicas, infecções pelo papilomavírus humano (papilomatose respiratória recorrente e condiloma acuminado), aids, neoplasias do tecido hematopoiético (leucemia mielóide crônica, tricoleucemia), tumores sólidos (sarcoma de Kaposi, melanoma maligno, carcinoma renal).
Contraindicação
O produto é contra-indicado para pacientes com reconhecida hipersensibilidade a quaisquer componentes da formulação. Pacientes com alterações no sistema nervoso, como distúrbios epilépticos, desordens psiquiátricas graves, doenças cardíacas graves, doenças autoimunes, alterações do estado imunológico e da coagulação sanguínea, doenças renais e hepáticas graves, alterações da função da tireóide, diabetes não controlada e doenças pulmonares, devem ter estrita avaliação médica do risco-benefício que o tratamento pode trazer.
Gravidez e lactação
Não está estabelecido o emprego seguro da Alfainterferona (substância ativa) 2b durante a gravidez e a lactação e o médico deve fazer uma análise de risco versus benefício em cada caso antes de usá-lo.
Informe seu médico a ocorrência de gravidez ou lactação na vigência do tratamento.
Como usar
O conteúdo do frasco-ampola deve ser reconstituído com 1 mL de água para injeção estéril e apirogênica, adicionando-se suavemente para evitar a formação de espuma. Deve ser facilmente reconstituído e não conter sólidos em suspensão nem turvação.
Uma vez que o conteúdo do frasco-ampola esteja reconstituído, o produto está pronto para uso. Para assegurar o máximo de atividade, deve ser administrado imediatamente depois de reconstituído. O produto não deve ser usado se após a reconstituição ocorrer formação de precipitado, turvação ou coloração.
A concentração do biofármaco reconstituído pode ser de 3.000.000 UI, 5.000.000 UI ou 10.000.000 UI.
Em adultos a dose é de 3.000.000 a 6.000.000 UI. Em algumas situações particulares de pacientes com câncer podem usar-se doses maiores, levando-se em consideração que os efeitos secundários serão também mais intensos. Em crianças a dose usual é de 3.000.000 a 6.000.000 UI / m2 de superfície corporal.
A freqüência de administração varia entre uma vez por dia e, uma, duas ou três vezes por semana. As duas últimas opções são as mais usadas em esquemas prolongados de tratamento.
A via de administração é intramuscular ou subcutânea.
As vias intravenosa, intratecal e intraperitoneal pressupõem a administração por profissional de saúde treinado.
Alguns dos esquemas de tratamento úteis são os seguintes:
Papilomatose Respiratória Recorrente
|
Período | Crianças (UI/Kg peso corporal) |
Adultos (UI) |
|
1° mês | 100.000 3x/semana |
6.000.000 3x/semana |
|
2° mês | 75.000 3x/semana |
3.000.000 3x/semana |
|
3° mês | 50.000 3x/semana |
3.000.000 3x/semana |
|
4° mês | 50.000 2x/semana |
3.000.000 3x/semana |
|
5° ao 12° mês | 50.000 1x/semana |
3.000.000 2x/semana |
|
Após 1 ano | 50.000/mês |
6.000.000/ mês |
Se ocorrer alguma recaída, deve-se regressar ao nível de dose ou freqüência imediatamente superior.
Condiloma Acuminado
6.000.000 UI 3 vezes por semana por via intramuscular durante 6 semanas.
Hepatite B Crônica
Em adultos:
6.000.000 UI Diárias por via intramuscular durante 2 semanas; depois 3 vezes por semana durante 4 semanas e 2 vezes por semana durante 16 semanas, num total de 22 semanas.
Em crianças:
3.000.000 a 6.000.000 UI/m² por via intramuscular 3 vezes por semana durante 16 semanas. Se a criança tiver mais de 12 anos, a dose deve ser de 6.000.000 UI.
Hepatite C Crônica
3.000.000 UI por via intramuscular ou subcutânea, 3 vezes por semana, durante 24 a 48 semanas. A eficácia do tratamento aumenta quando o interferon é combinado, sempre que seja possível, com ribavirina 1000-1250 mg/dia, em 2 tomadas, durante o mesmo período de tempo.
Infecção pelo Vírus da Imunodeficiência Humana
Durante o período assintomático, deve-se utilizar 3.000.000 UI, 3 vezes por semana. Este tratamento deve continuar durante um tempo prolongado, com controle hematológico e monitoramento do possível desenvolvimento de anticorpos anti-alfainterferona 2b.
Em pacientes com Sarcoma de Kaposi recomenda-se a dose de 30.000.000 UI/m² por dia até a obtenção da resposta total, ou durante 12 a 24 meses, dependendo da tolerância. Entretanto, nos casos em que o diagnóstico foi feito precocemente, Interferon alfa induziu remissões totais com uma dose de 6.000.000 UI /dia durante 6 semanas.
Leucemia Mielóide Crônica
Uma vez que se obtenha a remissão hematológica, pode-se administrar Alfainterferona (substância ativa) 2b em dias alternados.
A dose recomendada é de 3.000.000 UI/m² por dia. O tratamento deverá ser interrompido se houver progressão da doença.
Melanoma Maligno
Como adjuvante à cirurgia em pacientes sem lesões residuais, mas em risco de desenvolver recorrências, deve-se empregar Alfainterferona (substância ativa) 2b 20.000.000 UI, 5 vezes por semana, por via intravenosa ou intramuscular, durante 4 semanas. Posteriormente, 10.000.000 UI, 3 vezes por semana, por via subcutânea ou intramuscular, até um ano de tratamento
Tricoleucemia
Recomenda-se a administração de Alfainterferona (substância ativa) 2b 2.000.000 UI/ m² de superfície corporal 3x/semana durante 6 meses.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar observe o aspecto do medicamento.
Precauções
A monitorização hematológica (hemograma e plaquetas), das transaminases hepáticas, da creatinina e TSH poderá ser realizada a critério médico.
A Alfainterferona (substância ativa) 2b deve ser administrada com precaução em pacientes com antecedentes de doença cardíaca grave, alterações renais ou hepáticas graves, convulsões ou outra alteração funcional do sistema nervoso central e doenças autoimunes ou alérgicas.
Embora não se tenha demonstrado nenhum efeito cardiotóxico direto, é possível que algum dos efeitos secundários (por exemplo, febre, calafrios, mal-estar geral), freqüentemente associados com a administração de Alfainterferona (substância ativa) 2b, exacerbem uma alteração cardíaca anterior.
Devido a que um dos efeitos tóxicos associados com o uso de Alfainterferona (substância ativa) 2b pode ser a leucopenia, deve-se ser muito cuidadoso ao administrá-lo a pacientes com mielossupressão.
Como o rim é o sítio onde a Alfainterferona (substância ativa) 2b é excretado, deve-se ter cuidado ao usar Alfainterferona (substância ativa) 2b em pacientes com função renal comprometida, devendo-se considerar a possibilidade de redução de dose se necessário.
O uso de diferentes preparações de Alfainterferona (substância ativa) 2b tem sido associado a um aumento de manifestações alérgicas ou autoimunes como broncoconstrição, lúpus eritematoso, psoríase, dermatite atópica ou tiroidite. Embora estes fenômenos tenham ocorrido com muito baixa freqüência com o uso de Alfainterferona (substância ativa) 2b, deve-se ser cuidadoso.
As reações adversas produzidas por Alfainterferona (substância ativa) 2b são reversíveis. No caso de ocorrerem, deve-se reduzir a dose ou interromper o tratamento, conforme cada caso, e tomar-se as medidas apropriadas de acordo com a situação do paciente. Embora a experiência geral seja de que os efeitos colaterais diminuam à medida que a terapêutica com Alfainterferona (substância ativa) 2b prossiga, sua continuação ou reinício nestes casos deve ser monitorada cuidadosamente.
Gravidez e lactação
Não está estabelecido o emprego seguro da Alfainterferona (substância ativa) 2b durante a gravidez e a lactação e o médico deve fazer uma análise de risco versus benefício em cada caso antes de usá-lo.
Uso em idosos, crianças e outros grupos de risco
Não há estudos clínicos realizados especificamente em idosos. Entretanto, o produto tem sido usado neste grupo etário com igual perfil de segurança que em outras idades nas mesmas indicações,
particularmente as neoplasias.
A Alfainterferona (substância ativa) 2b tem sido usada em crianças com hepatite viral dos tipos B e C, papilomatose laríngea e respiratória recorrente e em neoplasias malignas. Os efeitos secundários foram semelhantes aos encontrados em adultos, fundamentalmente febre e mal-estar geral. Não foram relatados transtornos do crescimento ou do desenvolvimento psicossomático, mesmo após vários meses de tratamento contínuo.
Carcinogenese, Teratogenese e Mutagenese
Não há evidência, nem experimental nem da literatura, que sugira algum potencial carcinogênico. Nenhuma das provas realizadas demonstrou ou sugeriu que a Alfainterferona (substância ativa) 2b possa ser mutagênica ou causar dano cromossômico. As provas realizadas em camundongos não demonstraram nenhum efeito teratogênico ou sobre a fertilidade.
Reações Adversas
As reações adversas são dependentes da dose e reversíveis. Sua intensidade é geralmente leve (não requer tratamento) ou moderada (responde ao tratamento sintomático). Os pacientes que recebem doses de 6.000.000 UI de Alfainterferona (substância ativa) 2b podem ter reações adversas graves que requerem medidas adicionais, hospitalização, prolongamento da hospitalização, ou suspensão do tratamento.
As reações muito comuns (>1/10) foram:
Fadiga, cefaléia, mialgia, artralgias (dor nas articulações), dor nas pernas, dor nas costas, febre, calafrios, anorexia, pele seca, alopécia, secura nos olhos, diarréia, prurido, ressecamento nasal, disgeusia (distorção ou diminuição do senso do paladar), ageusia (ausência de paladar), sonolência, secura na boca, enjôo, náuseas vômitos, dor abdominal, diarréia, tosse, tontura, sonolência, irritabilidade, perda da memória, ansiedade, insônia, depressão, alteração da visão). As reações comuns (> 1/100 e < 1/10) foram: fraqueza, dispnéia, mal estar geral, astenia, fraqueza muscular, síncope, constipação, aftas, dispepsia, flatulência, perda da motivação, sede, aumento do apetite, dor de garganta, dor de ouvido, epistaxe transpiração excessiva, alergia, diminuição da libido, irritação ocular, choro anormal, dispepsia, dor óssea, cistite, atenção diminuída confusão mental, dormência, instabilidade emocional, enxaqueca, formigamento, tremor, melancolia, aumento da pressão arterial, distúrbios da bexiga, dor no peito, dor nos mamilos, eritema, dermatite instabilidade emocional, micose, pesadelos, taquicardia.
As reações incomuns (> 1/1.000 e < 1/100) foram:
Abscesso, agitação, alterações no olfato, alucinações, amputação, ascite, asma, atraso mestrual, candidíase, coriza, dificuldade para conversar, dor ocular, dor testicular, eczema, edema, erupção cutânea, fotofobia, aumento da freqüência urinária, gastroenterite, hemorragia vaginal, hemorróidas, herpes simples, hipoglicemia, hiponatremia, hipotensão, hipotermia, impotência, intolerância a lactose, labirintite, laringite, neuropatia, petéquias, pneumonia, rubor súbito de pele, sangramento na gengiva, sangue na urina, sangue nas fezes, sinusite, vaginite, rompimento de varizes esofágicas, zunido nos ouvidos. Também foram relatados casos muito raros (< 1/10.000)) de reações alérgicas leves (exantema, prurido), e toxicidade cardiovascular.
Tabela 3. Freqüência das principais reações adversas após o uso de Alfainterferona (substância ativa) 2b

Fonte: Estudo de vigilância ativa de ventos adversos associados a Alfainterferona (substância ativa) 2b produzida por Bio- Manguinhos /Fiocruz em pacientes com Hepatite Viral crônica tratados em serviço da SES /RS.
Por outro lado, relatou-se a farmacovigilância do uso de Alfainterferona (substância ativa) 2b em pacientes com doenças hematológicas, fundamentalmente leucemia mielóide crônica, com um padrão de reações adversas semelhante ao anterior. Nestes grupos relatou-se também um caso de anemia hemolítica aparentemente posterior ao desenvolvimento de auto-anticorpos antieritrocitários.
Um estudo de vigilância ativa da Alfainterferona (substância ativa) 2b produzida por Bio-Manguinhos realizado no Brasil envolvendo 141 pacientes portadores de hepatite C crônica revelou ao Setor de Farmacovigilância reações adversas no local de aplicação relacionadas a seguir (Tabela 5).
Tabela 4. Freqüência das principais reações adversas no local de aplicação após o uso de Alfainterferona (substância ativa) 2b em um total de 7658 aplicações
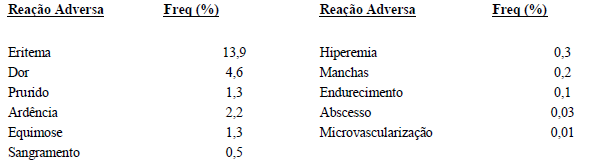
Fonte: Outros estudos com Alfainterferona (substância ativa) 2b de outros fabricantes evidenciaram reações adversas no local de aplicação como ardência, dor, edema, eritema, hematoma, inflamação e sangramento [15], ulceração [16], e necrose cutânea [17].
As reações adversas produzidas por Alfainterferona (substância ativa) 2b são reversíveis. No caso de ocorrerem, deve-se reduzir a dose pela metade ou interromper o tratamento, conforme cada caso, e tomar-se as medidas apropriadas de acordo com a situação do paciente. Embora a experiência geral seja de que os efeitos colaterais diminuem à medida que a terapêutica com Alfainterferona (substância ativa) 2b prossiga, sua continuação ou reinício nestes casos deve ser monitorada cuidadosamente.
Imunogenicidade da Alfainterferona (substância ativa) 2b
As preparações de Alfainterferona (substância ativa) 2b podem ser imunogênicas em uma proporção variável de pacientes tratados com elas. Os anticorpos gerados podem neutralizar a atividade do interferon e, portanto, impedir ou reverter a resposta ao tratamento. A imunogenicidade da Alfainterferona (substância ativa) 2b tem sido monitorada nos diferentes ensaios clínicos feitos com este produto. De um total de 563 pacientes tratados com Alfainterferona (substância ativa) 2b cujos soros foram avaliados, 14 (2,5%) tiveram atividade neutralizante anti-Alfainterferona (substância ativa) 2b.
Em resumo, os estudos realizados e o monitoramento das reações adversas aos tratamentos com Alfainterferona (substância ativa) 2b mostram resultados semelhantes quanto ao tipo, apresentação e intensidade, aos relatados para outras preparações que contêm como princípio ativo a Alfainterferona (substância ativa) 2b.
Em caso de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, disponível em www.anvisa.gov.br, ou para a Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
A interação do IFN alfa-2b recombinante (CIGB) com outros fármacos não foi ainda completamente avaliada.
Recomenda-se cautela na administração concomitante com outros medicamentos.
Pode-se usar o paracetamol durante o tratamento com a Alfainterferona (substância ativa) 2b, pois além de combater os sintomas de febre e cefaléia, o seu mecanismo de ação não afeta os mecanismos específicos da Alfainterferona (substância ativa) 2b. Recomenda-se a administração de paracetamol, como terapia concomitante, em doses de 500mg a 1g, 30 minutos antes da aplicação da Alfainterferona (substância ativa) 2b. A dose máxima de paracetamol é de 1g, 4 vezes ao dia.
A Alfainterferona (substância ativa) 2b tem ação sinérgica com algumas drogas antitumorais quanto ao efeito antiproliferativo, o que se deve ter em conta ao aplicar a combinação no tratamento de algumas neoplasias, pois pode potencializar o efeito mielossupressor de ambos os medicamentos. Também tem ação sinérgica, tanto no efeito antiviral como no antiproliferativo, com o interferon gama.
Ação da Substância
Resultados de Eficácia
Papilomatose Respiratória Recorrente (PRR)
O uso da Alfainterferona (substância ativa) 2b pode induzir remissão parcial ou completa dos papilomas e também prevenir recaídas após remoção cirúrgica dos tumores. O primeiro relato revelou que a enfermidade pôde ser controlada em 90% de 125 pacientes. Desde 1994 o estudo continuou com pacientes com lesões papilomatosas em todo o trato respiratório e tratamento com Alfainterferona (substância ativa) 2b. Foram incluídos pacientes com diagnóstico clínico e histológico de PRR. A Alfainterferona (substância ativa) 2b foi administrada por via intramuscular, depois da remoção cirúrgica dos papilomas, na dose de 100.000 UI/Kg 3 vezes por semana diminuindo-se gradativamente até 50.000 UI/Kg de peso, 1 vez por semana em crianças.
Em adultos a dose inicial foi de 6 x 106 UI/Kg, 3 vezes por semana, diminuindo-se gradativamente até 1 vez por mês. Doses mais altas foram utilizadas em alguns casos. Na ocorrência de recaída durante o tratamento retomava-se o nível imediatamente superior do esquema. Em pacientes com recaídas graves a dose poderia ser incrementada para até 150 000 UI/Kg ou 200 000 UI/Kg, 3 vezes por semana durante um mês em crianças. Em adultos este incremento poderia chegar até a 12 x 106 UI.
A avaliação da eficácia considerou: resposta satisfatória (RS) - sem recaídas durante todo o período de observação; resposta parcialmente satisfatória (RP) - menor freqüência de recaídas do que antes do tratamento e não resposta (NR) - recaídas com freqüência igual ou maior do que antes do tratamento.
Informe de dezembro de 1999 incluiu 83 crianças e 77 adultos. Os adultos responderam melhor. A enfermidade foi particularmente agressiva em crianças menores de 3 anos. A freqüência total de recaídas reduziu-se significativamente tanto em crianças como em adultos (tabela1).
Tabela 1. Número (%) de pacientes com Papilomatose Respiratória Recorrente em cada categoria de avaliação depois do tratamento com Alfainterferona (substância ativa) 2b.
Tabela 2. Média anual de recaídas ± DP em pacientes com Papilomatose Respiratória Recorrente tratada com Alfainterferona (substância ativa) 2b.
Fonte: Condiloma acuminado.
Demonstrou-se a eficácia da Alfainterferona (substância ativa) 2b em condilomas acuminados em um ensaio controlado, duplo cego. Quarenta pacientes (ambos os sexos) com diagnóstico clínico e histológico foram incluídos e randomizados em dois grupos: Alfainterferona (substância ativa) 2b ou placebo. O tratamento consistiu em 6 x 106 UI de Alfainterferona (substância ativa) 2b por via intramuscular, três vezes por semana, combinado com a aplicação tópica de creme hidrófilo contendo 20 000 UI/g de Alfainterferona (substância ativa) 2b três vezes ao dia durante 6 semanas. O grupo controle recebeu 2 mL dos excipientes de Alfainterferona (substância ativa) 2b por via intramuscular e creme hidrófilo inerte topicamente, segundo o mesmo esquema.
A taxa de resposta foi de 80% entre os pacientes tratados com Alfainterferona (substância ativa) 2b, incluindo melhora histológica, enquanto que somente 20% dos controles respondeu favoravelmente (p = 0,0018). Não houve reações adversas locais. Houve febre e calafrios em 70% dos pacientes que receberam Alfainterferona (substância ativa) 2b.
Estes resultados mostraram que pacientes com condiloma acuminado respondem favoravelmente ao tratamento com Alfainterferona (substância ativa) 2b, combinando as vias de administração tópica e parenteral.
Hepatite B crônica
Na hepatite B crônica com antígeno “e” positivo, pôde-se obter 50% de soroconversão (de HBe Ag positivo para anti-HBe positivo) depois de um esquema de 4 meses com Alfainterferona (substância ativa) 2b. O tratamento foi particularmente benéfico em pacientes imunossuprimidos. Relatou-se o resultado em 22 pacientes, em um estudo não controlado.
Realizou-se um estudo prospectivo, aberto, não controlado, unicêntrico. Incluiu-se um total de 30 pacientes (75% homens; 17 a 60 anos de idade, média: 35,5 anos) com hepatite crônica documentada histologicamente, alanina aminotransferase (ALT) sérica maior que 1,5 vezes em relação ao valor normal e HBsAg positivo no soro. O tratamento consistiu em Alfainterferona (substância ativa) 2b 5 x 106 UI, subcutâneo, em dias alternados, durante um período de 4 meses. Depois do esquema de tratamento, a ALT sérica normalizou em 18 pacientes (60%), diminuiu em 7 (23,3%) e não mudou em 5 (16,7%). Uma segunda biópsia hepática mostrou diminuição da inflamação hepática em 53,5% dos pacientes, não mudou em 36,7% e aumentou em 10% dos pacientes.
Houve uma forte correlação entre a normalização da ALT sérica e a melhoria histológica. HBsAg negativou em 5 pacientes (16,6%). Dez pacientes tinham HBeAg positivo antes do tratamento, que negativou em 4 (40%). A maioria dos pacientes experimentou reações adversas, mas em nenhum caso estas foram motivo de suspensão do tratamento. Não houve eventos adversos graves ou inesperados. Observou-se trombocitopenia em 2 pacientes.
A Alfainterferona (substância ativa) 2b também tem sido utilizada em crianças. Realizou-se um estudo com um seguimento em longo prazo de um grupo de 22 crianças (17 meninos e 5 meninas; 3 a 15 anos de idade) com hepatite crônica ativa (HCA) por vírus B. Os critérios diagnósticos incluíram aumento de ALT durante 6 meses, marcadores virais positivos (HBeAg, HBsAg), laparoscopia e biópsia hepática. As crianças menores de 12 anos de idade receberam 3 x 106 UI de IFN alfa-2b recombinante (CIGB) enquanto os de 12 anos ou mais receberam 6 x 106 UI por via intramuscular, três vezes por semana durante 4 meses. Realizou-se uma análise de variância para avaliar a resposta da ALT após a administração de Alfainterferona (substância ativa) 2b e usou-se o teste de McNemar para analisar o comportamento do sistema HbeAg / anti-HBe. Dezessete dos 22 pacientes (77%) responderam ao tratamento (negativação de HBeAg e normalização do nível de ALT). A soroconversão de HBeAg positivo para anti–Hbe positivo ocorreu em 36% dos pacientes durante o primeiro ano (p = 0,01) e aumentou para 50% no terceiro ano de seguimento. Os níveis de ALT também diminuíram e a diferença foi estatisticamente significativa (p < 0,01). Os eventos adversos foram poucos, transitórios e toleráveis e somente apareceram durante a fase inicial do tratamento; os sintomas foram principalmente de tipo gripal.
Em outro estudo de fase IV, mais recente, trataram-se 34 crianças com hepatite B crônica demonstrada histologicamente (25 meninos, idade média 7,4 anos, 12 com antecedentes de transfusões de sangue) com Alfainterferona (substância ativa) 2b, 3 – 5 x 106 UI/m2, por via intramuscular, 3 vezes por semana, durante 4 meses, e que foram seguidas durante 1 ano após o tratamento. A ALT sérica foi medida ao final do tratamento e a cada 4 meses durante o seguimento.
Ao final do seguimento realizou-se uma segunda biópsia hepática. As biópsias foram comparadas de maneira “cega” segundo o índice de Knodell [6]. Ao final do tratamento 13 pacientes (38,2%) tiveram resposta enzimática completa (normalização de ALT). Ao final do seguimento a taxa de resposta alcançou 50%.
Encontrou-se melhoria histológica em 20/29 pacientes nos quais se realizou a segunda biópsia (69%). Os eventos adversos foram febre (96%), calafrios e anorexia (37%), cefaléia (36%), vômitos (29%), mialgias (27%), artralgias (13%). Nenhum paciente teve leucopenia ou trombocitopenia. Três pacientes tiveram anemia leve.
Hepatite C crônica
Em estudo controlado, randomizado, foram incluídos 16 pacientes no grupo controle (sem tratamento) e 19 no grupo Alfainterferona (substância ativa) 2b, com as mesmas doses e esquemas anteriores. Aqueles pacientes que mantiveram ALT anormal ao final das 13 semanas de tratamento receberam dose dobrada de Alfainterferona (substância ativa) 2b até a semana 39. Houve 74% de resposta no grupo tratado com Alfainterferona (substância ativa) 2b e 33% nos controles (p = 0,06).
57% dos respondedores no grupo Alfainterferona (substância ativa) 2b e nenhum dos controles tiveram resposta sustentada ao final do seguimento. Realizou-se uma segunda biópsia em 10 pacientes do grupo Alfainterferona (substância ativa) 2b: 9 tiveram melhoria no índice de Knodell e houve piora em um caso. Os eventos adversos principais foram febre e cefaléia (33%) e mialgias (29%). Um paciente teve trombocitopenia, da qual se recuperou depois da suspensão da administração de Alfainterferona (substância ativa) 2b. Nenhum paciente desenvolveu anticorpos antiAlfainterferona (substância ativa) 2b.
Ao final, alcançou-se 80% de resposta enzimática (normalização de ALT) com monoterapia com Alfainterferona (substância ativa) 2b em hepatite crônica C vs. 22% no grupo controle. Em 41% dos casos estas respostas foram sustentadas depois de 9 meses de seguimento. Estes primeiros estudos, realizados nos primeiros anos da década de 1990, têm a limitação de que não tiveram avaliação virológica mediante a determinação do RNA viral no sangue. Não se contava com essa prova nesta época. É de se esperar que a taxa de resposta virológica seja inferior à resposta bioquímica encontrada. A boa resposta histológica em 68% (13/19) dos pacientes tratados com Alfainterferona (substância ativa) 2b demonstra efeito antifibrose e sugere eficácia antiviral.
A Alfainterferona (substância ativa) 2b deve ser usada em combinação com ribavirina para o tratamento da hepatite C crônica.
Realizou-se um estudo randomizado, duplo cego, em 47 pacientes com diagnóstico histológico e sorológico.
Os pacientes tinham pelo menos 1,5 vezes o valor normal de atividade de ALT, eram positivos para RNAVHC e negativos para as infecções por hepatite B e HIV no soro. A avaliação foi feita logo depois do final do tratamento e 6 meses após o término. Ao final do tratamento 80% dos pacientes no grupo ribavirina + Alfainterferona (substância ativa) 2b tiveram ALT normal vs. 55% no grupo Alfainterferona (substância ativa) 2b + placebo (p = 0,05). Esta diferença persistiu depois dos 6 meses de seguimento. Neste momento 65% (17/26) dos pacientes no grupo ribavirina + Alfainterferona (substância ativa) 2b tiveram o RNA-HCV negativo. A resposta virológica foi de 33% (7/21) no grupo Alfainterferona (substância ativa) 2b + placebo (p = 0,028). A melhora histológica, medida pelo índice de Knodell (excluindo a fibrose) foi 73% no grupo Alfainterferona (substância ativa) 2b + ribavirina vs. 52% no grupo de monoterapia com Alfainterferona (substância ativa) 2b (p = 0,046). A proporção de pacientes com resposta completa (bioquímica, histológica e virológica) foi o dobro com o tratamento combinado (46,1% vs. 23,8%). Este estudo demonstrou a eficácia da combinação da Alfainterferona (substância ativa) 2b com ribavirina. Ademais, os resultados obtidos com o grupo controle de monoterapia com Alfainterferona (substância ativa) 2b também apontam para a eficácia deste produto, já que as taxas de resposta são comparáveis às de outros estudos.
Há dois estudos em curso nos quais se utiliza Alfainterferona (substância ativa) 2b em combinação com ribavirina em pacientes com hepatite C crônica, dos quais há resultados parciais. Em um deles, desenvolvido no Instituto de Pósgraduação “Shaikh Zaid”, Lahore, Paquistão, de 26 pacientes avaliados, todos positivos ao RNA-HCV antes do tratamento, obteve-se resposta ao final do tratamento em 18 (69%), esta chega a 84% nos 19 pacientes portadores do genótipo 3.
O outro estudo em curso é de fase IV, multicêntrico, em vários hospitais cubanos. Até o mês de abril de 2004, iniciaram o tratamento com Alfainterferona (substância ativa) 2b e ribavirina 245 pacientes positivos ao RNA-HCV por PCR no soro, níveis de ALT pelo menos o dobro do valor normal e com dano histológico avaliado segundo o índice de Knodell. Ao terminar 12 meses de tratamento com Alfainterferona (substância ativa) 2b, 3 x 106 UI 3 vezes por semana, 42 pacientes de 77 (55%) tiveram negativação do RNA viral. De 45 que concluíram, 20 persistem negativos, 6 meses após o tratamento, com 44% de resposta virológica sustentada. A resposta bioquímica (normalização de ALT) foi de 82% depois do tratamento e 61% de resposta sustentada. Na avaliação histológica ao final do seguimento, incluíram-se 11 de 23 avaliados. Houve 48% de melhora, 26% não alteraram e outros 26% pioraram.
Infecção pelo Vírus da Imunodeficiência Humana
A Alfainterferona (substância ativa) 2b tem efeito anti-retroviral e tem sido considerado como um fator limitante da infecção pelo vírus da imunodeficiência humana (HIV). Realizou-se um ensaio randomizado com o propósito de prevenir ou retardar a progressão para a Síndrome de Imunodeficiência Adquirida (AIDS) em indivíduos nas fases iniciais da infecção por HIV, anti-HIV soropositivas, confirmados por Western blot, assintomáticos ou com linfadenopatias generalizadas. A administração de Alfainterferona (substância ativa) 2b, 3 x 106 UI, por via intramuscular, 3 vezes por semana (n=71) comparou-se com não-tratamento (N= 79). O ensaio durou de outubro de 1987 a fevereiro de 1992. Nesta época ainda não estavam disponíveis em Cuba os fármacos anti-retrovirais. O tratamento prolongado com Alfainterferona (substância ativa) 2b reduziu significativamente a proporção de indivíduos que desenvolveram qualquer sintoma (controle 58%; Alfainterferona (substância ativa) 2b 19%; p < 0,001) ou desenvolveram AIDS (controle 34 %; Alfainterferona (substância ativa) 2b 16 %; p < 0,05). O IFN alfa-2b recombinante (CIGB) também retardou a progressão a AIDS, de 67 - 83 meses desde a infecção no grupo controle a 116 – 180 meses nos tratados (IC - 95% do tempo até a progressão). Os indivíduos do grupo Alfainterferona (substância ativa) 2b tiveram significativamente menos infecções oportunistas assim como complicações não infecciosas relacionadas com a AIDS [10]. O seguimento posterior de até 10 anos dos mesmos pacientes permitiu a análise de sobrevida que foi mais prolongada no grupo que recebeu Alfainterferona (substância ativa) 2b (127 – 152 meses desde a infecção no grupo tratado vs. 101 – 120 no grupo controle. O grupo tratado com Alfainterferona (substância ativa) 2b teve uma taxa de sobrevida maior (61 – 77% vs. 24 – 54%, 10 anos desde a infecção e 53 – 69% vs. 34 – 52% aos 7 anos de seguimento). No entanto, as curvas de sobrevida não foram diferentes ao compará-las a partir do momento em que os pacientes desenvolveram AIDS e começaram a receber fármacos antivirais. Em conclusão, a administração de IFN alfa- 2b recombinante (CIGB) é útil e prolonga a sobrevida durante os estágios iniciais da infecção por HIV, porém não após o desenvolvimento da AIDS.
Leucemia mielóide crônica (LMC)
Foi realizado um primeiro estudo com 8 pacientes. Depois de alcançar a remissão hematológica com bussulfan os pacientes receberam Alfainterferona (substância ativa) 2b em dias alternados na dose de 10 x 106 UI durante 10 semanas, depois 8 x 106 UI durante 10 semanas, 6 x 106 UI durante 10 semanas e esta mesma dose de 6 x 106 UI durante 30 semanas. Em cada ciclo a Alfainterferona (substância ativa) 2b foi administrada diariamente nas semanas 5 e 10.
Em todos os casos se manteve a remissão hematológica durante o tratamento com Alfainterferona (substância ativa) 2b. Os períodos de seguimento variaram de 18 a 42 semanas. Em 8 pacientes conseguiu-se redução da proporção de células Ph + em até 30 - 88%, que nunca se observou com quimioterapia. Da mesma forma obtiveram-se reduções significativas de transcobalamina, LDH e muramidase, marcadores de massa celular.
Em um ensaio clínico randomizado e aberto compararam-se os tratamentos de manutenção, depois da remissão hematológica com bussulfan, usando Alfainterferona (substância ativa) 2b leucocitário (20 pacientes), Alfainterferona (substância ativa) 2b (10 pacientes), um grupo sem tratamento de manutenção (11 pacientes) e um grupo onde se combinou a Alfainterferona (substância ativa) 2b com quimioterapia (8 pacientes). Os esquemas de tratamento com Alfainterferona (substância ativa) 2b foram de 3 - 6 x 106 UI/m2/dia, 5 vezes por semana durante 6 meses e depois 3 x 106 UI/m2, 3 vezes por semana até nova recaída. Em pacientes em que se obteve a remissão clínico–hematológica com bussulfan, o tratamento com Alfainterferona (substância ativa) 2b durante a fase de manutenção prolongou o intervalo livre de recaídas a 72,5 ± 5,5 semanas, enquanto que no grupo não tratado foi de 24,6 ± 4,2 semanas. Não houve diferenças com o grupo que recebeu Alfainterferona (substância ativa) 2b leucocitário nem com o que recebeu a quimioterapia junto com a Alfainterferona (substância ativa) 2b. No total, os 18 pacientes que receberam Alfainterferona (substância ativa) 2b tiveram um intervalo livre de recaídas de 69,8 semanas, em média.
Sarcoma de Kaposi relacionado com AIDS
A Alfainterferona (substância ativa) 2b tem sido usada em séries de casos para o tratamento deste tumor. É possível obter remissões depois de 12 – 24 meses de tratamento. Também tem-se usado em aplicações intralesionais.
Relatou-se um caso tratado, com bons resultados.
Carcinoma renal
O carcinoma renal metastático é uma das indicações aceitas internacionalmente para o IFN alfa-2b [13]. Há três séries de casos com carcinoma metastático ou operados de carcinoma renal tratados com Alfainterferona (substância ativa) 2b nos quais utilizou-se a Alfainterferona (substância ativa) 2b como tratamento adjuvante ou neoadjuvante de manutenção. No primeiro estudo obteve-se 5 respostas objetivas, 3 estabilizações da enfermidade e uma progressão em 9 casos. Em quatro deles a resposta ou estabilização foi de mais de 18 meses. No segundo estudo utilizou-se a Alfainterferona (substância ativa) 2b combinada com quimioterapia em 6 casos com tumor metastático ou avançado, não operáveis, obtendo-se sobrevida prolongada (42 meses) em um deles. Já em pós-nefrectomia (23 pacientes) ou cirurgia conservadora do tumor (3 pacientes) relatou-se uma sobrevida média de mais de 40 meses, com 15 pacientes vivos por mais de 5 anos.
A terceira série são 15 pacientes nefrectomizados (nefrectomia total sem linfadenectomia), desde 1992 até 2002, que receberam atendimento no Hospital Clínico-Cirúrgico “Manuel Fajardo” da Cidade de Havana, cujos diagnósticos clínicos e anatomopatológicos (biópsia tumoral) foram de câncer de células renais, e que receberam como tratamento adjuvante Alfainterferona (substância ativa) 2b. Houve predomínio do sexo masculino, raça branca, e a idade média foi de 57 anos. Os sintomas referidos na consulta inicial foram predominantemente hematúria e dor. Em 53% dos pacientes a enfermidade estava no estágio I de acordo com a classificação de Robson, 33.3% no estágio II e 6,7 % no estágio III. A mediana da dose total de Alfainterferona (substância ativa) 2b recebida por esse grupo de pacientes foi de 216 x 106 UI em ciclos de tratamento de 10 x 106 UI semanais divididos em duas ou três doses durante 6 meses. Em 64,3 % dos pacientes houve resposta total e em 35,7% houve progressões, que corresponderam aos óbitos. O tempo médio de sobrevida foi de 104 meses (8,7 anos). Aos dois anos a sobrevida foi de 92,9 % e aos 5 anos 78,6%. Em 93,3% dos pacientes vivos o estado geral 0 da escala da OMS foi mantido (assintomático). A maior resposta ao tratamento relacionou-se de maneira significativa com o hábito de não fumar, estágios I-II da enfermidade e ao tamanho tumoral < 80 mm.
Tricoleucemia
Esta foi a primeira indicação aprovada para a Alfainterferona (substância ativa) 2b no mundo [14]. Ainda que não se tenham feito estudos nem relatado casos tratados com Alfainterferona (substância ativa) 2b, incluiu-se a indicação, dada a equivalência entre estas preparações, demonstrada em suas propriedades fisico-químicas, biológicas e a eficácia em outras indicações, assim como os dados de segurança acumulados. Produz-se regressão da enfermidade ou estabilização clínica significativa mesmo que o paciente tenha sido esplenectomizado previamente.
Melanoma maligno
Esta é também uma indicação aprovada para a Alfainterferona (substância ativa) 2b pela literatura internacional, como terapia adjuvante à cirurgia. Semelhantemente à sua indicação na tricoleucemia, ainda que não se tenham feito estudos nem relatado casos tratados com Alfainterferona (substância ativa) 2b, incluiu-se a indicação, dada a equivalência entre estas preparações, demonstrada em suas propriedades fisico-químicas, biológicas e a eficácia em outras indicações, assim como os dados de segurança acumulados.
Características Farmacológicas
Farmacodinâmica
Alfainterferona (substância ativa) 2b é um modificador da resposta imunobiológica, com efeitos antiviral, antiproliferativo e imunomodulador. Todas estas propriedades biológicas descritas foram encontradas na Alfainterferona (substância ativa) 2b.
O efeito antiviral do produto, através da inibição da replicação do DNA e RNA, foi demonstrado em testes realizados em vários sistemas de cultura de células infectadas por vírus. No caso de retrovírus, a reunião de partículas virais é inibida. Em células infectadas por Papilomavírus Humano (HPV), o produto tem demonstrado inibir a expressão dos genes virais.
Quanto à atividade antiproliferativa, os Interferons são as primeiras proteínas naturais observadas com ação reguladora negativa sobre células em crescimento, tendo ação antagônica a todos os fatores de crescimento conhecidos. O efeito é citostático (mais do que citotóxico) e reversível.
O efeito imunomodulador do produto inclui ações sobre vários elementos do sistema imune, tais como:
Estimulação das atividades líticas das células natural killer, linfócitos T citotóxicos e macrófagos sobre as células tumorais infectadas, modificação da produção de anticorpos pelas células B, regulação da expressão de antígenos MHC na membrana celular, e a estimulação da produção do Interferon Alfa.
Farmacocinética
O metabolismo da Alfainterferona (substância ativa) 2b não é diferente do encontrado para os Interferons Alfa em geral. Os Interferons alfa são filtrados totalmente nos glomérulos e degradados por proteases durante a reabsorção tubular, de maneira que não reaparecem na circulação sistêmica nem na urina. O metabolismo hepático não parece ser importante neste caso.
A concentração sérica de Alfainterferona (substância ativa) 2b tem uma grande variação individual. Os níveis máximos de atividade antiviral no soro são alcançados 3-8 horas depois de uma injeção intramuscular ou subcutânea. Este nível é dose dependente (entre 50 e 200 UI/mL quando se administram 6 milhões UI por essa via). A vida média de eliminação no soro é de cerca de 4 horas.
Contudo, os efeitos biológicos persistem depois que o interferon extracelular foi eliminado. In vitro, o efeito protetor induzido por Alfainterferona (substância ativa) 2b contra a infecção por vírus Mengo ou Herpes em células Hep-2 persiste por pelo menos 30 horas depois de lavar o produto do meio de cultivo. Em voluntários sadios e em indivíduos infectados com hepatite B detecta-se a ativação da 2’5’- oligoadenilato sintetase em linfócitos periféricos até 4 dias após uma administração intramuscular de Alfainterferona (substância ativa) 2b.