Comparamos o preço de Ofev - 100 Mg 60 Cápsulas Mole, veja o menor preço

R$ 7.033,04
RReferência
17
ofertasMelhores preços a partir de R$ 7.033,04 até R$ 12.705,99
Menor preço
vendido por Mundial Farma
economize
44.65%
R$ 7.033,04
vendido por Agille Medicamentos
economize
22.07%
R$ 9.901,49
Preço Válido para compra em Boleto
vendido por Agille Speciality
economize
22.07%
R$ 9.901,49
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Oncomg Medicamentos Especiais
economize
19.72%
R$ 10.200,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farma Visa
economize
18.24%
R$ 10.388,70
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
vendido por Life Medicamentos
economize
18.24%
R$ 10.388,70
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Imune Farma Medicamentos Especiais
economize
18.24%
R$ 10.388,80
vendido por Farma Ame
economize
18.24%
R$ 10.388,85
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farma Silva
economize
18.23%
R$ 10.390,00
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
vendido por Onco Express Medicamentos Especiais e Oncológicos
economize
18.15%
R$ 10.400,00
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
vendido por Aliria Medicamentos Especiais
economize
18.09%
R$ 10.407,13
vendido por Drogaria Dinâmica
economize
15.12%
R$ 10.785,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por OncoExpresso Medicamentos
economize
15.00%
R$ 10.800,00
vendido por Facilita Medicamentos
economize
14.17%
R$ 10.905,23
vendido por Onco Health
economize
3.38%
R$ 12.276,31
vendido por Fast Medicamentos
economize
0.31%
R$ 12.666,52
vendido por Pague Menos
R$ 12.705,99
Para que serve
Ofev é indicado para o tratamento e retardo da progressão da fibrose pulmonar idiopática.
Como o Ofev funciona?
O nintedanibe atua inibindo a proliferação, migração e transformação de fibroblastos, que são células envolvidas no desenvolvimento da fibrose pulmonar idiopática. Desta forma, atua tratando e diminuindo a progressão da doença.
Contraindicação
Você não deve usar Ofev se tiver alergia conhecida ao nintedanibe, amendoim, soja ou a qualquer excipiente do produto e/ou durante a gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Como usar
O tratamento com Ofev deve ser iniciado por médicos com experiência no diagnóstico e tratamento da fibrose pulmonar idiopática (FPI).
A cápsula de Ofev deve ser ingerida com água e, preferencialmente, junto com alimentos.
Este medicamento não deve ser partido, aberto ou mastigado.
A dose recomendada é de 150 mg duas vezes ao dia, administrados em intervalos de 12 horas.
Ajustes de dose
Além do tratamento sintomático, se for o caso, o manejo dos eventos adversos de Ofev pode incluir a redução da dose ou a interrupção temporária de Ofev. O tratamento com Ofev pode ser reiniciado com a dose completa (150 mg duas vezes ao dia) ou com uma dose reduzida (100 mg duas vezes ao dia). Nesses casos, seu médico saberá conduzir o manejo de Ofev.
População pediátrica
Não há dados nos estudos clínicos que autorizem o uso de Ofev em pacientes pediátricos.
Idosos (65 anos ou mais)
Não foram observadas diferenças gerais na segurança e na eficácia em pacientes idosos em comparação aos pacientes com idade abaixo de 65 anos, não sendo necessário ajuste da dose inicial com base na idade do paciente.
Raça
Nenhum ajuste de dose de Ofev é necessário, com base em sua raça.
Peso corporal
Nenhum ajuste de dose de Ofev é necessário, com base em seu peso corporal.
Insuficiência renal (mau funcionamento dos rins)
Menos de 1% da dose única de nintedanibe é excretada via renal. Não é necessário ajuste da dose inicial em pacientes com insuficiência renal leve a moderada. Todavia, não há dados que suportem o uso de Ofev em pacientes com insuficiência renal grave (< 30 mL/min de CrCL).
Insuficiência hepática (mau funcionamento do fígado):
O nintedanibe é predominantemente eliminado por excreção biliar/fezes (> 90%). A exposição aumentou em pacientes com insuficiência hepática (leve e moderada). Não é necessário ajuste da dose inicial em pacientes com insuficiência hepática leve. Uma vez que não existem dados em pacientes com insuficiência hepática moderada e grave, Ofev não é recomendado para estes pacientes.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e duração do tratamento.
Não interrompa o tratamento sem conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar este medicamento?
Você deve tomar a dose recomendada no próximo horário programado (habitual). Não duplique a dose e nunca exceda a dose máxima recomendada diária de 300 mg.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Diarreia
Ofev pode causar diarreia no início do tratamento; seu médico poderá receitar medicamentos para a diarreia ou interromper o tratamento com Ofev temporariamente. Seu médico poderá reiniciar o tratamento com uma dose reduzida ou com uma dose completa. Nos casos de persistência de sintomas severos, o tratamento com Ofev será descontinuado definitivamente.
Náuseas e vômitos
Ofev pode causar náuseas e vômitos; seu médico poderá receitar medicamentos sintomáticos, reduzir a dose ou interromper o tratamento com Ofev temporariamente. Seu médico poderá reiniciar o tratamento com uma dose reduzida ou com uma dose completa. Nos casos de persistência de sintomas severos, o tratamento com Ofev será descontinuado definitivamente.
Doenças do fígado
O tratamento com Ofev não é recomendado se você tiver doença moderada a grave do fígado. O risco de eventos adversos pode ser maior em pacientes com doença leve do fígado. Antes de iniciar o tratamento, seu médico deve realizar exames para testar os níveis de enzimas do fígado e a concentração de bilirrubina; durante o tratamento pode ocorrer aumento destas substâncias, portanto, seu médico deverá solicitar a realização de exames periodicamente. Dependendo dos resultados e dos sintomas, poderá reduzir a dose ou interromper o tratamento temporária ou definitivamente. Assim que os resultados dos exames voltarem a níveis normais, seu médico poderá reiniciar o tratamento com uma dose reduzida ou com uma dose completa.
Sangramentos e tromboembolismo venoso
O modo de ação de Ofev pode aumentar o risco de sangramentos e tromboembolismo venoso. Seu médico deve avaliar este risco.
Infarto do miocárdio (músculo do coração) e derrame
Pacientes com histórico recente não foram estudados. Seu médico deverá ter cautela se você tiver maior risco de doenças cardiovasculares e poderá interromper o tratamento se você apresentar sinais ou sintomas de infarto do miocárdio.
Perfuração gastrointestinal (abertura da parede do estômago ou intestino)
O modo de ação de Ofev pode aumentar o risco de perfurações gastrointestinais, entretanto, não foi observado o aumento deste risco durante os estudos com Ofev. No caso de perfuração gastrointestinal, seu médico deverá interromper o tratamento. Seu médico também deverá ter cautela se você já passou por cirurgia abdominal e deverá esperar pelo menos 4 semanas após uma cirurgia maior, incluindo-se cirurgias abdominais, para iniciar o tratamento com Ofev.
Cicatrização de feridas
O modo de ação de Ofev pode afetar o processo de cicatrização de feridas e seu médico deverá avaliar seu caso.
Excipiente lecitina de soja
As cápsulas de Ofev contém lecitina de soja.
Não use medicamento sem conhecimento do seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
Os eventos adversos mais frequentemente relatados associados com o uso de nintedanibe incluem diarreia, náuseas (enjoo) e vômitos, dor abdominal (dor na barriga), diminuição do apetite, perda de peso e aumento das enzimas do fígado.
Reações muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
Diarreia, náuseas (enjoo), dor abdominal (dor de barriga) e aumento de enzimas hepáticas (enzimas do fígado).
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Vômitos, aumento de enzimas do fígado: alanina aminotransferase (ALT), aspartato aminotransferase (AST) e gama glutamiltransferase (GGT); diminuição do apetite e perda de peso.
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
Aumento de fosfatase alcalina (FA) sanguínea, hiperbilirrubinemia (aumento de produção de bilirrubina, um dos pigmentos da bile que é secretada pelo fígado e acumulada na vesícula biliar) e hipertensão (pressão alta).
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
População Especial
Efeitos sobre capacidade de dirigir e operar máquinas
Não foram realizados estudos sobre o efeito na capacidade de dirigir e operar máquinas. Você deverá tomar cuidado quando for conduzir ou utilizar máquinas durante o tratamento com Ofev.
Fertilidade, Gravidez e Amamentação
Estudos em ratos não indicaram efeitos na fertilidade de machos, porém mostraram redução da fertilidade das fêmeas de ratos em níveis de exposição aproximadamente 3 vezes a máxima dose humana recomendada (MDHR).
Mulheres com possibilidade de engravidar devem fazer o teste de gravidez antes de iniciar o tratamento com Ofev e também evitar a gravidez durante o tratamento, pois estudos com Ofev em ratos e coelhos identificaram óbitos e danos na formação fetal.
Mulheres em tratamento com Ofev devem usar métodos contraceptivos adequados durante e pelo menos 3 meses após a última dose de Ofev.
Avise seu médico ou farmacêutico se você engravidar. A interrupção do seu tratamento com Ofev deve ser considerada.
Como precaução, a amamentação deve ser interrompida durante o tratamento com Ofev.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Informe imediatamente seu médico em caso de suspeita de gravidez.
Composição
Ofev 100 mg:
Cada cápsula contém:
Nintedanibe: 100 mg, correspondentes a 120,4 mg de esilato de nintedanibe.
Ofev 150 mg:
Cada cápsula contém:
Nintedanibe: 150 mg, correspondentes a 180,6 mg de esilato de nintedanibe.
Cada cápsula contém os excipientes: triglicerídeos de cadeia média, glicerídeos semissintéticos, lecitina de soja, gelatina, glicerol, dióxido de titânio, óxido de ferro vermelho, óxido de ferro amarelo e tinta preta.
Superdosagem
Não há um antídoto específico ou tratamento para a superdose de Ofev. Em caso de superdose, pode ocorrer aumento de enzimas hepáticas e sintomas gastrointestinais; o tratamento deve ser interrompido e as medidas de suporte geral devem ser iniciadas conforme apropriado.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
O nintedanibe é um substrato da glicoproteína-P (P-gp). O nintedanibe demonstrou não ser um substrato ou inibidor de OATP-1B1, OATP-1B3, OATP-2B1, OCT-2 ou MRP-2 in vitro. O nintedanibe também não foi um substrato de BCRP. Foi considerado apenas um fraco inibidor potencial de OCT-1, BCRP e P-gp, através de observações in vitro, o que é considerado de baixa relevância clínica. O mesmo se aplica para nintedanibe sendo um substrato de OCT-1.
Inibidores da P-gp
Inibidores potentes da P-gp (por exemplo, cetoconazol ou eritromicina) podem aumentar a exposição ao nintedanibe. Nesses casos, os pacientes devem ser cuidadosamente monitorizados quanto à tolerabilidade de nintedanibe. O manejo de eventos adversos pode requerer interrupção, redução da dose ou descontinuação da terapia com Esilato de Nintedanibe (substância ativa). Em um estudo dedicado de interação medicamentosa, a coadministração com cetoconazol aumentou a exposição ao nintedanibe em 1,61 vezes com base na ASC e em 1,83 vezes com base na Cmáx.
Indutores da P-gp
Indutores potentes da P-gp (por exemplo, rifampicina, carbamazepina, fenitoína e hipérico (erva-de-são-joão)) podem diminuir a exposição ao nintedanibe. Deve-se considerar a seleção de uma medicação concomitante alternativa sem ou com mínimo potencial de indução da P-gp. Em um estudo de interação medicamentosa com rifampicina, a exposição ao nintedanibe diminuiu em 50,3% com base na ASC e em 60,3% com base na Cmáx.
Enzimas do citocromo (CYP)
Apenas uma extensão menor da biotransformação de nintedanibe consistiu em vias de CYP. O nintedanibe e seus metabólitos, a porção de ácido livre BIBF 1202 e seu glicuronídeo BIBF 1202 não inibiram ou induziram as enzimas CYP em estudos pré-clínicos. Portanto, considera-se baixa a probabilidade de interações medicamentosas com nintedanibe com base no metabolismo de CYP.
Tratamento concomitante com pirfenidona
O tratamento concomitante de nintedanibe com pirfenidona foi investigado em um estudo com desenho de grupo paralelo em pacientes japoneses com FPI. Vinte e quatro pacientes foram tratados durante 28 dias com 150 mg de nintedanibe duas vezes ao dia. Em 13 pacientes, nintedanibe foi adicionado ao tratamento crônico com doses padrão de pirfenidona.
Onze pacientes receberam monoterapia de nintedanibe. A exposição ao nintedanibe tendeu a ser menor quando o nintedanibe foi administrado com pirfenidona em seu topo, comparado à administração de nintedanibe em monoterapia. O nintedanibe não exerceu nenhum efeito sobre a farmacocinética de pirfenidona. Devido à curta duração da exposição concomitante e ao baixo número de pacientes, nenhuma conclusão sobre a segurança e eficácia da combinação pode ser tirada.
Outros medicamentos
O potencial de interações de nintedanibe com contraceptivos hormonais não foi explorado.
Interação Alimentícia
Recomenda-se que Esilato de Nintedanibe (substância ativa) seja tomado com alimentos.
Ação da Substância
Resultados de eficácia
A eficácia clínica de nintedanibe foi estudada em pacientes com FPI em dois estudos de fase 3, randomizados, duplo-cegos e controlados com placebo com desenho idêntico (INPULSIS-1 e INPULSIS-2). Os pacientes foram randomizados em uma proporção de 3:2 para tratamento com Esilato de Nintedanibe 150 mg ou placebo duas vezes ao dia durante 52 semanas.
O desfecho primário foi a taxa anual de declínio na Capacidade Vital Forçada (CVF). Os desfechos secundários principais de avaliação foram a alteração na pontuação total no Questionário Respiratório de Saint George (QRSG) a partir do período basal até 52 semanas e o tempo para a primeira exacerbação aguda de FPI.
Taxa anual de declínio da CVF
A taxa anual de declínio da CVF (em mL) foi significativamente reduzida em pacientes que receberam nintedanibe em comparação com pacientes que receberam placebo. O efeito do tratamento foi consistente em ambos os estudos. Veja na Tabela 1 os resultados individuais e agrupados dos estudos.
Tabela 1: Taxa anual de declínio da CVF (mL) nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados - conjunto tratado:
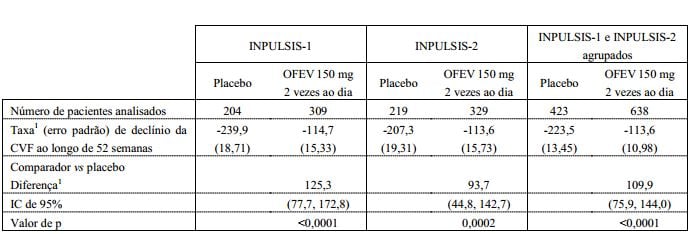
1Estimada com base em um modelo de regressão de coeficiente aleatório.
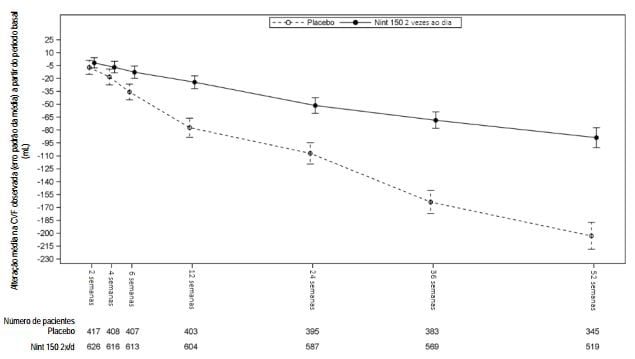
A robustez do efeito de nintedanibe na redução da taxa anual de declínio da CVF foi confirmada em todas as análises de sensibilidade pré-especificadas. Além disso, foram observados efeitos semelhantes em outros parâmetros de avaliação da função pulmonar, por exemplo, alteração na CVF a partir do período basal até a semana 52 e análise de pacientes que obtiveram resposta na CVF, provendo respaldo adicional para os efeitos de nintedanibe no retardo da progressão da doença. A Figura 1 mostra a evolução da alteração na CVF a partir do período basal ao longo do tempo em ambos os grupos de tratamento, com base na análise agrupada dos estudos INPULSIS-1 e INPULSIS-2.
Figura 1: Alteração média na CVF observada (erro padrão da média) a partir do período basal (mL) ao longo do tempo, nos estudos INPULSIS-1 e INPULSIS-2 agrupados:
Análise de pacientes que obtiveram resposta na CVF
Em ambos os estudos INPULSIS, a proporção de pacientes que obtiveram resposta na CVF, definidos como pacientes com um declínio absoluto na porcentagem da CVF prevista não superior a 5% (um limiar indicativo do aumento no risco de mortalidade em FPI), foi significativamente maior no grupo de nintedanibe em comparação ao grupo placebo. Resultados semelhantes foram observados em análises usando um limiar mais conservador de 10%. Veja a Tabela 2 para os resultados individuais e agrupados dos estudos.
Tabela 2: Proporção de pacientes que obtiveram resposta na CVF em 52 semanas nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados - conjunto tratado:
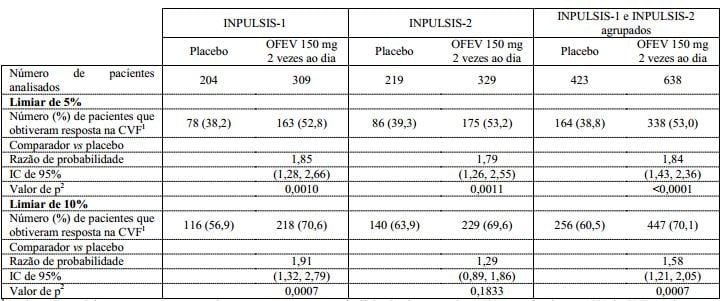
1 Pacientes que obtiveram resposta são aqueles que não apresentaram declínio absoluto superior a 5% ou maior do que 10% da CVF prevista em 52 semanas.
2 Com base em uma análise de regressão logística.
Tempo para progressão (? 10% de declínio absoluto da CVF prevista ou morte)
Em ambos os estudos INPULSIS, o risco de progressão foi estatisticamente e significativamente reduzido nos pacientes tratados com nintedanibe em comparação com o placebo. Na análise agrupada, a RR foi de 0,60, indicando uma redução de 40% no risco de progressão para os pacientes tratados com nintedanibe em comparação com placebo, veja a Tabela 3.
Tabela 3: Frequência de pacientes com ? 10% de declínio absoluto da CVF prevista ou morte ao longo de 52 semanas e tempo de progressão nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados – conjunto tratado:
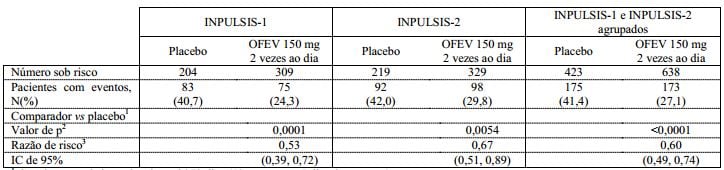
1 Com base em dados coletados até 372 dias (52 semanas + 7 dias de margem).
2 Com base no teste de Log-rank.
3 Com base em um modelo de regressão de Cox.
Alteração na pontuação total do QRSG na semana 52 a partir do período basal
A pontuação total do Questionário Respiratório St. George (QRSG), que avaliou a qualidade de vida relacionada à saúde (QVRS), foi analisada em 52 semanas. No INPULSIS-2, os pacientes que receberam placebo tiveram um aumento maior na pontuação total de QVRS a partir do basal em comparação com pacientes que receberam 150mg de nintedanibe duas vezes ao dia. A deterioração da QVRS foi menor no grupo nintedanibe; a diferença entre os grupos de tratamento foi estatisticamente significativa (-2,69, IC de 95%: -4,95, -0,43, p = 0,0197).
No INPULSIS-1, o aumento na pontuação total do QRSG na semana 52 a partir do período basal foi comparável entre nintedanibe e placebo (diferença entre os grupos de tratamento: -0,05, IC de 95%: -2,50, 2,40, p = 0,9657). Na análise agrupada dos estudos INPULSIS, a alteração média estimada desde o período basal até a semana 52 na pontuação total do QRSG foi menor no grupo nintedanibe (3,53) do que no grupo placebo (4,96), com uma diferença entre os grupos de tratamento de -1,43 (IC de 95%: -3,09, 0,23, p = 0,0923). No geral, o efeito de nintedanibe na qualidade de vida relacionada à saúde, medida pela pontuação total do QRSG, foi modesto, indicando uma menor deterioração em comparação com placebo.
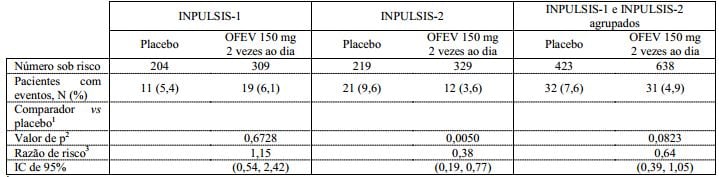
Tempo para a primeira exacerbação aguda de FPI
No estudo INPULSIS-2, o risco de ocorrência da primeira exacerbação aguda de FPI ao longo de 52 semanas foi significativamente reduzido nos pacientes que receberam nintedanibe em comparação com o placebo; no estudo INPULSIS-1, não houve diferença entre os grupos de tratamento. Na análise agrupada dos estudos INPULSIS, um risco numericamente inferior da ocorrência da primeira exacerbação aguda foi observado em pacientes que receberam nintedanibe em comparação aos pacientes que receberam placebo. A Tabela 3 mostra os resultados individuais e agrupados dos estudos.
Tabela 4: Tempo para a primeira exacerbação aguda ao longo de 52 semanas com base em eventos notificados pelo investigador nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados – conjunto tratado:
1 Com base em dados coletados até 372 dias (52 semanas + 7 dias de margem).
2 Com base no teste de Log-rank.
3 Com base em um modelo de regressão de Cox.
Todos os eventos adversos de exacerbação aguda de FPI relatados pelos pesquisadores foram avaliados por um comitê cego de avaliação. Uma análise de sensibilidade pré-especificada do tempo até a primeira “suspeita” de exacerbação aguda de FPI foi realizada nos dados agrupados. A frequência de pacientes com pelo menos uma exacerbação avaliada ocorrida dentro de 52 semanas foi menor no grupo nintedanibe (1,9% dos pacientes) do que no grupo placebo (5,7% dos pacientes). A análise do tempo até a ocorrência do evento de exacerbação (avaliada utilizando dados agrupados dos estudos ) produziu uma razão de risco (HR) de 0,32 ( IC de 95% 0,16, 0,65, p = 0,0010). Isto indica que o risco de ter uma primeira exacerbação aguda de FPI foi significativamente menor no grupo nintedanibe do que no grupo placebo em qualquer ponto analítico, com significância estatística.
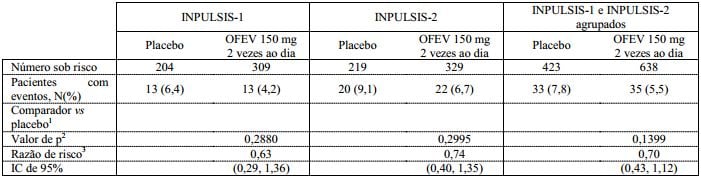
Análise de sobrevida
Na análise agrupada pré-especificada de dados de sobrevida dos estudos INPULSIS, a mortalidade total ao longo de 52 semanas foi menor no grupo nintedanibe (5,5%) em comparação com o grupo placebo (7,8%). A análise do tempo até a morte resultou em uma HR de 0,70 (IC de 95% 0,43, 1,12, p = 0,1399). Os resultados de todos os desfechos de sobrevida (como a mortalidade durante o tratamento e mortalidade por causas respiratórias) mostraram uma diferença numérica consistente a favor de nintedanibe.
Tabela 5: Todas as causas de mortalidade ao longo de 52 semanas nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados – conjunto tratado:
1 Com base em dados coletados até 372 dias (52 semanas + 7 dias de margem).
2 Com base no teste de Log-rank.
3 Com base em um modelo de regressão de Cox.
Evidências de suporte dos resultados do estudo de fase 2 (1199.30) com Esilato de Nintedanibe (substância ativa) 150 mg duas vezes ao dia
Evidências adicionais da eficácia são fornecidas pelo estudo de fase 2, randomizado, duplo-cego, controlado por placebo, de determinação de dose, incluindo um grupo de dose de 150 mg de nintedanibe duas vezes ao dia. O desfecho primário, taxa de declínio da CVF ao longo de 52 semanas, foi menor no braço nintedanibe (-0,060 L/ano, N = 84) do que no braço placebo (-0,190 L/ano, N = 83). A diferença estimada entre os grupos de tratamento foi de 0,131 L/ano (IC de 95% 0,027, 0,235). A diferença entre os grupos de tratamento atingiu significância estatística nominal (p = 0,0136).
A alteração média estimada na pontuação total do QRSG a partir do período basal até 52 semanas foi de 5,46 para o placebo, indicando piora da qualidade de vida relacionada à saúde, e de -0,66 para nintedanibe, indicando estabilidade na qualidade de vida relacionada à saúde. A diferença média estimada para nintedanibe em comparação ao placebo foi de -6,12 (IC de 95%: -10,57, -1,67; p = 0,0071).
O número de pacientes com exacerbações agudas de FPI ao longo de 52 semanas foi menor no grupo nintedanibe (2,3%, N = 86) comparado ao placebo (13,8%, N = 87). A taxa de risco estimada de nintedanibe versus placebo foi de 0,16 (IC de 95% 0,04, 0,71, p = 0,0054).
Efeito no intervalo QT
As medições de QT/QTc foram registradas e analisadas a partir de um estudo dedicado realizado em pacientes com carcinoma de células renais comparando a monoterapia de nintedanibe versus a monoterapia de sunitinibe.3 Neste estudo de doses orais únicas de 200 mg de nintedanibe, bem como de doses orais múltiplas de 200 mg duas vezes ao dia de nintedanibe administradas durante 15 dias, não prolongaram o intervalo QTcF.
Estudos pediátricos
Não foram conduzidos estudos clínicos em crianças e adolescentes.
Características Farmacológicas
Farmacodinâmica
Mecanismo de ação
O nintedanibe é uma molécula pequena que age como inibidor triplo de tirosina quinase, incluindo os receptores: receptor de fator de crescimento derivado de plaquetas (PDGFR) ? e ?, receptor de fator de crescimento fibroblástico (FGFR) 1-3 e receptor de fator de crescimento endotelial vascular (VEGFR) 1-3. Nintedanibe liga-se competitivamente ao sítio de ligação de ATP desses receptores e bloqueia a sinalização intracelular, que é crucial para a proliferação, migração e transformação de fibroblastos, que são mecanismos essenciais para a fisiopatologia da FPI. Além disso, nintedanibe inibe as quinases Flt-3, Lck, Lyn e Src.
Efeitos farmacodinâmicos
A ativação das cascatas de sinalização de FGFR e PDGFR está criticamente envolvida na proliferação e migração de fibroblastos/miofibroblastos pulmonares, células características na fisiopatologia de fibrose pulmonar idiopática. O impacto potencial da inibição de VEGFR na fisiopatologia da FPI ainda não está completamente elucidado. A nível molecular, acredita-se que o nintedanibe iniba as cascatas de sinalização de FGFR e PDGFR, mediando a proliferação e migração de fibroblastos pulmonares através da interação com o sítio de ligação do trifosfato de adenosina (ATP) do domínio quinase do receptor intracelular, interferindo, assim, na ativação cruzada da via de autofosforilação dos homodímeros receptores. In vitro, os receptores alvo são inibidos pelo nintedanibe em baixas concentrações nanomolares.
Em fibroblastos pulmonares humanos de pacientes com FPI, nintedanibe inibiu a proliferação celular estimulada por PDGF, FGF e VEGF com valores de EC50 de 11 nmol/L, 5,5 nmol/L e menos de 1 nmol/L, respectivamente. Em concentrações entre 100 e 1000 nmol/L, nintedanibe também inibiu a migração de fibroblastos estimulada por PDGF, FGF e VEGF e a transformação de fibroblastos a miofibroblastos induzida por TGF-?2. Além disso, acredita-se que a atividade anti-inflamatória de nintedanibe limite a estimulação fibrótica pela redução de mediadores pró-fibróticos como IL-1? a IL-6. A contribuição da atividade antiangiogênica de nintedanibe para o seu mecanismo de ação em doenças pulmonares fibróticas ainda não foi esclarecida. Em estudo in vivo, nintedanibe demonstrou possuir potente atividade antifibrótica e anti-inflamatória.
Farmacocinética
A farmacocinética de nintedanibe pode ser considerada linear em relação ao tempo (isto é, os dados de dose única podem ser extrapolados para os dados de doses múltiplas). O acúmulo em múltiplas administrações foi de 1,04 vezes para Cmáx e 1,38 vezes para AUC?. As concentrações mínimas de nintedanibe permaneceram estáveis por mais de um ano.
Absorção
Nintedanibe atingiu concentrações plasmáticas máximas em aproximadamente 2 - 4 horas após a administração oral de cápsulas gelatinosas moles (intervalo de 0,5-8 h). A biodisponibilidade absoluta de uma dose de 100 mg foi de 4,69% (IC de 90%: 3,615-6,078) em voluntários saudáveis. A absorção e a biodisponibilidade são diminuídas por efeitos de transportadores e metabolismo substancial de primeira passagem. Foi demonstrada proporcionalidade da dose por aumento da exposição ao nintedanibe (intervalo de dose 50-450 mg uma vez ao dia e 150-300 mg duas vezes ao dia).
As concentrações plasmáticas em estado de equilíbrio foram atingidas dentro de uma semana após a administração, no mais tardar. Após a ingestão de alimentos, a exposição ao nintedanibe aumentou em aproximadamente 20% em comparação à administração realizada em jejum (IC: 95,3-152,5%) e houve retardo na absorção (tmáx mediano em jejum: 2,00 h; alimentado: 3,98 h).
Distribuição
Nintedanibe segue uma cinética com disposição ao menos bifásica. Após infusão intravenosa, foi observado um grande volume de distribuição durante a fase terminal (Vz: 1050 L, 45,0% gCV). A ligação proteica avaliada in vitro de nintedanibe em plasma humano foi elevada, com uma fração ligada de 97,8%. A albumina sérica é considerada a principal proteína de ligação. Nintedanibe é preferencialmente distribuído no plasma com uma razão plasma/sangue de 0,869.
Metabolismo
A reação metabólica predominante para nintedanibe é a clivagem hidrolítica por esterases, resultando na porção de ácido livre BIBF 1202. BIBF 1202 é posteriormente glicuronizado por enzimas UGT, a citar, UGT 1A1, UGT 1A7, UGT 1A8 e UGT 1A10, ao glicuronídeo BIBF 1202. Apenas uma extensão menor da biotransformação de nintedanibe ocorre por vias de CYP, com CYP 3A4 sendo a enzima predominantemente envolvida. O principal metabólito dependente de CYP não pôde ser detectado no plasma no estudo de ADME humano. In vitro, o metabolismo dependente de CYP foi responsável por cerca de 5%, em comparação a cerca de 25% de clivagem de éster.
Eliminação
A depuração plasmática total após infusão intravenosa foi elevada (CL: 1390 mL/min, 28,8% gCV).
A excreção urinária da substância ativa inalterada dentro de 48 horas foi de cerca de 0,05% da dose (31,5% gCV) após administração oral e cerca de 1,4% da dose (24,2% gCV) após a administração intravenosa; a depuração renal foi de 20 mL/min (32,6% gCV). A principal via de eliminação da radioatividade relacionada ao medicamento após a administração oral de [14C]-nintedanibe ocorreu pela via de excreção fecal/biliar (93,4% da dose, 2,61% gCV). A contribuição da excreção renal para a depuração total foi baixa (0,649% da dose, 26,3% gCV). A recuperação global foi considerada completa (acima de 90%) dentro de 4 dias após a administração. A meia-vida terminal de nintedanibe ocorreu entre 10 e 15 h (%gCV, aproximadamente, 50%).
Relação entre exposição e resposta
As análises de exposição-resposta indicaram uma relação Emáx similar entre a exposição no intervalo observado na fase II e III e a taxa anual de declínio da CVF com uma EC50 de cerca de 3-
5 ng/mL (erro padrão relativo: 54-67%). Com respeito à segurança, parece haver uma fraca relação entre a exposição plasmática de nintedanibe e elevações de ALT e/ou AST. A dose real administrada poderia ser o melhor indicador para o risco de desenvolver diarréia de qualquer intensidade, mesmo que a exposição plasmática, como fator determinante de risco, não pudesse ser descartada
Fatores intrínsecos e extrínsecos; populações especiais
As propriedades farmacocinéticas de nintedanibe foram semelhantes em voluntários saudáveis, pacientes com FPI e pacientes com câncer. Com base nos resultados de uma análise farmacocinética populacional (PopPK) em pacientes com FPI e carcinoma de pulmão de células não pequenas (CPCNP) (N = 1191) e investigações descritivas, a exposição ao nintedanibe não foi influenciada pelo sexo (corrigido pelo peso corporal), insuficiência renal leve e moderada (estimada pela depuração da creatinina), consumo de álcool ou genótipo de glicoproteína-P (P-gp).
A análise PopPK indicou efeitos moderados na exposição ao nintedanibe com relação a idade, peso corporal e raça, que são descritos a seguir. Com base na variabilidade interindividual elevada de exposição observada, efeitos moderados são considerados não clinicamente relevantes.
Idade
A exposição ao nintedanibe aumentou linearmente com a idade. AUC?ss diminuiu em 16% para um paciente de 45 anos de idade (5o percentil) e aumentou em 13% para um paciente de 76 anos de idade (95o percentil) em relação a um paciente com a idade mediana de 62 anos. A faixa etária coberta pela análise foi de 29 a 85 anos; aproximadamente 5% da população tinha mais de 75 anos. Estudos em populações pediátricas não foram realizados.
Insuficiência hepática
Os dados farmacocinéticos de nintedanibe foram coletados em pacientes com anormalidades nos parâmetros hepáticos definidas por elevações nos níveis de AST, ALT e bilirrubina. Uma tendência à exposição elevada foi observada em pacientes com valores elevados de AST e ALT (até 10 x LSN) e os níveis de bilirrubina elevados (até 1,5 x LSN) no período basal em comparação a pacientes com níveis normais de AST, ALT e bilirrubina. Em pacientes com ALT ou AST> 10x LSN e bilirrubina> 1,5x LSN, os dados foram muito limitados para se tirar conclusões.
Peso corporal
Foi observada uma correlação inversa entre peso corporal e exposição ao nintedanibe. AUC?, ss aumentou em 25% para um paciente de 50 kg (5o percentil) e diminuiu em 19% para um paciente de 100 kg (95o percentil) em relação a um paciente com o peso mediano de 71,5 kg.
Raça
A exposição média geométrica para nintedanibe foi 33% maior em chineses, taiwaneses e pacientes indígenas, enquanto que foi 22% menor em coreanos, em comparação com brancos (corrigido pelo peso corporal). Os dados de indivíduos negros foram muito limitados, mas mantiveram-se na mesma faixa dos brancos.
Insuficiência hepática
Em um estudo dedicado de fase I de dose única e comparado com indivíduos saudáveis, a exposição ao nintedanibe com base na Cmáx e ASC foi 2,2 vezes maior em voluntários com insuficiência hepática leve (Child-Pugh A; IC de 90% 1,3-3,7 para Cmáx e 1,2-3,8 para a ASC, respectivamente). Em voluntários com insuficiência hepática moderada (Child-Pugh B), a exposição foi 7,6 vezes maior com base na Cmáx (IC de 90% 4,4-13,2) e 8,7 vezes maior (IC de 90% 5,7-13,1) com base na ASC, respectivamente, em comparação com voluntários saudáveis. Pacientes com insuficiência hepática grave (Child-Pugh C) não foram estudados.
Cuidados de Armazenamento
Conservar sob refrigeração (temperatura entre 2 °C e 8 °C) e proteger da umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Apresentação
As cápsulas moles de Ofev100 mg são de cor pêssego e as de 150 mg são de cor marrom. Ambas são opacas, oblongas (ovais), contendo uma suspensão viscosa amarelo brilhante. São marcadas com o símbolo da empresa Boehringer Ingelheim em preto e identificadas quanto à concentração.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Venda sob prescrição médica.
MS 1.0367.0173
Farm. Resp.:
Dímitra Apostolopoulou – CRF-SP 08828
Importado por:
Boehringer Ingelheim do Brasil Quím. e Farm. Ltda.
Rod. Régis Bittencourt, km 286
Itapecerica da Serra – SP
CNPJ 60.831.658/0021-10
SAC 0800-7016633
Fabricado por:
Catalent Germany Eberbach GmbH Eberbach - Alemanha
Embalado por:
Boehringer Ingelheim Pharma GmbH & Co. KG
Ingelheim am Rhein - Alemanha