Comparamos o preço de Puregon Pen 300Ui Cartucho C 1 Carpule De 0,480Ml E 6 Agulha, veja o menor preço

R$ 916,15
RReferência
7
ofertasMelhores preços a partir de R$ 916,15 até R$ 1.400,00
Menor preço
vendido por Pague Menos
economize
34.56%
R$ 916,15
vendido por Life Medicamentos
economize
17.81%
R$ 1.150,70
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farma Visa
economize
17.81%
R$ 1.150,70
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
vendido por Imune Farma Medicamentos Especiais
economize
17.80%
R$ 1.150,80
vendido por Farma Ame
economize
17.80%
R$ 1.150,85
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farma Silva
economize
15.25%
R$ 1.186,56
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
vendido por Saúde Farma Medicamentos
R$ 1.400,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria!
Para que serve
Puregon é indicado para tratar a infertilidade em quaisquer das seguintes situações:
- Em mulheres que não estão ovulando, Puregon pode ser utilizado para proporcionar a ovulação naquelas que não responderam ao tratamento com citrato de clomifeno;
- Em mulheres que se submeterem às técnicas de reprodução assistida, incluindo a fertilização in vitro (FIV) e outros métodos, Puregon pode ser utilizado para desenvolver múltiplos folículos;
- Nos homens que não são férteis devido a uma deficiência hormonal, Puregon pode ser utilizado para a produção do esperma.
Como o Puregon funciona?
Puregon contém o hormônio betafolitropina, conhecido como hormônio folículo estimulante (FSH). O FSH pertence ao grupo das gonadotropinas que desempenha um papel importante na fertilidade e reprodução humanas. O FSH na mulher é necessário para o crescimento e desenvolvimento dos folículos nos ovários. Os folículos são pequenas bolsas que contêm os óvulos. No homem, o FSH é necessário para a produção do esperma.
Contraindicação
Este medicamento é contraindicado para uso por pessoas com:
- Alergia (hipersensibilidade) à betafolitropina ou a quaisquer dos excipientes;
- Tumores de ovário, mama, útero, testículos ou cérebro (hipófise ou hipotálamo);
- Sangramento vaginal intenso ou irregular de causa desconhecida;
- Insuficiência primária do ovário Puregon;
- Cistos ovarianos ou ovários aumentados, não relacionados com síndrome de ovários policísticos;
- Malformações dos órgãos reprodutivos incompatíveis com uma gravidez normal;
- Miomas uterinos incompatíveis com uma gravidez normal;
- Insuficiência primária dos testículos.
Este medicamento é contraindicado para uso por mulheres grávidas ou que suspeitam que possam estar.
Como usar
Cuidados de administração
As injeções iniciais de Puregon devem ser aplicadas apenas sob supervisão médica.
As injeções são administradas lentamente em um músculo (por exemplo, nas nádegas ou na parte superior da perna ou do braço) ou sob a pele (na parede abdominal, por exemplo).
Injeções intramusculares devem apenas ser administradas por médicos ou enfermeiros.
Injeções sob a pele (subcutâneas), em alguns casos, podem ser aplicadas por você mesma(o) ou seu(sua) parceiro(a).
Seu médico a(o) orientará quando isso puder ser feito.
Quando as instruções forem seguidas corretamente, Puregon poderá ser administrado apropriadamente e com desconforto mínimo.
Instruções de uso
Preparação da seringa
Devem ser usadas seringas e agulhas estéreis descartáveis para a administração de Puregon. O volume da seringa deve ser o menor possível para que a dose prescrita possa ser administrada com precisão razoável. Puregon solução para injeção é apresentado em frasco-ampola de vidro. Não use a solução se ela contiver partículas ou se não estiver límpida.
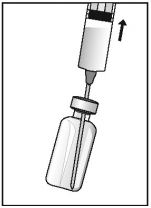
- Primeiramente remova a tampa externa do frasco-ampola. Adapte a agulha na seringa e a insira através da rolha de borracha do frasco-ampola.

- Aspire a solução na seringa.
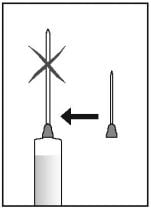
- Substitua a agulha por outra apropriada para a injeção.
- Finalmente aponte a agulha da seringa para cima e bata delicadamente com os dedos na seringa para forçar a saída das bolhas de ar. Pressione o êmbolo até que todo o ar seja expelido e apenas a solução de Puregon permaneça na seringa.
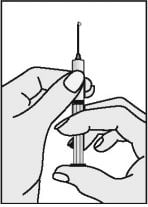
Se necessário, o êmbolo pode ser mais pressionado para ajustar o volume a ser administrado.
Local da injeção
- O melhor local para injeção subcutânea é o abdome, em torno do umbigo.

Onde há pele em excesso e camada de tecido adiposo. O local da injeção deve ser mudado a cada aplicação. É possível aplicar Puregon em outras áreas; o médico ou enfermeiro informará quais são os locais adequados.
Preparação da área
Estimule as extremidades nervosas com batidas suaves no local da injeção, para auxiliar na redução do desconforto à penetração da agulha. Lave as mãos e limpe o local da aplicação com algodão embebido em antisséptico (por exemplo, clorexidina 0,5%) para eliminar qualquer bactéria na superfície. Limpe cerca de 5 cm em torno do ponto de aplicação e deixe o antisséptico secar por pelo menos um minuto antes da administração.
Inserção da agulha
- Pince a pele entre os dedos (polegar e indicador) e, com a outra mão, insira a agulha a um ângulo de 90o em relação à superfície da pele.
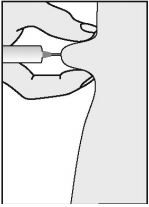
Verificação da posição correta da agulha
Se a agulha estiver na posição correta, deve haver certa dificuldade ao puxar o êmbolo. Se houver sangue na seringa, significa que a agulha penetrou em uma veia ou artéria. Se isso ocorrer, retire a seringa do local de injeção, cubra-o com algodão embebido em antisséptico e exerça pressão; o sangramento cessará em 1 a 2 minutos. Não use essa solução, você deve descartá-la. Inicie novamente pelo item 1, usando uma nova agulha e seringa e um novo frasco-ampola de Puregon.
Injetando a solução
Pressione o êmbolo vagarosamente e de forma constante de modo que a solução seja corretamente injetada e os tecidos da pele não sejam danificados.
Retirada da seringa
Retire rapidamente a seringa e exerça pressão no local de injeção com algodão contendo antisséptico. Massageie suavemente o local – ao mesmo tempo em que mantém a pressão – para auxiliar a dispersão da solução de Puregon e aliviar o desconforto. Descarte qualquer quantidade de solução que tenha sobrado após o uso único. Puregon não pode ser misturado com outro medicamento.
Posologia Puregon frasco-ampola para mulheres
Sempre utilize Puregon exatamente conforme instruído pelo seu médico. Caso você não esteja seguro, verifique com o seu médico ou farmacêutico.
O seu médico decidirá sobre a dose de Puregon que deve ser utilizada no seu caso, que poderá ser ajustada à medida que o tratamento prosseguir. Maiores detalhes sobre o esquema de tratamento são fornecidos a seguir. Há grandes diferenças entre as mulheres com relação à resposta dos ovários ao FSH, que tornam impossível estabelecer um esquema de doses padronizado que possa ser utilizado em todas as pacientes. Para encontrar a dose correta, o crescimento do folículo é verificado pela ultrassonografia e dosagem da quantidade de estradiol (hormônio sexual feminino) no sangue.
Mulheres que não estão ovulando
Inicialmente a dose é definida pelo seu médico e será mantida por, pelo menos, 7 dias. Se não houver resposta ovariana, a dose diária será aumentada gradativamente, até que o crescimento do folículo e/ou as concentrações plasmáticas de estradiol indiquem que há resposta adequada. A dose diária, então, é mantida até que um folículo de tamanho adequado esteja presente. Geralmente, 7 a 14 dias de tratamento são suficientes. A administração de Puregon é, então, interrompida e a ovulação pode ser induzida pela administração de gonadotropina coriônica humana (hCG).
Programas de reprodução assistida [por exemplo, fertilização in vitro (FIV)]
A dose inicial é definida pelo seu médico e será mantida durante pelo menos os quatro primeiros dias. Depois disso, a dose pode ser ajustada para a paciente individualmente, com base em sua resposta ovariana. Quando um número suficiente de folículos de tamanho adequado estiver presente, a fase final de maturação dos folículos é induzida pela administração de hCG. A retirada do ovo (oócito) é realizada depois de 34 a 35 horas.
Posologia Puregon frasco-ampola para homens
Puregon é geralmente prescrito na dose de 450 UI/semana, mais frequentemente em 3 administrações de 150 UI, em combinação com outro hormônio (hCG) por pelo menos 3 a 4 meses. Se não houver resposta após esse período, o tratamento pode ser prolongado por pelo menos 18 meses.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Como usar o Puregon Carpules
As injeções iniciais de Puregon devem ser aplicadas apenas sob supervisão médica.
Puregon solução injetável em carpules foi desenvolvido para ser utilizado em conjunto com a caneta injetora Puregon Pen. Siga cuidadosamente as instruções de uso que acompanham Puregon Pen.
Não utilize a carpule se a solução contiver partículas ou não estiver límpida.
Utilizando a caneta Puregon Pen, as injeções sob a pele (na parede abdominal, por exemplo) podem ser aplicadas por você mesma(o) ou seu(sua) parceiro(a). Seu médico a(o) orientará quando isso puder ser feito. Quando as instruções forem seguidas corretamente, Puregon poderá ser administrado apropriadamente e com desconforto mínimo.
Posologia Puregon Carpules
Sempre utilize Puregon exatamente conforme instruído pelo seu médico. Caso você não esteja seguro, verifique com o seu médico ou farmacêutico.
Posologia Puregon Carpules para mulheres
O seu médico decidirá sobre a dose de Puregon que deve ser utilizada no seu caso, que poderá ser ajustada à medida que o tratamento prosseguir. Maiores detalhes sobre o esquema de tratamento são fornecidos a seguir. Há grandes diferenças entre as mulheres com relação à resposta dos ovários ao FSH, que tornam impossível estabelecer um esquema de doses padronizado que possa ser utilizado em todas as pacientes. Para encontrar a dose correta, o crescimento do folículo é verificado pela ultrassonografia e dosagem da quantidade de estradiol (hormônio sexual feminino) no sangue.
Mulheres que não estão ovulando
Inicialmente a dose é definida pelo seu médico e será mantida por, pelo menos, 7 dias. Se não houver resposta ovariana, a dose diária será aumentada gradativamente, até que o crescimento do folículo e/ou as concentrações plasmáticas de estradiol indiquem que há resposta adequada. A dose diária, então, é mantida até que um folículo de tamanho adequado esteja presente. Geralmente, 7 a 14 dias de tratamento são suficientes. A administração de Puregon é, então, interrompida e a ovulação pode ser induzida pela administração de gonadotropina coriônica humana (hCG).
Programas de reprodução assistida [por exemplo, fertilização in vitro (FIV)]
A dose inicial é definida pelo seu médico e será mantida durante pelo menos os quatro primeiros dias. Depois disso, a dose pode ser ajustada para a paciente individualmente, com base em sua resposta ovariana. Quando um número suficiente de folículos de tamanho adequado estiver presente, a fase final de maturação dos folículos é induzida pela administração de hCG. A retirada do ovo (oócito) é realizada depois de 34 a 35 horas.
Posologia Puregon Carpules para homens
Puregon é geralmente prescrito na dose de 450UI/semana, mais frequentemente em 3 administrações de 150UI, em combinação com outro hormônio (hCG) por pelo menos 3 a 4 meses. Se não houver resposta após esse período, o tratamento pode ser prolongado por pelo menos 18 meses.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu em esquecer de usar o Puregon?
Se você se esquecer de administrar Puregon, não use uma dose dupla para compensar a dose esquecida.
Informe ao seu médico que você se esqueceu de tomar a injeção.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Informe ao seu médico se você:
- Já apresentou reação alérgica à neomicina e/ou à estreptomicina (antibióticos);
- Apresenta glândula pituitária descontrolada ou problemas no hipotálamo;
- Apresenta hipoatividade da glândula tireóide (hipotireoidismo);
- Apresenta glândulas adrenais que não funcionam apropriadamente (insuficiência adrenocortical);
- Apresenta alta concentração de prolactina no sangue (hiperprolactinemia);
- Apresenta qualquer outra condição médica (por exemplo diabetes, doença cardíaca ou qualquer outra doença de longa data).
Em mulheres
É muito importante a supervisão médica rigorosa. Geralmente, em intervalos regulares, são realizadas ultrassonografias dos ovários. Seu médico poderá checar as concentrações de hormônio no sangue. Os resultados desses exames permitem que seu médico escolha a dose correta de Puregon a ser administrada durante todo o tratamento. Isso é muito importante, pois doses muito elevadas de FSH podem ocasionar complicações raras, mas graves, nas quais os ovários são excessivamente estimulados e os folículos em crescimento tornam-se maiores que os normais. Esta condição médica grave é chamada de síndrome de hiperestimulação ovariana (SHEO). Em casos raros, a SHEO grave pode representar risco à vida. SHEO causa acúmulo repentino de fluído na área do estômago e tórax e pode causar a formação de coágulos de sangue. Procure seu médico imediatamente se você notar inchaço abdominal, dor na área do estômago (abdome), mal-estar geral (náusea), vômito, ganho de peso repentino devido ao acúmulo de fluído, diarreia, diminuição da produção de urina ou dificuldade para respirar. A monitoração regular da resposta ao tratamento com FSH auxilia o seu médico a prevenir a hiperestimulação ovariana. Portanto, contate-o imediatamente se apresentar dor estomacal significativa, mesmo que ela ocorra alguns dias depois que a última injeção tiver sido administrada.
Torção ovariana tem ocorrido após o tratamento com gonadotropinas, incluindo Puregon.
Torção ovariana é uma torção do ovário que pode reduzir o fluxo sanguíneo para o ovário até interrompê-lo.
Antes de usar este medicamento, é importante informar seu médico se você:
- Já teve síndrome de hiperestimulação ovariana (SHEO);
- Está grávida ou suspeita que possa estar grávida;
- Já fez cirurgia do estômago (abdominal);
- Já teve torção no ovário;
- Teve ou têm cistos em um dos seus ovários ou nos dois.
O tratamento com Puregon (assim como a própria gravidez) pode aumentar o risco de trombose, que é a formação de coágulo em um vaso sanguíneo.
Coágulo de sangue pode levar a uma condição médica grave, como:
- Bloqueio de seus pulmões (embolia pulmonar);
- Derrame;
- Ataque cardíaco;
- Problemas de vaso sanguíneo (tromboflebite);
- Uma falta de fluxo de sangue (trombose de veia profunda) que pode resultar em uma perda de seu braço ou perna.
Converse com o seu médico antes de iniciar o tratamento, especialmente se:
- Souber que apresenta maior risco de trombose;
- Você ou algum membro de sua família tem ou teve trombose;
- Estiver com o peso muito acima do normal.
Após tratamento com preparações de gonadotropina, existe uma chance aumentada de gestações múltiplas, mesmo quando apenas um embrião é transferido para o útero. As gestações múltiplas implicam em um aumento do risco para a saúde da mãe e dos seus bebês no momento do parto. Além disso, gestações múltiplas e características dos pacientes submetidos a tratamento de fertilidade (por exemplo, idade da mãe, características do esperma, formação genética de ambos os pais) podem estar associadas com um aumento no risco de defeitos de nascimento.
Há um pequeno aumento de risco de uma gravidez fora do útero (gravidez ectópica). Portanto, seu médico deverá realizar um exame ultrassonográfico precoce para excluir a possibilidade de gravidez fora do útero.
Há relatos de tumores de ovário e de outros do sistema reprodutor em mulheres que fizeram tratamento para infertilidade. Não é conhecido se o tratamento com medicamentos para fertilidade aumenta o risco desses tumores em mulheres inférteis.
Outras condições médicas
Além disso, antes de iniciar o uso deste medicamento, informe o seu médico se algum médico disse que a gravidez poderia ser perigosa para você.
Em homens
Concentrações elevadas de FSH no sangue são indicativas de dano testicular. Puregon geralmente não é eficaz nesses casos. Para monitorar o tratamento, o seu médico pode solicitar uma análise do sêmen cerca de 4 a 6 meses após o início do tratamento.
Atenção diabéticos: contém açúcar.
Este medicamento pode causar doping.
Reações Adversas
Assim como todos os medicamentos, Puregon pode causar reações indesejáveis, embora nem todas as pessoas as apresentem.
Em mulheres
Uma complicação decorrente do tratamento com FSH é a hiperestimulação indesejada dos ovários. A hiperestimulação ovariana pode desenvolver uma condição médica chamada Síndrome de Hiperestimulação Ovariana (SHEO), que pode ser um problema médico grave. O risco pode ser reduzido pela monitoração cuidadosa do desenvolvimento dos folículos durante o tratamento. Seu médico irá fazer uma ultrassonografia de seus ovários para monitorar cuidadosamente o número de folículos maduros. Ele poderá também checar as concentrações de hormônio no sangue.
Os primeiros sintomas de hiperestimulação ovariana podem ser notados por dor no estômago (abdome), mal-estar geral ou diarreia. Em casos mais graves, os sintomas podem incluir aumento dos ovários, acúmulo de líquido no abdome e/ou tórax (que pode causar ganho de peso repentino devido ao acúmulo de fluído) e a ocorrência de coágulos na circulação. Contate o seu médico imediatamente se você apresentar quaisquer desses sintomas, mesmo que eles ocorram alguns dias depois da administração da última injeção.
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Dor de cabeça;
- Reações no local da injeção (tais como hematoma, dor, vermelhidão, inchaço e coceira);
- Síndrome de hiperestimulação ovariana (SHEO);
- Dor pélvica;
- Dor estomacal e/ou inchaço.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Queixas mamárias (incluindo sensibilidade);
- Diarreia, constipação ou desconforto estomacal;
- Aumento do tamanho do útero;
- Mal-estar geral;
- Reações de hipersensibilidade (tais como erupção cutânea, vermelhidão, urticária e coceira);
- Cistos ovarianos ou aumento do tamanho dos ovários;
- Torção ovariana (torção nos ovários);
- Sangramento vaginal.
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
Coágulos sanguíneos (isto também pode ocorrer na ausência de hiperestimulação indesejada dos ovários.
Gravidez fora do útero (gravidez ectópica), aborto e gestações múltiplas têm sido relatados. Essas reações adversas não são consideradas relacionadas com o uso de Puregon, mas à Técnica de Reprodução Assistida (TRA) ou gravidez subsequente.
Em homens
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Acne;
- Endurecimento no local de injeção;
- Dor de cabeça;
- Erupção cutânea;
- Desenvolvimento de mamas;
- Cisto nos testículos.
Se alguma das reações adversas se tornar grave ou se você notar qualquer reação não mencionada nesta bula, informe ao seu médico ou farmacêutico.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
População Especial
Gravidez e lactação
Peça orientação ao seu médico ou farmacêutico antes de usar qualquer medicamento. Você não deve usar Puregon se estiver grávida ou suspeitar que possa estar grávida.
Se estiver amamentando, informe seu médico antes de usar Puregon.
Efeitos sobre a habilidade de dirigir e operar máquinas
Não foram observados efeitos sobre a habilidade de dirigir veículos e operar máquinas.
Composição
Composição Puregon Frasco-ampola
Cada frasco-ampola contém:
50UI de betafolitropina.
Excipientes: sacarose, citrato de sódio di-hidratado, metionina, polissorbato 20, ácido clorídrico e/ou hidróxido de sódio (para ajuste de pH) e água para injetáveis.
Cada frasco-ampola contém:
100UI de betafolitropina.
Excipientes: sacarose, citrato de sódio di-hidratado, metionina, polissorbato 20, ácido clorídrico e/ou hidróxido de sódio (para ajuste de pH) e água para injetáveis.
Isso corresponde a 100 ou 200UI/mL. Uma ampola contém 5 ou 10mcg de proteína (bioatividade específica in vivo igual a aproximadamente 10.000UI de FSH/mg de proteína).
Composição Puregon Carpule
A solução para injeção contém 833UI de betafolitropina por mL de solução aquosa.
Cada carpule contém:
400UI (300UI utilizáveis) de betafolitropina.
Excipientes: sacarose, citrato de sódio di-hidratado, polissorbato 20, álcool benzílico, metionina, ácido clorídrico e/ou hidróxido de sódio (para ajuste de pH) e água para injetáveis.
Cada carpule contém:
700UI (600UI utilizáveis) de betafolitropina.
Excipientes: sacarose, citrato de sódio di-hidratado, polissorbato 20, álcool benzílico, metionina, ácido clorídrico e/ou hidróxido de sódio (para ajuste de pH) e água para injetáveis.
Superdosagem
Informe ao seu médico imediatamente. Doses muito elevadas podem causar síndrome de hiperestimulação dos ovários (SHEO).
Os primeiros sintomas de hiperestimulação ovariana podem ser:
Dor abdominal, mal-estar geral ou diarreia.
Em casos mais graves, os sintomas podem incluir aumento dos ovários, acúmulo de líquido no abdome e/ou tórax, aumento de peso e ocorrência de coágulos na circulação.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
O uso concomitante de Betafolitropina (substância ativa) e citrato de clomifeno pode aumentar a resposta folicular.
Após a dessensibilização hipofisária induzida por um agonista do GnRH, pode ser necessária uma dose maior de Betafolitropina (substância ativa) para produzir uma resposta folicular adequada.
Esse produto não deve ser misturado a outros medicamentos, uma vez que não há estudos de compatibilidade.
Ação da Substância
Resultados de Eficácia
Mulheres
A eficácia de Betafolitropina foi estabelecida em quatro estudos clínicos controlados [três estudos para Técnicas de Reprodução Assistida (TRA) e um estudo para a Indução da Ovulação], três dos quais estão descritos a seguir. Nesses estudos comparativos, não houve diferenças clinicamente significativas entre os grupos de tratamento nos resultados do estudo.
Técnica de Reprodução Assistida (TRA)
Betafolitropina foi avaliado em um estudo de segurança e eficácia, randomizado, cego, com grupo comparativo, multicêntrico (estudo no. 37608) em 981 mulheres inférteis tratadas durante um ciclo para fertilização in vitro com Betafolitropina ou urofolitropina após a supressão hipofisária com um agonista do GnRH.
Os resultados com Betafolitropina são resumidos na tabela a seguir.
Resultados de um estudo de eficácia e segurança, randomizado, cego, com grupo comparativo, multicêntrico (estudo nº. 37608) de Betafolitropina (substância ativa) em mulheres inférteis tratadas para fertilização in vitro após a supressão hipofisária com agonista de GnRH
| Parâmetro |
Betafolitropina (substância ativa) (n=585) |
|
Quantidade total de oócitos recuperados | 10,9 |
|
Taxa de gravidez† por tentativa‡ | 22,2% |
|
Taxa de gravidez† por transferência‡, § | 26,0% |
*Todos os valores são médias.
† Foi considerada gravidez com feto único ou múltipla gestação quando confirmada pelo investigador após, no mínimo 12 semanas da transferência de embriões (TE).
‡ O estudo não tinha poder para demonstrar esses pontos de avaliação (endpoints) secundários.
§ Transferências foram limitadas a um máximo de três embriões.
Resultados de um estudo de eficácia e segurança, randomizado, cego, com grupo comparativo, multicêntrico (estudo no. 37608) de Betafolitropina em mulheres inférteis tratadas para fertilização in vitro após a supressão hipofisária com agonista de GnRH*.
Betafolitropina (substância ativa) foi também avaliado em um estudo de segurança e eficácia, randomizado, cego, com grupo comparativo, monocêntrico (estudo no. 37604) em 89 mulheres inférteis tratadas com Betafolitropina ou menotropinas para fertilização in vitro, sem supressão hipofisária com agonista do GnRH.
Os resultados com Betafolitropina são resumidos na tabela a seguir.
Resultados de um estudo de eficácia e segurança, randomizado, cego, com grupo comparativo, monocêntrico (estudo nº. 37604) de Betafolitropina (substância ativa) em mulheres inférteis tratadas para fertilização in vitro sem supressão hipofisária*
|
Parâmetro |
Betafolitropina (substância ativa) (n=54) |
|
Quantidade total de oócitos recuperados | 9,9 |
|
Taxa de gravidez† por tentativa‡ | 22,2% |
|
Taxa de gravidez† por transferência‡, § | 30,8% |
* Todos os valores são médias.
† Foi considerada gravidez com feto único ou múltipla gestação quando confirmada pelo investigador após, no mínimo 12 semanas da transferência de embriões (TE).
‡ O estudo não tinha poder para demonstrar esses pontos de avaliação (endpoints) secundários. § Transferências foram limitadas a um máximo de três embriões.
Indução da ovulação
Resultados de um estudo de segurança e eficácia, randomizado, cego, com grupo comparativo, multicêntrico (estudo nº. 37609) de Betafolitropina (substância ativa) em 172 mulheres com anovulação crônica, que falharam em ovular e/ou conceber durante tratamento com citrato de clomifeno são resumidos nas duas tabelas apresentadas abaixo.
Taxas cumulativas de ovulação (estudo nº. 37609)
| Ciclo |
Betafolitropina (substância ativa) (n=105) |
|
Primeiro ciclo de tratamento | 72% |
|
Segundo ciclo de tratamento | 82% |
|
Terceiro ciclo de tratamento | 85% |
† Taxas cumulativas de gravidez* (estudo nº. 37609)
| Ciclo |
Betafolitropina (substância ativa) (n=105) |
|
Primeiro ciclo de tratamento | 14% |
|
Segundo ciclo de tratamento | 19% |
|
Terceiro ciclo de tratamento | 23% |
*Todas as gestações foram confirmadas após, no mínimo, 12 semanas após a injeção de hCG.
† O estudo não tinha o poder para demonstrar esse resultado.
Homens
A segurança e eficácia Betafolitropina (substância ativa) administrado por injeção subcutânea concomitantemente com gonadotropina coriônica humana (hCG) foram examinadas em um estudo clínico (estudo nº. 37618) para indução de espermatogênese em homens com hipogonadismo hipogonadotrófico.
O estudo comparou efeitos de dois esquemas de dosagem diferentes de Betafolitropina (substância ativa)/hCG sobre parâmetros do sêmen, concentrações séricas do hormônio folículo estimulante (FSH) e hCG, e avaliou a tolerância local da via de administração subcutânea (SC) de Betafolitropina (substância ativa) e hCG. O estudo multicêntrico envolveu uma fase de pré-tratamento de dezesseis semanas com hCG em uma dosagem de 1.500 UI, duas vezes por semana para normalizar as concentrações séricas de testosterona. Em caso de resposta insuficiente após oito semanas de tratamento (concentrações de testosterona ainda abaixo da variação de tolerância inferior), a dose pôde ser aumentada para 3.000 UI duas vezes por semana.
Essa fase foi seguida por um período de tratamento de 48 semanas. Os pacientes que ainda eram azoospérmicos após a fase de pré-tratamento foram randomizados para receber 225 UI de Betafolitropina (substância ativa) juntamente com 1.500 UI de hCG duas vezes por semana ou 150 UI de Betafolitropina (substância ativa) três vezes por semana juntamente com 1.500 UI de hCG duas vezes por semana.
Os pacientes que necessitaram de 3.000 UI de hCG duas vezes por semana na fase de pré-tratamento continuaram nessa dosagem durante a fase de tratamento. A média etária dos pacientes no grupo que recebeu três injeções semanais de Betafolitropina (substância ativa) foi 30,7 (faixa de 18 a 47) anos. No grupo que recebeu duas injeções semanais de Betafolitropina (substância ativa), a média etária foi de 30,1 (faixa de 19 a 40) anos. No início de estudo, os volumes médios de testículo esquerdo e direito foram de 4,61 ± 2,94 mL e 4,57 ± 3,00 mL, respectivamente no grupo que recebeu três injeções semanais de Betafolitropina (substância ativa).
Para o grupo que recebeu duas injeções semanais de Betafolitropina (substância ativa), os volumes médios de testículo esquerdo e direito foram de 6,54 ± 2,45 mL e 7,21 ± 2,94 mL, respectivamente, no início de estudo. O ponto primário de avaliação da eficácia (endpoint) foi a percentagem de pacientes com densidade espermática média de ? 1 x 106 /mL em suas últimas duas avaliações do tratamento.
Os resultados do tratamento nos 30 homens inscritos na fase de tratamento são resumidos na tabela a seguir.
Número de homens recebendo Betafolitropina (substância ativa) que atingiram densidade espermática média de ? 106 /mL nas suas últimas duas avaliações do tratamento (estudo nº. 37618)
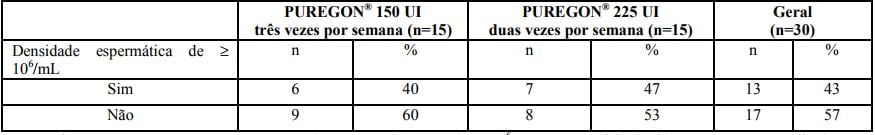
Em pacientes que apresentaram concentração de esperma de, no mínimo, 106 por mL, esta foi atingida em um tempo médio de 165 dias após iniciar o Betafolitropina (substância ativa), variando de 25 a 327 dias. Para o grupo de dose de 150 UI, o tempo médio para atingir concentração de esperma de, no mínimo, 106 por mL foi de 186 dias, variando de 25 a 327 dias. O tempo médio antes desta ter sido atingida no grupo de dose de 225 UI foi de 141 dias, variando de 43 a 204 dias. Nenhum dado de gravidez foi coletado durante o estudo.
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Gonadotropinas.
Código ATC: G03G A06.
Betafolitropina (substância ativa) contém FSH (hormônio folículo estimulante) recombinante (FSHr) produzido pela técnica de DNA recombinante, usando-se uma linhagem de células de ovário de hamster chinês transfectada com subunidades de genes de FSH humano. A sequência primária de aminoácidos é idêntica à do FSH humano natural. Existem pequenas diferenças na estrutura da cadeia de carboidratos.
O FSH é indispensável para o crescimento e maturação folicular normais e para a produção de esteroides gonadais. Na mulher, a quantidade de FSH é determinante para o início e duração do desenvolvimento folicular e, consequentemente, para o tempo de amadurecimento e número de folículos que atingem a maturidade. Portanto, Betafolitropina (substância ativa) pode ser utilizado para estimular o desenvolvimento folicular e a produção de esteroides em casos selecionados de alterações da função gonadal.
Além disso, Betafolitropina (substância ativa) pode ser utilizado para promover o desenvolvimento folicular múltiplo em programas de reprodução assistida [por exemplo, fertilização in vitro/transferência de embriões (FIV/TE), transferência intratubária de gametas (GIFT) e injeção intracitoplasmática de espermatozoides (ICSI)]. O tratamento com Betafolitropina (substância ativa) é, geralmente, seguido pela administração de gonadotropina coriônica humana (hCG) para induzir a fase final da maturação folicular, retomada da meiose e ruptura do folículo.
Propriedades farmacocinéticas
Após a administração intramuscular ou subcutânea de Betafolitropina (substância ativa), as concentrações máximas de FSH são alcançadas em aproximadamente 12 horas. Após administração intramuscular de Betafolitropina (substância ativa), as concentrações máximas de FSH são mais elevadas e atingidas mais precocemente em homens do que em mulheres. Por causa da liberação prolongada a partir do local de administração e da meia-vida de eliminação de aproximadamente 40 horas (variando de 12 a 70 horas), as concentrações de FSH permanecem elevados durante 24 a 48 horas.
Devido à meia-vida de eliminação relativamente longa, após a administração repetida da mesma dose, as concentrações de FSH no plasma são aproximadamente 1,5 a 2,5 vezes maiores do que após a administração única. Esse aumento permite que sejam alcançadas concentrações terapêuticas de FSH.
Não existem diferenças farmacocinéticas significativas entre a administração subcutânea e intramuscular de Betafolitropina (substância ativa). Ambas têm biodisponibilidade absoluta de aproximadamente 77%. O FSH recombinante é bioquimicamente muito similar ao FSH urinário humano e é distribuído, metabolizado e excretado pelas mesmas vias.
Dados de segurança pré-clínicos
A administração de dose única de Betafolitropina (substância ativa) em ratos não induziu efeitos toxicológicos significativos. Em estudos de dose repetida em ratos (duas semanas) e cães (13 semanas) com até 100 vezes a dose terapêutica máxima humana, Betafolitropina (substância ativa) não induziu efeitos toxicológicos significativos. Betafolitropina (substância ativa) não apresentou potencial mutagênico no teste de Ames e em teste de aberração cromossômica in vitro com linfócitos humanos.
Cuidados de Armazenamento
Nas distribuidoras e farmácias Puregon deve ser conservado sob refrigeração (entre 2 e 8°C), protegido da luz. Não congelar.
Armazenamento pelo paciente: há duas opções:
- Armazenar o produto em geladeira (entre 2 e 8°C), sem congelar;
- Armazenar Puregon em ambiente com temperatura máxima de 25°C por um período de até 3 meses. Anote a data em que retirar o produto da geladeira. Mantenha o frasco-ampola em sua embalagem externa.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após aberto, este medicamento deve ser utilizado imediatamente após a perfuração da tampa de borracha do frasco-ampola.
Características físicas Puregon Frasco-ampola
Puregon é uma solução límpida e incolor, contida em um frasco-ampola de vidro.
Não use Puregon se você notar que a solução contém partículas ou se não estiver límpida.
Características físicas Puregon Carpules
A solução de Puregon é límpida e incolor. Em carpules, destina-se ao uso com uma caneta injetora Puregon Pen.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Descarte as agulhas imediatamente após a injeção.
Descarte as carpules usadas (incluindo o volume restante) após a última injeção do ciclo de tratamento.
Puregon solução em carpules não pode ser misturado com outros medicamentos nas carpules. As carpules vazias não podem ser recarregadas.
Medicamentos não devem ser descartados no lixo caseiro nem na água usada. Pergunte ao seu farmacêutico como jogar fora medicamentos que não podem mais ser usados. Essas medidas auxiliarão na proteção do meio ambiente.
Dizeres Legais
MS 1.0171.0081
Farm. Resp.:
Cristina Matushima
CRF-SP no 35.496
Fabricado e embalado por:
N. V. Organon, Oss, Holanda
Importado e registrado por:
Schering-Plough Indústria Farmacêutica Ltda. Rua João Alfredo, 353
São Paulo/SP
CNPJ 03.560.974/0001-18 – Brasil
Venda sob prescrição médica.