Comparamos o preço de Trulicity 1,5 Mg - Solução Injetável 2 Seringa Preenchida 0,5 Ml + 2 Can Aplicador, veja o menor preço

R$ 332,99
BBiológicos
4
ofertasMelhores preços a partir de R$ 332,99 até R$ 374,98
Menor preço
vendido por Pague Menos
economize
11.20%
R$ 332,99
vendido por Farmácia Indiana
economize
10.18%
R$ 336,80
vendido por promofarma
economize
3.55%
R$ 361,65
vendido por Drogaria Primus
R$ 374,98
Para que serve
Trulicity é indicado em monoterapia (terapia com medicamento único), como um adjuvante à dieta e ao exercício, para melhorar o controle da taxa de glicose (açúcar) no sangue em adultos com diabetes mellitus tipo 2 em que a metformina está contraindicada ou é considerada inadequada por intolerância.
Trulicity é indicado em terapia de associação, juntamente com dieta e exercício, quando nãohá um controle da taxa de glicose (açúcar) no sangue. Pode ser combinado aos seguintes medicamentos redutores de glicose: metformina, metformina e sulfonilureia, metformina e tiazolidinediona e também com insulina prandial (na hora das refeições), com ou sem metformina.
Como Trulicity funciona?
Trulicity melhora o controle da glicemia (quantidade de açúcar no sangue) reduzindo a quantidade de glicose (açúcar) de jejum, pré-prandial (pré-refeição) e pós-prandial (pós-refeição) através:
- Da liberação de insulina na presença de alta quantidade de glicose;
- Da redução da quantidade de glucagon (hormônio responsável por aumentar a taxa de açúcar no sangue);
- Do atraso do esvaziamento do estômago.
A melhora no controle da taxa de glicose começa após a primeira administração de Trulicity e é mantida durante uma semana, até sua próxima aplicação.
Contraindicação
Não utilize Trulicity caso seja alérgico à dulaglutida ou a qualquer um dos componentes da fórmula.
Não utilize Trulicity caso tenha histórico pessoal ou familiar de Carcinoma Medular de Tireoide (tumor maligno da tireoide), ou seja portador de Neoplasia Endócrina Múltipla (dois ou mais tumores benignos ou malignos, envolvendo glândulas endócrinas).
Como usar
Monoterapia:
A dose inicial recomendada é de 0,75 mg uma vez por semana. A dose pode ser aumentada para 1,5 mg uma vez por semana nos casos em que seja necessário controle da taxa de glicose (açúcar) adicional.
Terapia de associação:
A dose recomendada é de 1,5 mg uma vez por semana.
Você deve utilizar Trulicity uma vez por semana, a qualquer hora do dia, independente das refeições. A dose máxima recomendada é de 1,5 mg por semana.
Administrar Trulicity por via subcutânea (embaixo da pele) e sem diluição. Você pode aplicar Trulicity no abdome, coxa ou parte superior do braço.
Para maiores informações sobre como utilizar a caneta de uso único, ler e seguir atentamente as recomendações descritas nas Instruções de uso que acompanham o produto.
Geralmente não é necessário ajuste de dose com base na idade, insuficiência renal ou hepática.
Quando Trulicity é adicionado à terapia com metformina e/ou pioglitazona, as doses de metformina e/ou pioglitazona podem ser mantidas. Quando é adicionado à terapia com uma sulfonilureia ou insulina prandial (na hora das refeições), pode-se considerar uma redução da dose da sulfonilureia ou da insulina para diminuir o risco de hipoglicemia.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Mudando seu esquema posológico semanal:
Você pode mudar o dia da administração semanal de Trulicity, se necessário, desde que você tenha aplicado a última dose há 3 dias ou mais.
O que devo fazer quando eu me esquecer de usar Trulicity?
Caso você se esqueça de utilizar Trulicity, você deve administrar o medicamento o quanto antes, se restarem no mínimo 3 dias (72 horas) até a próxima dose planejada. Se restarem menos de 3 dias para a próxima dose, a dose perdida deve ser pulada e você deve administrar a dose seguinte no dia marcado. Em ambos os casos, você pode reiniciar seu esquema posológico normal de uma dose por semana.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Trulicity não deve ser utilizado por pacientes que tenham diabetes mellitus tipo 1 ou para o tratamento de cetoacidose diabética (complicação do diabetes ocasionada por deficiência de insulina e caracterizada por aumento na glicose e de substâncias ácidas no sangue).
O uso de medicamentos da mesma classe de Trulicity, conhecidos como agonistas do receptor GLP-1, pode estar relacionado com a presença de reações adversas gastrointestinais. Não é recomendado que você utilize Trulicity caso tenha doença gastrointestinal grave (doença dos órgãos digestivos), incluindo gastroparesia grave (diminuição da velocidade da passagem de alimentos pelo estômago), pois Trulicity não foi estudado em pacientes com essas doenças.
Eventos de pancreatite (inflamação aguda do pâncreas) foram relatados após o uso de Trulicity e de medicamentos dessa mesma classe. Se houver suspeita de pancreatite, você deve descontinuar seu tratamento com Trulicity até que ocorra confirmação ou não do diagnóstico. Caso o diagnóstico seja confirmado, você deve descontinuar Trulicity permanentemente.
Trulicity está associado com aumentos na quantidade das enzimas do pâncreas, amilase e/ou lipase, em relação ao início do tratamento. Na ausência de sinais e sintomas de pancreatite aguda, os aumentos isolados das enzimas do pâncreas não prediz a ocorrência de pancreatite.
É desconhecido se Trulicity irá causar tumores de células C da tireoide em humanos. Caso você apresente nódulos na tireoide, observados durante exame físico ou imagem de pescoço, consulte um médico para uma avaliação adicional.
Caso você esteja grávida ou amamentando, somente utilizar Trulicity se o benefício do tratamento justificar o risco para o bebê.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
A segurança e o efeito de Trulicity não foram estabelecidos em pacientes com menos de 18 anos de idade.
Geralmente não é necessário ajuste de dose de Trulicity com base na idade, sexo, raça, etnia, peso corporal, insuficiência hepática ou renal. No entanto, para populações potencialmente vulneráveis, como por exemplo, pacientes com idade igual ou superior a 75 anos, pode-se considerar uma dose inicial de 0,75 mg. A experiência em pacientes com comprometimento renal grave ou em pacientes com doença renal em fase terminal é muito limitada, por tal motivo não é recomendada a utilização de Trulicity nesta população.
Se você estiver utilizando Trulicity junto com uma sulfonilureia ou insulina, tenha cuidado para evitar hipoglicemia enquanto você dirige ou opera máquinas.
Interações medicamentosas
Trulicity poderá afetar a ação dos medicamentos que são tomados por via oral, pois ele torna o esvaziamento do estômago mais lento.
Nos estudos clínicos, Trulicity não afetou a ação dos medicamentos orais que foram testados, como por exemplo, varfarina, metformina, lisinopril, metoprolol, digoxina, paracetamol, norelgestromina, etinilestradiol, sitagliptina e atorvastatina. Não é necessário realizar ajuste da dose dos medicamentos utilizados junto com Trulicity.
Nenhum estudo foi conduzido para investigar possível interação entre Trulicity e plantas medicinais, álcool, nicotina e realização de exames laboratoriais e não laboratoriais.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use este medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Durante os estudos clínicos que foram conduzidos com Trulicity, as seguintes reações adversas foram identificadas.
Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
Náusea (vontade de vomitar), diarreia (incluindo volume fecal aumentado e movimentos intestinais frequentes), vômito [incluindo ânsia (vontade de vomitar) e vômito em excesso], dor abdominal (incluindo desconforto abdominal, dor abdominal baixa e alta, abdominal e dor gastrointestinal), hipoglicemia (baixa quantidade de açúcar no sangue) quando utilizado com insulina prandial/secretagogos (medicamentos que aumentam a produção de insulina), junto com metformina mais glimepirida ou junto com insulina prandial (na hora das refeições) e hipoglicemia quando utilizado sem secretagogos e junto com metformina.
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Diminuição do apetite, dispepsia (indigestão), constipação (intestino preso) (incluindo volume fecal reduzido e movimentos intestinais infrequentes), flatulência (gases), distensão abdominal (distensão do abdome causada por excesso de gases), doença do refluxo gastroesofágico (retorno do alimento do estômago para o esôfago), eructação (arroto), fadiga (cansaço) [incluindo astenia (fraqueza) e mal-estar], taquicardia sinusal (aumento do batimento cardíaco), bloqueio atrioventricular de primeiro grau [a condução do impulso no coração (do átrio para o ventrículo) é atrasada e ocorre mais lentamente], hipoglicemia (baixa quantidade de açúcar no sangue) quando utilizado sem secretagogos, junto com metformina mais pioglitazona e como monoterapia.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
Reação no local da injeção [incluindo eritema (lesão avermelhada na pele), irritação, prurido (coceira), edema (inchaço) e erupção (lesões)].
Hipoglicemia:
Quando Trulicity foi utilizado junto a um não-secretagogo (medicamentos que não aumentam a produção de insulina), nenhum paciente apresentou hipoglicemia (baixa quantidade de açúcar no sangue) grave.
Quando Trulicity foi utilizado junto com uma sulfonilureia ou com uma insulina prandial (na hora das refeições), poucos pacientes apresentaram eventos de hipoglicemia grave.
Distúrbio gastrointestinal:
Os eventos gastrointestinais relatados (náusea, vômito e diarreia) foram de leves a moderados em gravidade. As duas primeiras semanas de tratamento com Trulicity apresentaram maior intensidade dos eventos adversos náusea, vômito e diarreia.
Esses eventos rapidamente diminuíram durante as 4 semanas seguintes de tratamento e ficaram constantes com o passar das semanas. A maioria dos eventos gastrointestinais ocorreu 2 a 3 dias após a dose inicial com diminuição nas doses subsequentes.
Reações no local da injeção:
Os eventos adversos causados no local da injeção [como por exemplo, erupção cutânea (feridas na pele) e eritema (lesão avermelhada na pele)] nos pacientes que fizeram uso de Trulicity foram geralmente leves e ocorreram em 0,7% dos pacientes que receberam dulaglutida.
Aumento na frequência cardíaca:
Trulicity pode causar pequenos aumentos na frequência cardíaca (aumento dos batimentos do coração).
Descontinuação devido a um evento adverso:
Nos estudos de Trulicity as reações adversas mais comuns que levaram o paciente a descontinuar o tratamento foram: náusea, vômito e diarreia. Essas reações foram geralmente informadas dentro das primeiras 4 a 6 semanas de tratamento.
Enzimas pancreáticas:
Trulicity está associado com aumentos na quantidade das enzimas do pâncreas, amilase e/ou lipase, em relação ao início do tratamento.
Hipersensibilidade:
Eventos de hipersensibilidade sistêmica, como por exemplo, urticária (reação da pele caracterizada por vermelhidão e coceira) e angioedema (coceira seguida de inchaço nas camadas mais profundas da pele) foram informados por 0,5% dos pacientes que receberam Trulicity.
Dados pós-comercialização
A reação adversa seguinte foi baseada em relatos de pós-comercialização.
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
Distúrbio do sistema imune:
Reação anafilática (reação alérgica grave generalizada/reação de hipersensibilidade imediata e sistêmica).
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
Composição
Cada 0,5 mL contém:
0,75 mg ou 1,5 mg de dulaglutida.
Excipientes: citrato trissódico di-hidratado, ácido cítrico anidro, manitol e polissorbato 80 em água para injeção.
Superdosagem
Os efeitos da superdose de Trulicity nos estudos clínicos do medicamento incluíram distúrbios gastrointestinais e hipoglicemia (baixa quantidade de açúcar no sangue). No caso de superdose, um tratamento de suporte adequado deve ser iniciado conforme os sinais e sintomas clínicos do paciente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Ligue para 0800 722 6001, se você precisar de maiores orientações.
Interação Medicamentosa
A dulaglutida causa um atraso no esvaziamento gástrico e, assim, tem o potencial de afetar a absorção de medicamentos orais administrados concomitantemente.
Nos estudos de farmacologia clínica, este medicamento não afetou a absorção dos medicamentos administrados por via oral testados em nenhum grau clinicamente relevante (como por exemplo, varfarina, metformina, lisinopril, metoprolol, digoxina, paracetamol, norelgestromina + etinilestradiol, sitagliptina e atorvastatina).
Nenhum ajuste na dose da medicação concomitante foi necessário.
Nenhum estudo foi conduzido para investigar possível interação entre este medicamento e plantas medicinais, nicotina e realização de exames laboratoriais e não laboratoriais.
Interação Alimentícia
Nenhum estudo foi conduzido para investigar possível interação entre este medicamento e álcool.
Ação da Substância
Resultados de Eficácia
Dulaglutida (substância ativa) foi estudado como monoterapia e em associação com metformina, metformina e sulfonilureia, metformina e tiazolidinediona e insulina prandial com ou sem metformina.
Os estudos avaliaram o uso de Dulaglutida (substância ativa) 0,75 mg e 1,5 mg.
Titulação não foi realizada em nenhum dos estudos; pacientes foram iniciados e mantidos em 0,75 mg ou 1,5 mg durante todo o período dos estudos.
Em pacientes com diabetes mellitus tipo 2, Dulaglutida (substância ativa) produziu reduções a partir do período inicial na HbA1c comparado ao placebo.
Não há diferenças globais na eficácia glicêmica observada entre os subgrupos demográficos (idade, sexo, raça/etnia, duração do diabetes).
Monoterapia
Em um estudo duplo-cego de 52 semanas (desfecho primário de 26 semanas), 807 pacientes tratados não adequadamente controlados, com dieta e exercícios, ou com dieta e exercícios e um agente antidiabético usado na dose submáxima, foram randomizados para Dulaglutida (substância ativa) 0,75 mg uma vez por semana, Dulaglutida (substância ativa) 1,5 mg uma vez por semana ou metformina 1.500-2.000 mg/dia após duas semanas sem medicação.
Setenta e cinco por cento (75%) da população randomizada estava em tratamento com um agente antidiabético na consulta de triagem.
A maioria dos pacientes previamente tratados com um agente antidiabético estavam recebendo metformina (~90%) a uma dose média diária de 1.000 mg e aproximadamente 10% estavam recebendo sulfonilureia.
Os pacientes tinham uma idade média de 56 anos e uma duração média do diabetes tipo 2 de 3 anos.
Quarenta e quatro por cento (44%) eram do sexo masculino. Brancos, negros e asiáticos representavam 74%, 7% e 8% da população racial, respectivamente.
Vinte e nove por cento (29%) da população do estudo eram dos Estados Unidos.
O tratamento com Dulaglutida (substância ativa) 0,75 mg e 1,5 mg uma vez por semana resultou na redução de HbA1c a partir do período inicial no momento da avaliação primária de 26 semanas (Tabela 1).
A diferença na magnitude do efeito observado entre Dulaglutida (substância ativa) 0,75 mg e 1,5 mg, respectivamente, e metformina neste estudo excluiu a margem de não inferioridade pré-especificada de 0,4%.
Tabela 1: Resultados da semana 26 em um estudo de Dulaglutida (substância ativa) como monoterapia a
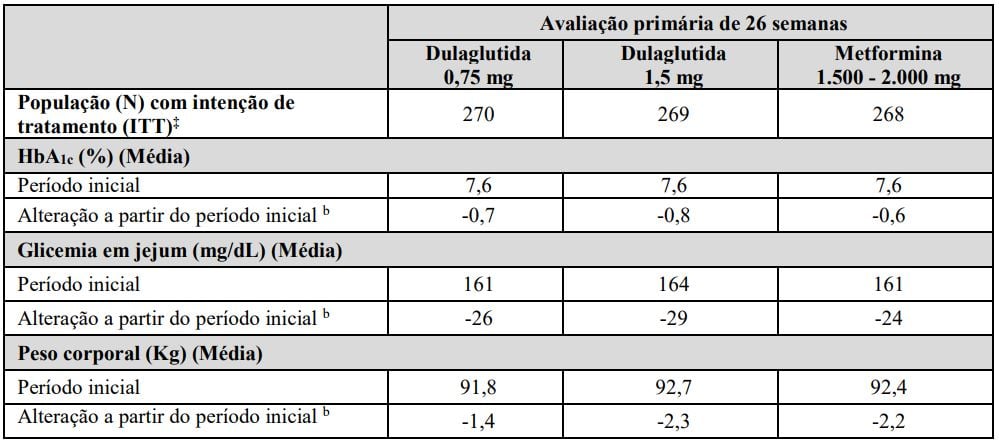
Abreviação: HbA1c = hemoglobina A1c.
aPopulação com intenção de tratamento. Última observação realizada (LOCF) foi utilizada para imputar os dados que faltavam. Dados pós-início da terapia de resgate são tratados como ausência. Na Semana 26, a eficácia primária estava ausente em 10%, 12% e 14% dos indivíduos randomizados para Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e metformina, respectivamente.
bMédia ajustada dos mínimos quadrados para o valor do período inicial e outros fatores de estratificação.
‡Indivíduos incluídos na análise é um subconjunto da população ITT que tiveram pelo menos uma avaliação após o período inicial. A análise primária incluiu 265 indivíduos em cada um dos braços de tratamento.
Terapia de associação
Adicionada à metformina
Neste estudo de 104 semanas, controlado por placebo, duplo-cego (desfecho primário de 52 semanas), 972 pacientes foram randomizados para placebo, Dulaglutida (substância ativa) 0,75 mg uma vez por semana, Dulaglutida (substância ativa) 1,5 mg uma vez por semana, ou sitagliptina 100 mg/dia (após 26 semanas, os pacientes no grupo de tratamento com placebo receberam sitagliptina 100 mg/dia, de forma cega, para o restante do estudo), todas adicionadas à metformina.
A randomização ocorreu após 11 semanas para permitir um período de estabilização glicêmica de 6 semanas após a titulação da metformina.
Os pacientes tinham uma idade média de 54 anos, duração média do diabetes tipo 2, de 7 anos, 48% do sexo masculino.
Brancos, negros e asiáticos representavam 53%, 4% e 27% da população racial, respectivamente e 24% da população estudada eram dos Estados Unidos.
Na semana 26 do estudo controlado por placebo, a mudança na HbA1c foi de 0,1%, -1,0%, -1,2% e -0,6% para placebo, Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e sitagliptina, respectivamente.
A porcentagem de pacientes que alcançaram HbA1c <7,0% foi de 22%, 56%, 62% e 39% para o placebo, Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e sitagliptina, respectivamente.
Nas 26 semanas, houve uma redução média de peso de 1,4 Kg, 2,7 Kg, 3,0 Kg e 1,4 Kg para placebo, Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e sitagliptina, respectivamente.
Houve uma redução média da glicemia de jejum de 9 mg/dL, 35 mg/dL, 41 mg/dL e 18 mg/dL para o placebo, Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e sitagliptina, respectivamente.
O tratamento com Dulaglutida (substância ativa) 0,75 mg e 1,5 mg uma vez por semana resultou em uma redução estatisticamente significativa na HbA1c em comparação ao placebo (com 26 semanas) e em comparação com sitagliptina (com 26 e 52 semanas), todos em combinação com metformina (Tabela 2 e Figura 1).
Tabela 2: Resultados do estudo de 52 semanas de Dulaglutida (substância ativa) comparado com sitagliptina, adicionadas à metforminaa
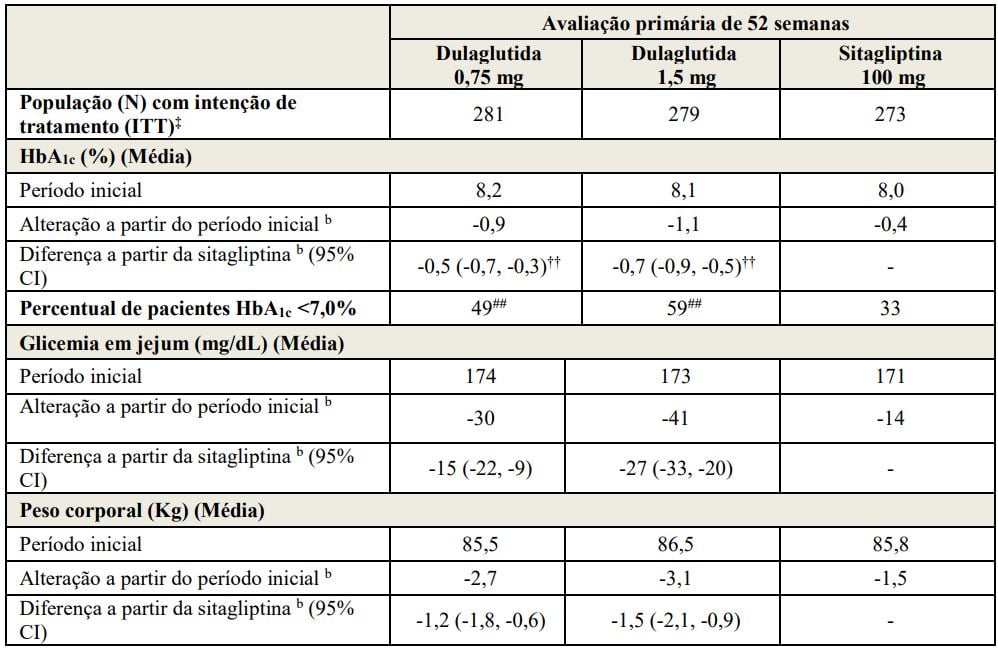
Abreviação: HbA1c = hemoglobina A1c.
aTodos os pacientes com intenção de tratamento randomizados após determinação da dose do estudo. Última observação realizada (LOCF) foi utilizada para imputar os dados ausentes. Na Semana 52 a eficácia primária estava ausente para 15%, 19% e 20% dos indivíduos randomizados para Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e sitagliptina, respectivamente.
bMédia ajustada dos mínimos quadrados (MQ) para o valor do período inicial e outros fatores de estratificação.
‡Indivíduos incluídos na análise é um subconjunto da população ITT que tiveram pelo menos uma avaliação após o período inicial. A análise primária incluiu 276, 277 e 270 indivíduos randomizados para Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e sitagliptina, respectivamente.
††Multiplicidade ajustada do valor de p unilateral <0,001, para a superioridade de Dulaglutida (substância ativa) comparada com sitagliptina, avaliada somente para HbA1c.
##p<0,001 Dulaglutida (substância ativa) comparado à sitagliptina, avaliada somente para HbA1c<7,0%.
Figura 1: Alteração no ajuste médio de HbA1c em cada período (ITT, MMRM) e na semana 52 (ITT, LOCF)
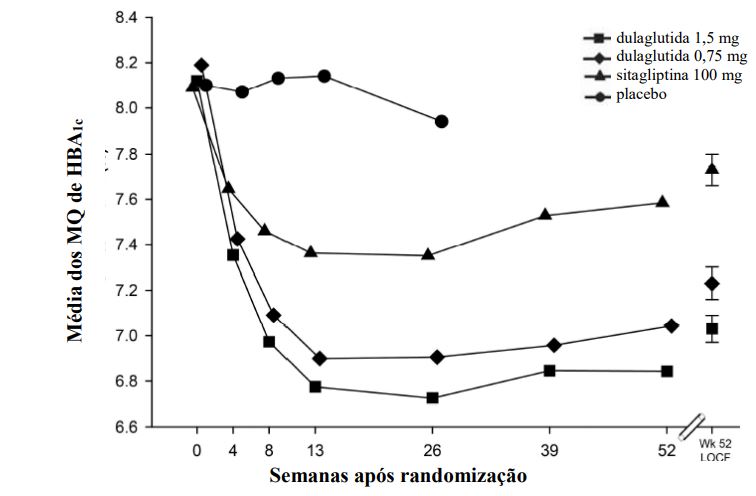
Número de indivíduos com dados observados?
Alteração média a partir do período inicial ajustada para a HbA1c inicial.
MMRM: medida repetida do modelo de efeito misto.
Adicionada à metformina e sulfonilureia
Neste estudo comparativo aberto de 78 semanas (desfecho primário de 52 semanas) (duplo-cego em relação à designação de dose de Dulaglutida (substância ativa)), 807 pacientes foram randomizados e receberam Dulaglutida (substância ativa) 0,75 mg uma vez por semana, Dulaglutida (substância ativa) 1,5 mg uma vez por semana ou insulina glargina uma vez ao dia, todas adicionadas às doses máximas toleradas de metformina e glimepirida.
A randomização ocorreu após um período de 10 semanas; durante as 2 semanas iniciais, os pacientes foram titulados para as doses máximas toleradas de metformina e glimepirida.
Isto foi seguido por um período de estabilização glicêmica de 6 a 8 semanas antes da randomização.
Os pacientes randomizados para insulina glargina iniciaram com uma dose de 10 U uma vez ao dia.
Os ajustes de dose da insulina glargina ocorreram duas vezes por semana pelas primeiras 4 semanas de tratamento com base na glicemia de jejum (GJ) automonitorada, seguida por uma titulação uma vez por semana até a semana 8 do tratamento do estudo, utilizando um algoritmo que objetivava a GJ alvo <100 mg/dL.
Apenas 24% dos pacientes foram titulados para a meta no desfecho primário de 52 semanas. A dose de glimepirida poderia ser reduzida ou descontinuada após a randomização (a critério do investigador) na ocorrência de eventos hipoglicêmicos persistentes.
A dose de glimepirida foi reduzida ou descontinuada em 28%, 32% e 29% dos pacientes randomizados com Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e glargina.
Os pacientes tinham uma idade média de 57 anos, duração média do diabetes tipo 2 de 9 anos, 51% eram do sexo masculino.
Brancos, negros e asiáticos representaram 71%, 1% e 17% da população racial, respectivamente, e 0% da população do estudo era dos Estados Unidos.
O tratamento com Dulaglutida (substância ativa) uma vez por semana resultou em uma redução na HbA1c a partir do período inicial em 52 semanas, quando utilizado em combinação com metformina e sulfonilureia (Tabela 3).
A diferença no tamanho do efeito observado entre Dulaglutida (substância ativa) 0,75 mg e 1,5 mg, respectivamente, e glargina neste estudo excluiu a margem de não inferioridade pré-especificada de 0,4%.
Tabela 3: Resultados do estudo de 52 semanas de Dulaglutida (substância ativa) comparado à insulina glargina, ambas adicionadas à metformina e sulfonilureia a
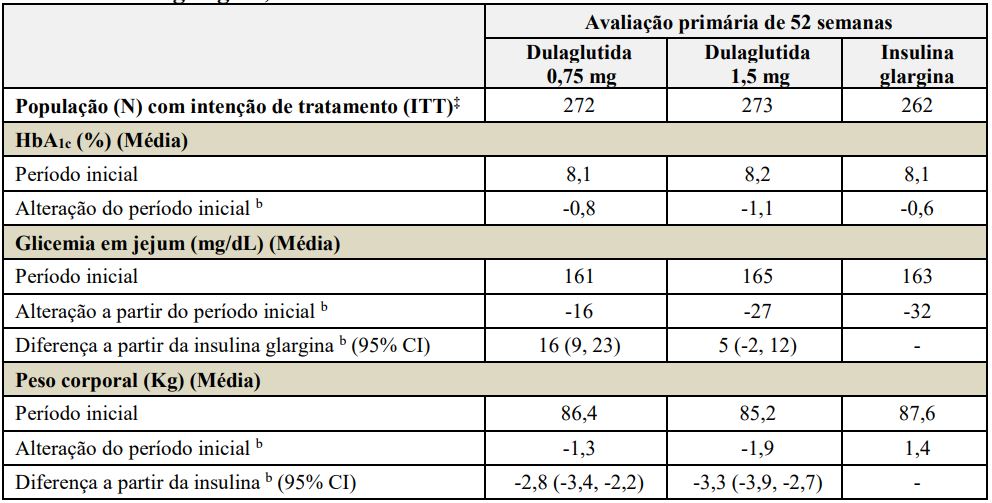
aPopulação com intenção de tratamento. Última observação realizada (LOCF) foi utilizada para imputar os dados ausentes. Dados após o início da terapia de resgate são tratados como ausentes. Na Semana 52, a eficácia primária estava ausente para 17%, 13% e 12% dos indivíduos randomizados para Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e glargina, respectivamente.
bMédia dos mínimos quadrados (MQ) ajustados para o valor inicial e outros fatores de estratificação.
‡Indivíduos incluídos na análise é um subconjunto da população ITT que tiveram pelo menos uma avaliação após o período inicial. A análise primária incluiu 267, 263 e 259 indivíduos randomizados para Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e glargina, respectivamente.
Adicionada à metformina e tiazolidinediona
Neste estudo de 52 semanas controlado por placebo (desfecho primário de 26 semanas), 976 pacientes foram randomizados e receberam placebo, Dulaglutida (substância ativa) 0,75 mg uma vez por semana, Dulaglutida (substância ativa) 1,5 mg uma vez por semana ou exenatida 10 mcg duas vezes ao dia, todos associados às doses máximas toleradas de metformina (?1.500 mg por dia) e pioglitazona (até 45 mg por dia).
Exenatida foi administrada em esquema aberto de tratamento enquanto o tratamento com Dulaglutida (substância ativa) 1,5 mg, Dulaglutida (substância ativa) 0,75 mg e placebo foram cegos. Após 26 semanas, os pacientes no grupo de tratamento com placebo foram randomizados para Dulaglutida (substância ativa) 1,5 mg uma vez por semana ou para Dulaglutida (substância ativa) 0,75 mg uma vez por semana para manter o caráter cego do estudo.
A randomização ocorreu após 12 semanas; durante o período inicial de 4 semanas, os pacientes foram titulados para as doses máximas toleradas de metformina e pioglitazona; isto foi seguido por um período de estabilização glicêmica de 8 semanas antes da randomização.
Os pacientes foram randomizados para exenatida a uma dose inicial de 5 mcg duas vezes ao dia por 4 semanas e, então, titulados para 10 mcg duas vezes ao dia.
Os pacientes tinham uma idade média de 56 anos, duração média do diabetes tipo 2 de 9 anos, 58% eram do sexo masculino.
Brancos, negros e asiáticos representavam 74%, 8% e 3% da população racial, respectivamente, e 81% da população do estudo eram dos Estados Unidos.
O tratamento com Dulaglutida (substância ativa) 0,75 mg e 1,5 mg uma vez por semana resultou em uma redução estatisticamente significativa na HbA1c comparado ao placebo (com 26 semanas) e comparado à exenatida com 26 semanas (Tabela 4 e Figura 2).
Ao longo do período do estudo de 52 semanas, a porcentagem de pacientes que necessitou de resgate glicêmico foi de 8,9% no grupo de tratamento com Dulaglutida (substância ativa) 0,75 mg uma vez por semana com metformina e pioglitazona, 3,2% no grupo de tratamento com Dulaglutida (substância ativa) 1,5 mg uma vez por semana com metformina e pioglitazona, e 8,7% no grupo de tratamento com exenatida duas vezes ao dia com metformina e pioglitazona.
Tabela 4: Resultados do estudo de 26 semanas de Dulaglutida (substância ativa) comparado ao placebo e exenatida, todas adicionadas à metformina e tiazolidinedionaa
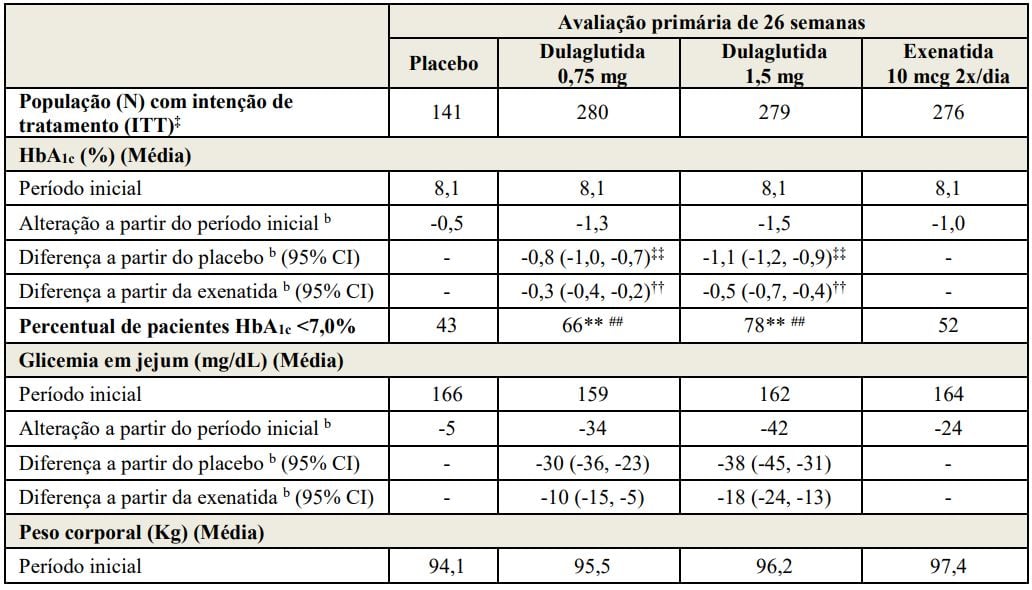
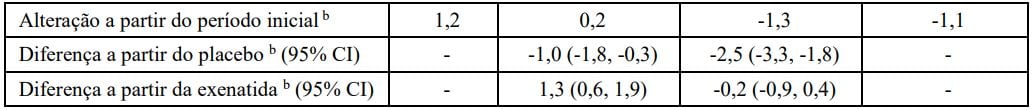
Abreviações: 2x/dia = duas vezes ao dia; HbA1c= hemoglobina A1c.
aPopulação com intenção de tratamento. Última observação realizada (LOCF) foi utilizada para imputar os dados ausentes. Dados após o início da terapia de resgate são tratados como ausentes. Na Semana 26, a eficácia primária estava ausente para 23%, 10%, 7% e 12% dos indivíduos randomizados com placebo, Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e exenatida, respectivamente.
bMédia dos mínimos quadrados (MQ) ajustada para o valor do período inicial e outros fatores de estratificação.
‡Indivíduos incluídos na análise é um subconjunto da população ITT que tiveram pelo menos uma avaliação após o período inicial. A análise primária incluiu 119, 269, 271 e 266 indivíduos randomizados para placebo, Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e exenatida, respectivamente.
‡‡Multiplicidade ajustada do valor p unilateral <0,001, para superioridade de Dulaglutida (substância ativa) comparada ao placebo, avaliada apenas para HbA1c.
††Multiplicidade ajustada do valor p unilateral <0,001, para superioridade de Dulaglutida (substância ativa) comparada à exenatida, avaliada apenas para HbA1c.
**p<0,001 Dulaglutida (substância ativa) comparada ao placebo, avaliado somente para HbA1c<7,0%.
##p<0,001 Dulaglutida (substância ativa) comparada à exenatida, avaliado somente para HbA1c<7,0%.
Figura 2: Alteração no ajuste médio da HbA1c em cada momento (ITT, MMRM) e na semana 26 (ITT, LOCF)
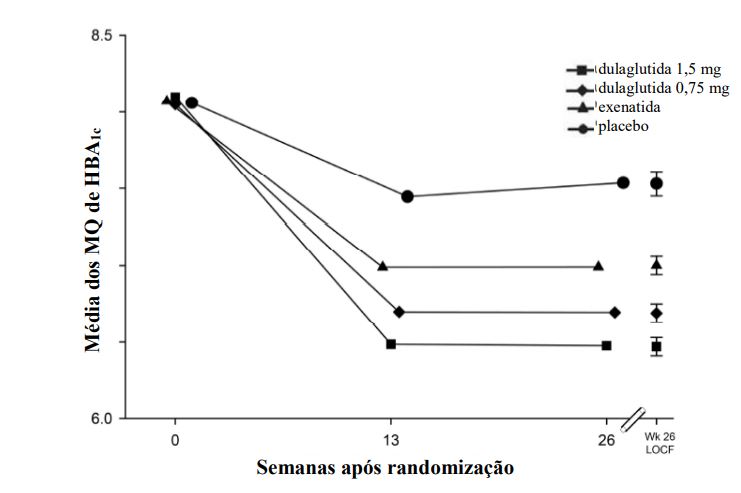
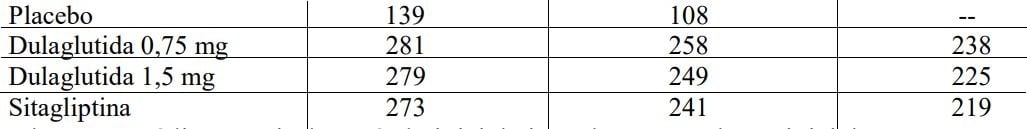
Número de indivíduos com dados observados
| Placebo | 141 | 108 |
| Dulaglutida (substância ativa) 0,75 mg | 280 | 251 |
| Dulaglutida (substância ativa) 1,5 mg | 279 | 259 |
| Exenatida | 276 | 242 |
Alteração média a partir do período inicial ajustada para a HbA1c inicial.
Adicionada à insulina prandial com ou sem metformina
Neste estudo comparativo de 52 semanas (desfecho primário de 26 semanas) (duplo-cego com relação às doses de Dulaglutida (substância ativa)), foram incluídos 884 pacientes com 1 ou 2 injeções de insulina por dia. A randomização ocorreu após um período inicial de 9 semanas; durante as duas semanas iniciais, os pacientes continuaram seu regime de insulina pré-estudo, mas poderiam iniciar e/ou titular a metformina, a critério do investigador; isto foi seguido por um período de estabilização glicêmica de 7 semanas antes da randomização.
Na randomização, os pacientes descontinuaram seu regime de insulina pré-estudo e foram randomizados para Dulaglutida (substância ativa) 0,75 mg uma vez por semana, Dulaglutida (substância ativa) 1,5 mg uma vez por semana ou insulina glargina uma vez ao dia, todos em associação com insulina lispro prandial 3 vezes ao dia, com ou sem metformina.
A insulina lispro foi titulada em ambos os braços com base na glicemia pré-prandial e antes de deitar, e a insulina glargina foi titulada com base na glicemia de jejum de <100 mg/dL.
Apenas 36% dos pacientes randomizados para glargina foram titulados para a meta da glicemia de jejum no desfecho primário de 26 semanas.
Os pacientes tinham uma idade média de 59 anos, duração média do diabetes tipo 2 de 13 anos, 54% eram do sexo masculino. Brancos, negros e asiáticos representaram 79%, 10% e 4% na população racial, respectivamente, e 33% da população do estudo eram dos Estados Unidos.
O tratamento com Dulaglutida (substância ativa) 0,75 mg e 1,5 mg uma vez por semana resultou na redução da HbA1c a partir do período inicial.
A diferença no tamanho do efeito observado entre Dulaglutida (substância ativa) 0,75 mg e 1,5 mg, respectivamente, e glargina neste estudo excluiu a margem de não inferioridade pré-especificada de 0,4%.
Tabela 5: Resultados do estudo de 26 semanas de Dulaglutida (substância ativa) comparado à insulina glargina, ambas em associação com insulina lispro a
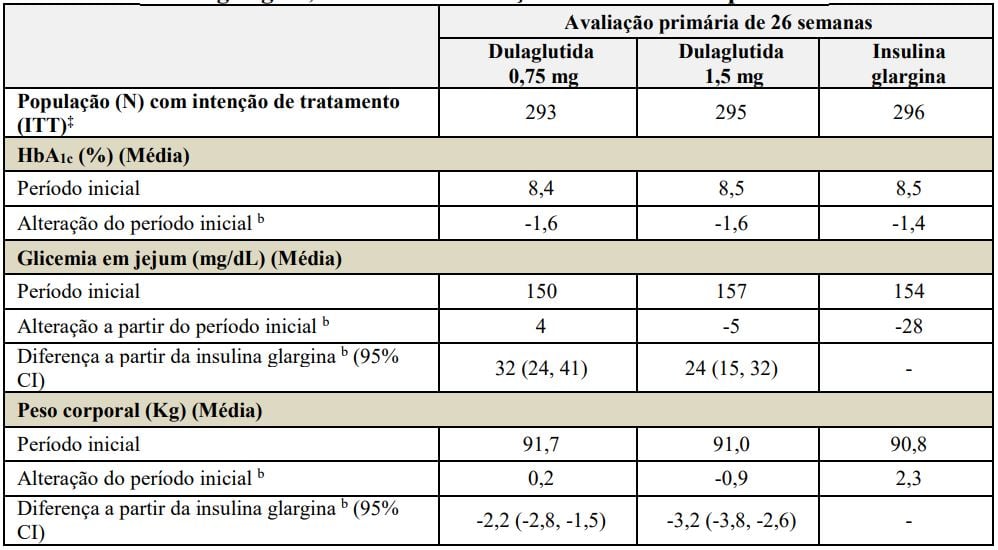
Abreviação: HbA1c= hemoglobina A1c.
aPopulação com intenção de tratamento. Última observação realizada (LOCF) foi utilizada para imputar os dados ausentes. Dados após o início da terapia de resgate são tratados como ausentes. Na Semana 26, a eficácia primária estava ausente para 14%, 15% e 14% dos indivíduos randomizados para Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e glargina, respectivamente.
bMédia dos mínimos quadrados (MQ) ajustada para o valor inicial e outros valores de estratificação.
‡Indivíduos incluídos na análise é um subconjunto da população ITT que tiveram pelo menos uma avaliação após o período inicial. A análise primária incluiu 275, 273 e 276 indivíduos randomizados para Dulaglutida (substância ativa) 0,75 mg, Dulaglutida (substância ativa) 1,5 mg e glargina, respectivamente.
Características farmacológicas
Descrição
Dulaglutida (substância ativa) é um agonista do receptor do peptídeo semelhante ao glucagon (GLP-1) de longaduração que aumenta a secreção de insulina dependente de glicose e reproduz várias outras ações anti-hiperglicêmicas do GLP-1.
A molécula Dulaglutida (substância ativa) consiste de 2 cadeias idênticas unidas por pontes dissulfeto, cada uma contendo uma sequência N-terminal análoga ao GLP-1 ligada covalentemente à porção de uma cadeia pesada (Fc) da imunoglobulina G4 humana modificada (IgG4) por um pequeno peptídeo ligante, que foi produzido utilizando culturas celulares de mamíferos.
A porção análoga de GLP- 1 da Dulaglutida (substância ativa) é 90% homóloga ao GLP-1 humano nativo (7-37). Modificações estruturais foram introduzidas na sequência da molécula de GLP-1 que é responsável pela interação com a enzima dipeptidil-peptidase IV (DPP-4).
Modificações adicionais foram feitas nas áreas potenciais de ligação de epítopos à célula T e nas porções da molécula Fc da IgG4, responsável por ligar aos receptores de alta afinidade da Fc e a formação de anticorpos parciais.
O peso molecular global da Dulaglutida (substância ativa) é aproximadamente 63 quilodaltons.
Mecanismo de ação
A Dulaglutida (substância ativa) é um agonista do receptor peptídeo-1 semelhante ao glucagon (GLP-1) que apresenta várias ações anti-hiperglicêmicas do GLP-1. A Dulaglutida (substância ativa) aumenta o AMP cíclico intracelular (AMPc) nas células beta levando à liberação de insulina na presença de concentrações elevadas de glicose.
A Dulaglutida (substância ativa) restaura a primeira fase da secreção de insulina e melhora a segunda fase de secreção, bem como reduz as concentrações de glucagon em jejum e pós-prandiais e retarda o esvaziamento gástrico.
O GLP-1 natural (7-37) apresenta uma meia-vida de 1,5 a 2 minutos devido à degradação pela DPP-4 e depuração renal.
Em contraste ao GLP-1 natural, a Dulaglutida (substância ativa) é resistente à degradação pela DPP-4 e tem um tamanho maior que lentifica a absorção e reduz a depuração renal. Estas características resultam em uma formulação solúvel e uma meia-vida prolongada de 4,7 dias, o que a torna apropriada para a administração subcutânea uma vez por semana.
Propriedades farmacodinâmicas
A Dulaglutida (substância ativa) melhora o controle glicêmico reduzindo as concentrações de glicose de jejum, pré- refeição e pós-prandiais em pacientes com diabetes mellitus tipo 2.
A melhora no controle glicêmico começa após a primeira administração de Dulaglutida (substância ativa) e é sustentada ao longo do intervalo de administração semanal.
Propriedades farmacocinéticas
Absorção
Após administração subcutânea a pacientes com diabetes mellitus tipo 2, Dulaglutida (substância ativa) atinge concentrações plasmáticas máximas em 48 horas. As exposições máxima média (Cmáx) e área sob a curva total (AUC) foram de aproximadamente 114 ng/mL e 14.000 ng·h/mL, respectivamente, após múltiplas doses subcutâneas de 1,5 mg de Dulaglutida (substância ativa) a pacientes com diabetes mellitus tipo 2.
As concentrações plasmáticas no estado de equilíbrio foram obtidas dentro de 2 e 4 semanas de administração uma vez por semana de Dulaglutida (substância ativa) 1,5 mg.
As exposições após administração subcutânea de doses únicas de Dulaglutida (substância ativa) 1,5 mg no abdome, coxa ou parte superior do braço foram comparáveis.
A biodisponibilidade absoluta média de Dulaglutida (substância ativa) após administração subcutânea única de uma dose de 0,75 mg e 1,5 mg foi de aproximadamente 65% e 47%, respectivamente.
Distribuição
O volume médio de distribuição após administração subcutânea de Dulaglutida (substância ativa) 0,75 mg e 1,5 mg para o estado de equilíbrio em pacientes com diabetes mellitus tipo 2 foi de aproximadamente 19,2 L e 17,4 L, respectivamente.
Metabolismo
Presume-se que a Dulaglutida (substância ativa) seja degradada a seus componentes aminoácidos pelas vias gerais de catabolismo proteico.
Eliminação
O clearance médio aparente de Dulaglutida (substância ativa) em humanos em estado de equilíbrio foi de 0,111 L/h para a dose de 0,75 mg e 0,107 L/h para a dose de 1,5 mg, com uma meia-vida de eliminação de 4,7 dias.
Cuidados de Armazenamento
Você deve manter Trulicity em sua embalagem original sob refrigeração de 2 a 8°C até o momento da utilização. Você pode guardar Trulicity sem refrigeração por até 14 dias, desde que a temperatura não ultrapasse 30°C.
Você pode utilizar Trulicity em até 24 meses após a data de fabricação (data de validade), mas não deve utilizá-lo além de sua data de validade.
Trulicity não deve ser congelado, portanto, você não deve utilizar o medicamento caso ele tenha sido congelado.
Trulicity é fotossensível (sensível à luz) e por isso ele deve ser protegido da luz.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características Físicas
Trulicity é uma solução estéril, límpida e incolor, disponibilizado na forma de caneta para uso único.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Registro MS - 1.1260.190
Farm. Resp.:
Márcia A. Preda - CRF-SP nº 19189
Fabricado por:
Eli Lilly and Company - Indianápolis – EUA
Embalado por:
Eli Lilly Italia S.P.A - Sesto Fiorentino – Itália
Importado e Registrado por:
Eli Lilly do Brasil Ltda..
Av. Morumbi, 8264 - São Paulo, SP - Brasil
CNPJ 43.940.618/0001-44
Venda sob prescrição médica.